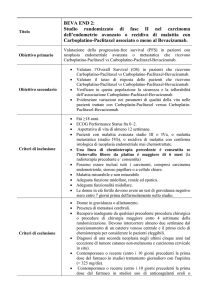
Trattamento di prima linea della Leucemia
Linfoblastica Acuta (LLA) Philadelphia positiva
(Ph+)/BCR/ABL+ con un nuovo potente inibitore
delle Tirosin-chinasi (TKI), AP24534 (Ponatinib).
Studio multicentrico, esplorativo, di fase II in
pazienti di età superiore ai 60 anni o non idonei
al programma intensivo di chemioterapia e
trapianto delle cellule staminali.
EudraCT number 2012-002761-35
Sinossi dell studio GIMEMA LAL1811
Data 07/07/2014
Versione finale 2.0
The protocol will be written and will be conducted in respect of the Helsinki Declaration,
of Good Clinical Practice and of applicable national regulations.
Protocollo LAL1811
Study Responsibilities:
For GIMEMA Foundation:
Sponsor according to European Directives: GIMEMA Foundation, Rome
Study Coordinator Prof. Giovanni Martinelli
Prof. Michele Baccarani and Prof. Fabrizio
Study Co-coordinator Pane
Dpt of specialist, diagnostics and
experimental medicine, “Sant’OrsolaCoordinating Center: Malpighi” University Hospital of Bologna
Writing Committee: Emanuele Angelucci, Nicola Cascavilla,
Giuseppe Cimino, Antonio Curti, Antonio
Cuneo, Paola Fazi, Felicetto Ferrara, Robin
Foà, Ilaria Iacobucci, Mario Luppi, Giovanna
Meloni, Cristina Papayannidis, Giovanni
Pizzolo, Giuseppe Saglio, Nicoletta Testoni,
Adriano Venditti, Marco Vignetti, Antonella
Vitale, Giuseppe Visani
Study and Project Management: GIMEMA Data Center, Roma
ALWP GIMEMA Chairman Prof. Sergio Amadori
Legal representative of the GIMEMA Foundation: Prof. Franco Mandelli
Versione finale 2.0
Data 07/07/2014
2/7
Protocollo LAL1811
Trattamento di prima linea della Leucemia Linfoblastica Acuta (LLA) Philadelphia
positiva (Ph+)/BCR/ABL+ con un nuovo potente inibitore delle Tirosin-chinasi (TKI),
AP24534 (Ponatinib). Studio multicentrico, esplorativo, di fase II in pazienti di età
superiore ai 60 anni o non idonei al programma intensivo di chemioterapia e trapianto
delle cellule staminali.
EudraCT number 2012-002761-35
Fase dello Studio: 2
Obiettivo dello studio:
L’obiettivo dello studio è valutare gli effetti terapeutici di Ponatinib nei pazienti affetti LLA Ph+ che
abbiano 60 o più anni o che non siano idonei per chemioterapia e trapianto di cellule staminali. Poiché in
questi pazienti, la percentuale di Remissione Ematologica Completa con altri TKI è già prossima al 100%,
ma il tasso di recidiva a un anno è del 50% o più, lo scopo dello studio è indurre una migliore e più
lunga remissione.
Obiettivi secondari:
Valutare:
La Risposta Ematologica Completa (CHR) a 6, 12, 24, 36 e 48 settimane.
La Risposta Citogenetica Completa (CCgR) a 6, 12, 24, 36 e 48 settimane e la durata della CCgR.
La Risposta Molecolare Completa (CMolR) e la Risposta Molecolare Maggiore (MMR) a 12, 24, 36
e 48 settimane, e la durata della CMolR.
Il tipo ed il numero di mutazioni del dominio della chinasi BCR-ABL che si sviluppano durante e dopo
lo studio.
La relazione tra la risposta ed i biomarkers.
Event Free Survival (EFS).
Overall Survival (OS).
Failure Free Survival (FFS).
La tossicità del trattamento.
Versione finale 2.0
Data 07/07/2014
3/7
Protocollo LAL1811
Disegno dello Studio: questo è uno studio multicentrico, di fase 2, a singolo braccio, in aperto con
Ponatinib, assunto per via orale in pazienti con Leucemia Linfoblastica Acuta Philadelphia Positiva. I
pazienti riceveranno giornalmente una somministrazione orale di Ponatinib alla dose di 45 mg/die per 6
settimane (definito come un ciclo) per 8 cicli, allo stesso dosaggio e schema, per un totale di 48 settimane.
Ogni paziente sarà seguito per i successivi 24 mesi, raccogliendo, ogni 3 mesi, informazioni sulla
sopravvivenza e monitorando, ogni 3 mesi, gli eventi avversi gravi occorsi. Ogni paziente dovrebbe essere
trattato per un minimo di 6 settimane. Successivamente il paziente può interrompere il trattamento nelle
seguenti situazioni:
- alla fine del primo ciclo (6 settimane), in caso di mancata CHR;
- alla fine del terzo ciclo (18 settimane), in caso di mancata CCgR;
- in qualsiasi momento in caso di perdita della CHR o della CCgR.
Se i pazienti rimarranno in terapia dopo le 48 settimane, potranno continuare il trattamento durante la
fase di estensione dello studio, se nell’interesse del paziente, o potranno ricevere qualsiasi trattamento che
sia nel loro interesse. In tutti i pazienti che rimarranno nello studio, per i successivi 24 mesi, saranno valutati
risposta, esito e tossicità. La periodicità di 6 settimane deve essere rigorosamente rispettata,
indipendemente dalla temporanea interruzione del farmaco sperimentale (es: se un paziente assumerà
Ponatinib solo per 4 settimane e rimarrà fuori trattamento per le successive 2 settimane a causa di un
evento avverso, quando inizierà la 7° settimana questo paziente ricomincerà Ponatinib come secondo ciclo,
in accordo col protocollo). Prednisone (P) sarà somministrato a tutti i pazienti per 7-14 giorni, prima di
Ponatinib, in modo che sia possibile attendere i risultati degli esami citogenetici e molecolari, e valutare la
risposta al solo Prednisone, e sarà somministrato, quindi, per ulteriori 21 giorni. La terapia intratecale (IT)
con Metotressato/Ara-C/Desametasone è obbligatoria, ogni 28 giorni, nei pazienti senza evidenza clinicocitologica di un coinvolgimento meningeo. Nei pazienti con una patologia del Sistema Nervoso Centrale, la
terapia intratecale sarà effettuata due volte a settimana fino a raggiungere la completa clearance del
fluido cerebrospinale dai blasti cellulari, successivamente una volta a settimana per quattro settimane e poi
mensilmente.
Versione finale 2.0
Data 07/07/2014
4/7
Protocollo LAL1811
Popolazione:
Criteri di inclusione:
1. I pazienti, per essere classificati come affetti da LAL Ph+, devono avere, al momento della diagnosi,
una concentrazione di blasti nel midollo osseo >20% e non devono presentare una precedente storia di
Leucemia Mieloide Cronica (CML).
2. Pazienti con una LAL Ph+ and/or BCR/ABL + precedentemente non trattata:
-
di età ≥ 60 anni
-
di età ≥ 18 anni, ma non eleggibili per un programma di terapia intensiva o per un trapianto
allogenico di cellule staminali
3. Adeguata funzionalità epatica come definito dai seguenti criteri:
-
bilirubina sierica totale ≤1.5 volte al di sopra dei limiti normali, se non causata dalla sindrome di
Gilbert
-
alanino aminotranferasi (ALT) ≤ 2.5 volte al di sopra dei limiti normali
-
aspartato aminotrasferasi (AST) ≤ 2.5 volte al di sopra dei limiti normali.
4. Funzionalità pancreatica adeguata come definita dal seguente criterio:
-
lipasi sierica ed amilasi ≤1.5 volte al di sopra dei limiti normali.
5. Per le donne potenzialmente fertili un test di gravidanza negativo deve essere documentato prima
della randomizzazione.
6. Per i soggetti maschi e per le femmine potenzialmente fertili, consenso all’uso di una contraccezione
efficace con i loro partner sessuali dalla randomizzazione ai 4 mesi successivi alla fine del trattamento
7. Consenso informato scritto in accordo con le ICH/EU/GCP e la normativa locale nazionale.
Criteri di esclusione:
1. Performance status WHO ≤ 50% (Karnofsky) o ≥ 3 (ECOG).
2. Epatite attiva da virus HBV o HCV, o AST/ALT ≥ 2.5 x ULN e bilirubina ≥ 1.5 x ULN.
3. Anamnesi di pancreatite acuta entro un anno dall’inizio dello studio o anamnesi di pancreatite cronica.
4.
Storia di abuso di alcool.
5.
Infezioni in corso o attive.
6. Ipertrigliceridemia incontrollata (trigliceridi >450 mg/dL).
7. Patologia cardiovascolare, clinicamente significativa, incontrollata o attiva, comprendente nello
specifico, ma non limitatamente:
-
storia di infarto miocardico, ictus o rivascolarizzazione
-
pregressa angina instabile o attacco ischemico transitorio nei 6 mesi precedenti l'arruolamento
-
pregressa Insufficienza cardiaca congestizia nei 6 mesi precedenti l'arruolamento o pregressa
frazione di eiezione ventricolare sinistra (FEVS) minore del limite inferiore standard nei 6 mesi
Versione finale 2.0
Data 07/07/2014
5/7
Protocollo LAL1811
precedenti l'arruolamento
-
storia di aritmia atriale clinicamente significativa (come stabilito dal medico curante)
-
Storia di aritmia ventricolare
-
Storia di tromboembolismo venoso tra cui trombosi venosa profonda o embolia polmonare.
8. Ipertensione non controllata (pressione diastolica> 90 mmHg; sistolica> 140 mm Hg). I pazienti con
ipertensione dovrebbero essere trattati dall'ingresso nello studio per mantenere controllo della
pressione arteriosa.
9. Assunzione di farmaci che sono noti per essere associati con Torsione di Punta.
10.Assunzione di farmaci o integratori a base di erbe, noti come forti inibitori del CYP3A4, non successiva
al 14° giorno precedente all’ assunzione della prima dose di ponatinib.
11. Livello di creatinina> 2.5mg/dl o filtrazione glomerulare (GFR) <20 ml/min o proteinuria >3,5 g/die.
12.Deficit della funzione gastrointestinale, o presenza di una patologia gastrointestinale che possa alterare
significativamente l’assorbimento dei farmaci in studio
(ad esempio rari problemi ereditari di
intolleranza al galattosio, deficit di Lapp lattasi o malassorbimento di glucosio-galattosio, sindrome da
malassorbimento grave o estesa resezione chirurgica dell’intestino tenue).
13.Pazienti che stanno attualmente ricevendo un trattamento con una qualsiasi delle terapie elencate
nell’Appendix E, qualora le terapie non possono essere interrotte o cambiate con una differente terapia
prima di iniziare il farmaco sperimentale. I farmaci elencati nell’Appendix E possono potenzialmente
prolungare il tratto QT.
14.Pazienti che abbiano ricevuto qualsiasi farmaco sperimentale nelle precedenti 4 settimane.
15.Pazienti che siano stati sottoposti a chirurgia maggiore nelle due settimane precedenti l’inizio del
farmaco sperimentale o che non siano guariti dagli effetti collaterali di un simile terapia.
16.Donne in gravidanza o che allattano al seno e adulti potenzialmente fertili che non utilizzano un efficace
metodo di barriera per il controllo delle nascite (Le donne potenzialmente fertili devono eseguire un test
di gravidanza che risulti negativo entro le 48 ore precedenti la somministrazione di Ponatinib). Le
donne in menopausa non devono aver avuto il ciclo mestruale nei 12 mesi prima dell’inizio della terapia
per essere considerate come non potenzialmente fertili. Uomini e donne devono essere d’accordo ad
utilizzare una efficace metodica contraccettiva di barriera durante lo svolgimento dello studio e per 4
mesi successivi all’ultima somministrazione del farmaco sperimentale.
17.Pazienti con anamnesi di un’altra neoplasia maligna primitiva che risulti clinicamente significativa o che
richieda attualmente un intervento attivo.
18.Pazienti non disposti o incapaci di attenersi al protocollo.
Trattamento:
I pazienti riceveranno giornalmente una somministrazione orale di Ponatinib alla dose di 45 mg/die per 6
settimane (definito come un ciclo) per 8 cicli, allo stesso dosaggio e schema, per un totale di 48 settimane.
Versione finale 2.0
Data 07/07/2014
6/7
Protocollo LAL1811
Ogni paziente sarà seguito per i successivi 24 mesi, ogni 3 mesi, raccogliendo informazioni sulla
sopravvivenza e monitorando gli eventi avversi gravi. Ogni paziente dovrebbe essere trattato per un
minimo di 6 settimane. Una volta che la risposta ematologica completa è stata raggiunta, con una conta
piastrinica ≥ 50x109 / L, i pazienti possono essere trattati con aspirina e / o con una statina, come indicato
clinicamente, al discrezione dello sperimentatore.
Dimensione del Campione:
Basandosi sulla precedente esperienza GIMEMA con Imatinib nella stessa popolazione (Vignetti et al, Blood
2007;109:3676-8) ci si attende che la proporzione di pazienti che dovrebbe essere in CHR a 6 mesi sia
del 55% con Imatinib. L’ipotesi da testare è che il 75% dei pazienti sarà in CHR a 6 mesi usando Ponatinib.
La dimensione del campione è calcolata usando la “Sample size tables for exact single-stage phase II
design” (A’Hern RP, Statistics in Medicine 2001;20:859-866). Assumendo che la proporzione di pazienti che
sono in CHR a 6 mesi trattati solo con Imatinib sia del 55% (P0) (Vignetti et al, Blood 2007;109:3676-8), il
numero di pazienti richiesto per valutare un aumento della proporzione dei pazienti che sono in CHR da
55% (P0) a 75% (P1), con = 0.05 e 1 - = 0.80 è 37. Se il numero di risposte sarà ≥26, l’ipotesi che
P1 ≤ 55% sarà rifiutata. Se il numero di risposte sarà < 25 l’ipotesi che P1 ≥ 75% sarà rifiutata. Il valore
stabilito del numero di pazienti da arruolare è aggiustato a 44, tenendo conto di un 20% di dropout e
violazioni di protocollo.
Durata dello Studio: (arruolamento + durata della terapia + follow-up) circa 5 anni.
Versione finale 2.0
Data 07/07/2014
7/7