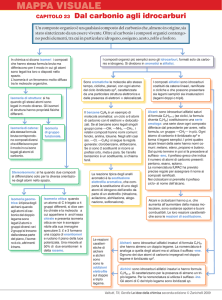
GLI IDROCARBURI
Gli idrocarburi sono i più semplici composti del carbonio con
l'idrogeno.
Sono le molecole di base della chimica organica poiché, oltre ad
essere molto numerosi, tutti gli altri composti si possono
considerare come derivati da essi per sostituzione di un atomo di
idrogeno con un cosiddetto
gruppo funzionale, quel
gruppo chimico, cioè, che conferisce al composto proprietà
caratteristiche, diverse da quelle dell'idrocarburo di origine e
peculiari di una classe di composti.
Idrocarburi
Alifatici
Aromatici
Gli idrocarburi vengono classificati,
secondo la nomenclatura tradizionale,
in
alifatici quando sono costituiti da catene lineari o
ramificate;
aromatici quando presentano una particolare
struttura ciclica, tipo benzene.
Idrocarburi
Alifatici
Alcani
Aromatici
Alcheni
Alchini
Idrocarburi
Alifatici
Alcani
Gli alcani sono
idrocarburi che
contengono solo
legami singoli
H
H
H
C
C
H
H
H
Idrocarburi
Alifatici
Gli alcheni sono
idrocarburi caratterizzati
dalla presenza di un
doppio legame.
H
H
Alcheni
C
H
C
H
Idrocarburi
Alifatici
Gli alchini sono idrocarburi
caratterizzati dalla
presenza di un triplo
legame.
Alchini
HC
CH
Idrocarburi
I composti aromatici o
areni più diffusi
contengono l’anello
benzenico.
Aromatici
H
H
H
H
H
H
Centri reattivi o gruppi funzionali negli
Idrocarburi
Gruppi funzionali
Il gruppo funzionale è l’unità strutturale presente
in una molecola responsabile del suo
comportamento chimico
Gruppi funzionali negli idrocarburi
alcani
alcheni
alchini
areni
RH
doppio legame
triplo legame
ArH
Alcani
R—H
Il gruppo funzionale è l’idrogeno
Alcani
R—H
R—X
Il gruppo funzionale è l’idrogeno
negli alcani hanno luogo reazioni di sostituzione
un idrogeno è sostituito da un altro atomo
o gruppo atomico
H
H
H
C
C
H
H
H + Cl2
H
H
H
C
C
H
H
Cl + HCl
Alcani
L’alcano più semplice ha 1 atomo di carbonio
e 4 atomi di idrogeno (CH4)
Il suo nome è metano
La formula generale degli alcani è
CnH2n+2
Gli atomi di carbonio sono tutti ibridati sp3
La geometria di tutti gli atomi di carbonio è
tetraedrica (angoli di 109,5°)
La molecola è formata esclusivamente da
legami di tipo σ
14
La serie omologa
La serie degli alcani rappresenta una serie omologa
Ciascun composto ha un atomo di carbonio in più (la catena si
allunga)
Le proprietà fisiche variano con una certa regolarità (massa, p.f.,
p.e., solubilità)
Certe proprietà chimiche vengono esaltate altre si affievoliscono
Pentano (C5H12 CH3-CH2- CH2- CH2- CH3)
Esano (C6H14 CH3-CH2- CH2- CH2- CH2 -CH3)
Eptano (C7H16 CH3-CH2- CH2- CH2- CH2 -CH2 -CH3)
Ottano (C8H18 CH3-CH2- CH2- CH2- CH2 -CH2 -CH2 -CH3)
15
Cicloalcani
I cicloalcani sono idrocarburi alifatici che, a partire dal
propano, possono chiudere la catena di atomi di
carbonio con la perdita di due atomi di idrogeno.
La formula generale dei cicloalcani è CnH2n.
16
Cicloalcani
La formula generale dei cicloalcani è
CnH2n
Dove n =3, 4, ecc.
Tutti gli atomi di carbonio sono ibridati sp3
Tutti i legami sono di tipo σ
Gli angoli dovrebbero essere tetraedrici
(109,5°)
H
H
CH2
C
C3H6
H
C
C
H
H
H
H2C
60°
CH2
17
La serie
Gli angoli di legame aumentano come
aumentano gli atomi di carbonio
Quando diventano 6 gli angoli sono quelli
tipici tetraedrici
ciclobutano
H2C
CH2
H2C
CH2
ciclopentano
cicloesano
CH2
CH2
H2C
H2C
CH2
CH2
H 2C
CH2
H 2C
CH2
CH2
18
Il cicloalcano più interessante dal punto di vista biologico
è il cicloesano, che presenta due strutture possibili: a
sedia (più stabile) e a barca (meno stabile).
Valitutti,Tifi, Gentile, Esploriamo la chimica © Zanichelli editore 2010
19
CnH2n+2
Introduzione allo studio degli alcani:
Metano, Etano, e Propano
I cicloalcani
CnH2n
Gli alcani più semplici
Metano (CH4)
CH4
Etano (C2H6)
CH3CH3
Propano (C3H8)
CH3CH2CH3
bp -160°C
bp -89°C
bp -42°C
Strutture di
Lewis H
CH4
C
H
(etano)
Formula condensata
CH3 CH3
C 3H 8
(propano)
Formula condensata
CH3 CH2 CH3
C4H10
(butano)
H
H
(metano)
C 2H 6
CnH2n+2
H
H
H H
H
H C C H
H H
H
H
H
H C
H
C
C
H
H
Formula condensata
H
CH3 CH2 CH2 CH3
22
ISOMERIA
A PARTIRE DAI COMPOSTI CON QUATTRO
ATOMI DI CARBONIO, COME PER IL
BUTANO, GLI ALCANI PRESENTANO IL
FENOMENO DELL’ISOMERIA
COSTITUZIONALE O DI CATENA.
23
ISOMERI
GLI ISOMERI SONO MOLECOLE CHE
PRESENTANO LA STESSA FORMULA
BRUTA, MA DIVERSA FORMULA DI
STRUTTURA E DIVERSE
CARATTERISICHE FISICHE E CHIMICHE
24
25
C4H10
ALCANI ISOMERICI: I BUTANI
n-Butano
Isobutano
CH3CH2CH2CH3
CH3 CH CH3
CH3
bp -0.4°C
bp -10.2°C
ISOBUTANO PRESENTA STESSA
FORMULA BRUTA DEL BUTANO , MA
DIVERSA STRUTTURA
28
GLI ISOMERI DI FORMULA C5H12
C5H12
CH3CH2CH2CH2CH3
CH3 CH CH2 CH3
CH3
Isopentano
n-Pentano
carboni primari e secondari
carboni primari secondari e terziari
CH3
CH3 C CH3
carboni primari e quaternari
CH3
Neopentano
Quanti sono gli Isomeri?
Il numero di isomeri di un alcano aumenta
all’aumentare del numero di atomi di carbonio.
Non esiste un modo semplice per predire il
numero di isomeri possibili per una
determinata formula bruta
Tabella
Numero di Isomeri costituzionali degli Alcani
CH4
C2H6
C3H8
C4H10
C5H12
C6H14
C7H16
1
1
1
2
3
5
9
Tabella
Numero di Isomeri costituzionali degli Alcani
CH4
C2H6
C3H8
C4H10
C5H12
C6H14
C7H16
1
1
1
2
3
5
9
C8H18
C9H20
C10H22
C15H32
C20H42
C40H82
18
35
75
4,347
366,319
62,491,178,805,831
NATURA DEGLI ATOMI DI
CARBONIO
I carboni di una catena si identificano in primari,
secondari, terziari o quaternari a seconda che siano
legati rispettivamente a uno, due, tre o quattro atomi
di carbonio.
Posizione e tipologia degli atomi di carbonio nella catena
idrocarburica
Il carbonio terminale della catena idrocarburica lineare e/o
ramificata è detto carbonio primario.
Nel metano e nell’etano esistono solo atomi di carbonio
primari.
Nel propano ognuno dei due atomi di carbonio
terminale della catena idrocarburica è detto
carbonio primario, perché contrae un solo
legame con un altro atomo di carbonio;
quello centrale è un carbonio secondario,
perché contrae legami con i due atomi di
carbonio adiacenti.
BUTANO
Il carbonio centrale dell’isobutano è un carbonio
terziario, perché contrae tre legami singoli con i tre
atomi di carbonio adiacenti.
Quello centrale del neo pentano è detto carbonio
quaternario, perché contrae tutti e quattro i legami
semplici possibili con altrettanti atomi di carbonio
a lui adiacenti nella molecola.
Il carbonio