Stato gassoso
I gas:
• Sono privi di forma e di volume definiti
• Si diffondono con molta facilità
• Si lasciano agevolmente comprimere
• A temperatura ambiente hanno una bassissima densità
Grande libertà di movimento, notevole energia cinetica, deboli forze attrattive.
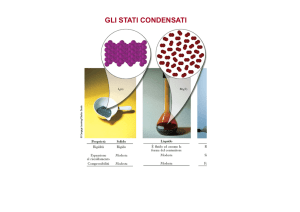
Stato liquido
Un liquido non ha una sua forma definita, ma assume quella del recipiente che lo contiene.
Sono presenti forze attrattive.
Rispetto ai gas, i liquidi possiedono:
• Maggiore densità
• Pochissima comprimibilità
• Limitata diffusione nell’ambiente
A parità di volume, un liquido ha massa maggiore rispetto ad un gas. Il gran numero di urti tra molecole
diminuisce l’energia cinetica. Le uniche molecole che si diffondono sono quelle in superficie, perché soggette
a forze attrattive minori.
Tensione di vapore
Un gas, se raffreddato a sufficienza, liquefa, mentre un liquido riscaldato evapora.
Un liquido evapora a qualsiasi temperatura, perché alcune particelle hanno un’energia cinetica superiore alla
media e riescono a passare allo stato di vapore, che è energeticamente più ricco.
Le particelle di vapore con energia più bassa posso passare allo stato liquido (condensazione).
Aumentando la temperatura viene favorita l’evaporazione, diminuendola viene favorita la condensazione.
Un liquido lasciato in un recipiente aperto evapora completamente.
In un recipiente ben tappato, si raggiunge un certo equilibrio tra vapore e liquido: il numero di particelle che
evaporano è equilibrato da quelle che condensano (equilibrio dinamico) e il vapore è detto saturo.
Si definisce tensione di vapore la pressione esercitata sul liquido sottostante dal vapore saturo che si trova
in uno stato di equilibrio col liquido. Tale valore dipende solo dalla natura chimica e dalla temperatura del
liquido. La tensione di vapore è elevata per i liquidi volatili.
La tensione di vapore di un liquido evidenzia la sua tendenza a passare allo stato aeriforme.
Punto di ebollizione: tensione di vapore uguale a pressione atmosferica.
Quando l’acqua bolle, la tensione di vapore è maggiore di 760 mmHg
Stato solido
I solidi possiedono una loro forma. Notevoli forze attrattive e posizioni fisse.
Le proprietà caratteristiche dei solidi sono:
• La rigidità
• La scarsa dilatabilità
• Un volume quasi costante (azione repulsiva tra le nubi elettroniche degli atomi)
• La formazione di strutture ordinate, chiamate cristalli (se un solido non è cristallino, non è un vero solido e
si chiama solido amorfo)
Cristalli
Corpi di forma geometrica ben definita, tipica della specie chimica di appartenenza, determinata da uno schema
preciso, ordinato e ripetuto.
Molti solidi hanno struttura microcristallina ossia composta da piccoli cristalli, la cui formazione è stata
vicendevolmente disturbata.
Reticolo ionico (NaCl): uno ione positivo circondato da 6 negativi e viceversa. Non esistono spazi vuoti. Non
conduce elettricità, a meno che sia fuso.
1
Reticolo covalente(Diamante): ogni carbonio è circondato da altri 4. Struttura compatta a tetraedro. Buon
conduttore di elettricità perché gli elettroni non coinvolti nei legami sono mobili.
Reticolo metallico: struttura esagonale o cubica, in cui ogni ione è circondato da una nube di elettroni di
valenza. Ottimo conduttore elettrico. I metalli sono plastici, duttili, malleabili. Proprietà molto varie.
In questi reticoli non ha senso parlare di molecole.
Reticolo molecolare: i nodi sono occupati da molecole, che si uniscono con forze intermolecolari (legami di
Van Der Waals e interazioni dipolari). Quasi tutte le sostanze organiche e le inorganiche che a temperatura
ambiente risultano liquide o gassose dispongono di un reticolo molecolare.
Legame metallico: i nodi sono occupati dagli ioni positivi del metallo che, a loro volta, sono circondati da
elettroni sia condivisi tra gli ioni, sia mobili.
Sostanze amorfe isotrope presentano proprietà fisiche costanti in qualsiasi direzione vengano considerate.
Legame covalente
Legame ionico
Metalli
Bassa energia di ionizzazione
Bassa elettronegatività
Non metalli
Metalli di transizione
Caratteristiche
Grande raggio atomico
Alta energia di ionizzazione
Alta elettronegatività
Piccolo raggio atomico
Legame ionico
o
Legame covalente molto polare
2