LEZIONE 004 – Gli stati di aggregazione
TITOLO: GLI STATI DI AGGREGAZIONE
La materia è costituita da aggregati di particelle submicroscopiche (atomi, molecole, ioni); a
seconda della loro distanza e della loro libertà di movimento, a livello macroscopico la materia
si presenta in tre stati di aggregazione:
-
lo stato solido
possiede forma e volume propri
-
lo stato liquido
possiede solo un volume
-
lo stato aeriforme (gas o vapore)
non possiede forma e volume
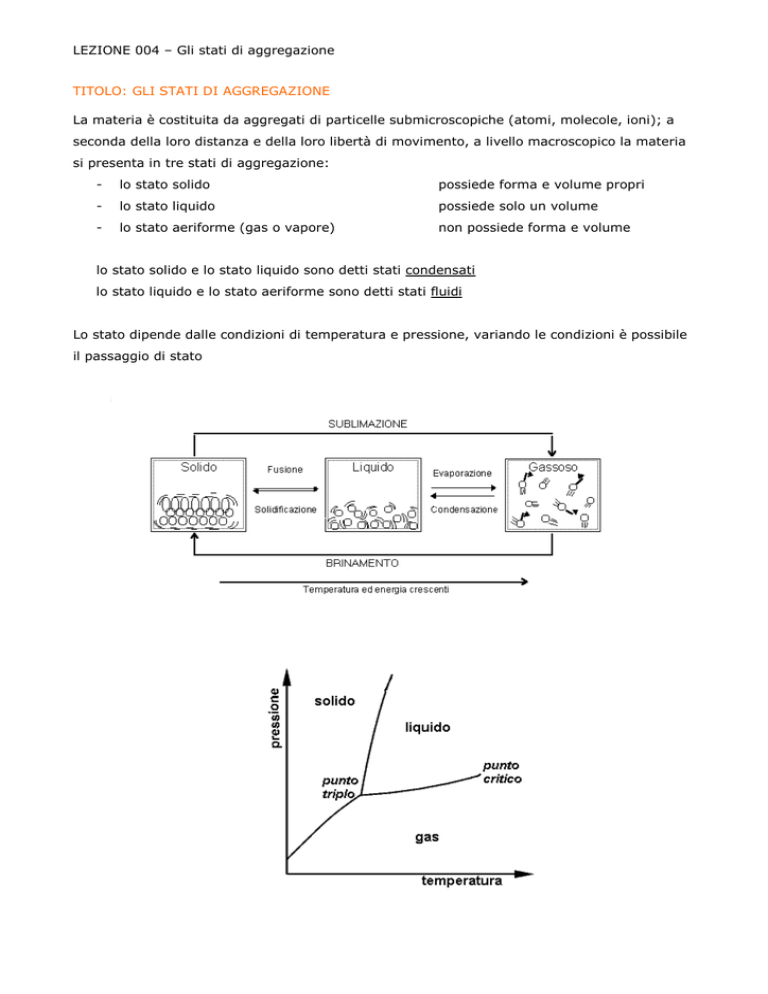
lo stato solido e lo stato liquido sono detti stati condensati
lo stato liquido e lo stato aeriforme sono detti stati fluidi
Lo stato dipende dalle condizioni di temperatura e pressione, variando le condizioni è possibile
il passaggio di stato
LEZIONE 004 – Gli stati di aggregazione
TEORIA CINETICA E CORPUSCOLARE DELLA MATERIA
Spiega l’effetto che temperatura e pressione esercitano sulla materia.
a) tutta la materia è composta da particelle
b) le particelle sono in movimento costante
c) tutte le collisioni sono elastiche (non si verifica cambiamento nell’energia cinetica totale
di due particelle)
URTI DELLE MOLECOLE
A temperatura ambiente le molecole di un gas sono dotate di elevata velocità e le collisioni
fra le molecole sono frequenti.(N°collisioni, velocità, percorso variano al variare della
temperatura e della massa) A temperatura ambiente (25 °C) la velocità media di una
molecola di O2 è di 443 m/sec
PRESSIONE
Forza e il numero di collisioni contro la parete del recipiente.
Le molecole urtano l’una contro l’altra, ma anche contro le pareti del recipiente.
Pressione: è il rapporto tra la forza esercitata perpendicolarmente ed uniformemente su
una superficie e l'area della superficie stessa.
La pressione atmosferica è la pressione esercitata dall'aria sui corpi e si misura in
atmosfere ed è uguale alla pressione esercitata dall'aria su una colonna di mercurio alta 1
metro.
1 atm. = 101,325 KPa = 1,013 * 105 Pa = 760 mm Hg = 760 torr =1,013 bar=1013 mb












