Lezione
Il Secondo Principio
1
Cicli termodinamici e macchine termiche
La termodinamica è storicamente nata per studiare la possibilità di ricavare
energia meccanica (lavoro) dal calore, per esempio sfruttando la pressione dei
gas per muovere pistoni. La necessità di produrre energia meccanica in modo
continuativo e non sporadico porta allo studio di macchine cicliche, sistemi che
subiscono una definita sequenza di trasformazioni tornando periodicamente allo
stato iniziale.
L’esempio tipico è un cilindro riempito di gas e chiuso ermeticamente da
un pistone. Il gas può espandersi scambiando lavoro con l’esterno attraverso il
pistone, e può eventualmente scambiare calore con l’esterno attraverso le pareti
del cilindro.
Come sistema sottoposto a un ciclo di trasformazioni studieremo, al solito,
il caso idealizzato di una quantità fissata di gas perfetto. Le trasformazioni
che il gas subisce saranno in genere irreversibili, ma noi considereremo quasi
esclusivamente il caso limite di trasformazioni reversibili, dunque infinitamente
lente.
Un sistema sottoposto a un ciclo termoodinamico torna per definizone allo
stato termodinamico iniziale al termine del ciclo stesso. Dunque la variazione netta delle variabili di stato e di tutte le funzioni di stato sarà nulla. In
particolare, l’energia interna del sistema sarà tornata al valore iniziale:
∆U = 0
Dal primo principio della termodinamica sappiamo dunque che
∆Q = ∆L
Il lavoro compiuto dal sistema verso l’esterno deve essere uguale al calore assorbito. Per ottenere lavoro è necessario fornire calore al sistema, e uno dei modi
più semplici è metterlo in contatto con una “sorgente calda” che cedendo calore
al sistema fa per esempio espandere il gas, e muovere il pistone. Per far tornare
il sistema allo stato originale si dovrà però successivamente comprimere il gas;
questo potrebbe per esempio essere ottenuto raffreddandolo, e dunque facendogli cedere calore all’esterno attraverso il contatto con una “sorgente fredda”.
La macchina sarà tanto migliore quanto maggiore sarà il rapporto tra il lavoro
compiuto e il calore fornito dalla sorgente calda (che rappresenta se vogliamo il
“consumo” in termini per esempio di combustibile)
1
1.1
Lavoro compiuto da un gas in un ciclo reversibile
Se rappresentiamo lo stato del sistema costituito da una certa quantità di gas
perfetto come un punto nel diagramma p, V , abbiamo che una trasformazione
ciclica è rappresentata da una curva chiusa se il ciclo è costituito di trasformazioni reversibili. In quel caso, come sappiamo, il lavoro compiuto dal sistema
durante un ciclo
p V Figura 1: Ciclo generico reversibile rappresentato nel diagramma p, V di un gas
perfetto. Il lavoro compiuto dal gas è pari all’area racchiusa dalla curva, presa
con il segno positivo se il ciclo è percorso in senso orario.
I
∆L =
p dV
H
è rappresentato dall’area racchiusa dalla curva nel piano p, V (il simbolo si
usa per indicare gli integrali lungo linee chiuse). Dal primo principio sappiamo
anche che questo sarà il calore netto ∆Qin − ∆Qout assorbito dal gas, ma non
sappiamo a priori quanto valga il calore assorbito e quanto quello ceduto.
2
Il ciclo di Carnot
Il modo più semplice di ottenere un ciclo in cui tutte le quantità rilevanti sono
facilmente calcolabili è quello di limitare gli scambi di calore del sistema all’interazione con due soli corpi esterni o sorgenti di calore, e di considerare il caso
limite di trasformazioni reversibili.1
Chiamiamo bagno termico o serbatoio termico un corpo caratterizzato da una
capacità termica enormemente più grande rispetto a quella del sistema studiato,
cosicché la sua temperatura si possa considerare costante indipendentemente dal
calore che cede o assorbe. Un corpo a contatto con il bagno termico scambia
calore con quest’ultimo fino ad arrivare alla sua temperatura.
Consideriamo dunque un gas perfetto a cui è permesso scambiare calore con
l’esterno solo attraverso il contatto con un bagno termico a temperatura assoluta
1 L’utilità
dal punto di vista della fisica di considerare un ciclo reversibile che non sarà mai
realizzabile nella pratica è in realtà quella di stabilire un caso limite, come sarà più chiaro in
seguito.
2
T1 (sorgente fredda) o con un altro bagno termico a temperatura maggiore T2
(sorgente calda).
Mettiamo il gas a contatto con la sorgente calda e facciamolo espandere
molto lentamente, in modo da approssimare l’espansione a una trasformazione
isoterma a temperatura T2 . Il gas compirà lavoro verso l’esterno, e assorbirà
calore dalla sorgente. Per far tornare il gas al volume iniziale è necessario
ricomprimerlo a una temperatura più bassa (altrimenti il sistema non compirebbe un lavoro netto verso l’esterno). Lo ricomprimiamo quindi a contatto
con la sorgente fredda a temperatura T1 , attraverso una compressione isoterma
reversibile.
Affinché la trasformazione sia reversibile è necessario che il gas sia sempre
all’equilibrio con la sorgente, e deve quindi essere portato alla temperatura T1
prima di iniziare la compressione: otterremo questo attraverso un’espansione
adiabatica, in cui il gas non scambia calore con l’esterno e quindi, espandendosi
e compiendo lavoro, si raffredda.
Al termine della compressione a contatto con la sorgente fredda il gas dovrà
essere riportato allo stato iniziale: anche in questo caso useremo una trasformazione adiabatica, per garantire che il gas non scambi calore con l’esterno.
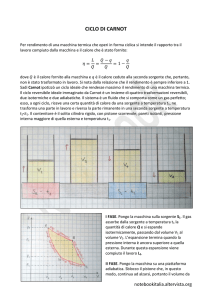
p A B D C V Figura 2: Ciclo di Carnot diretto, costituito da un’espansione isoterma (A →
B) a temperatura T2 , un’espansione adiabatica (B → C) , una compressione
isoterma (C → D) a temperatura T1 < T2 e una compressione adiabatica (D →
A).
Analizziamo gli scambi energetici lungo i quattro rami del ciclo, usando il
primo principio della termodinamica dove necessario.
1. Espansione isoterma A → B:
∆LAB = ∆QAB = nRT1 ln
VB
VA
dato che in una trasformazione isoterma ∆U = 0
3
≡ |Q2 |
2. Espansione adiabatica B → C:
∆QBC = 0 ∆LBC = −∆UBC
per definizione di adiabatica
3. Compressione isoterma C → D:
∆LCD = ∆QCD = −nRT1 ln
VC
VD
≡ −|Q1 |
dato che in una trasformazione isoterma ∆U = 0
4. Compressione adiabatica D → A:
∆QDA = 0 ∆LDA = −∆UDA
per definizione di adiabatica.
Dal primo principio della termodinamica otteniamo che il lavoro totale fatto dal
gas durante un ciclo è
X
X
∆L =
∆Q = |Q2 | − |Q1 |
W =
dove abbiamo usato i valori assoluti delle quantità di calore scambiato per
mettere meglio in evidenza se si tratta di calore assorbito o ceduto.
Poiché sia i punti B e C, sia i punti A e D stanno agli estremi di una
trasformazione adiabatica reversibile, abbiamo che
TB VBγ−1 = TC VCγ−1
TA VAγ−1 = TD VDγ−1
cioè
T2 VBγ−1 = T1 VCγ−1
T2 VAγ−1 = T1 VDγ−1
Dividendo membro a membro le ultime due uguaglianze otteniamo
γ−1 γ−1
VB
VC
=
VA
VD
cioè, passando ai logaritmi
(γ − 1) ln
VB
VA
VB
VA
= (γ − 1) ln
VC
VD
e quindi
ln
= ln
VC
VD
da cui deduciamo
C
nRT1 ln VVD
|Q1 |
T1
=
=
V
B
|Q2 |
T2
nRT2 ln VA
che è la relazione fondamentale caratteristica del ciclo di Carnot reversibile:
la quantità di calore scambiata con ciascuna delle due sorgenti è proporzionale
alla temperatura assoluta della sorgente stessa.
4
Il ciclo di Carnot è un esempio idealizzato di macchina termica, che produce
energia meccanica (lavoro) sottraendo calore a una sorgente calda e cedendone
a una fredda, come schematizzato dalla figura
T2 |Q2| |Q1| T1 W Figura 3: Schema grafico di una macchina termica che lavora tra due sorgenti,
estraendo calore da una sorgente calda e trasformandolo in parte in lavoro meccanico, in parte in calore ceduto alla sorgente fredda. Il diverso spessore delle
frecce visualizza la relazione quantitativa tra le grandezze scambiate.
Il rendimento η di una macchina termica è definito come il rapporto tra
il lavoro sviluppato e il calore assorbito: tanto più alto è il rendimento, tanto
minore è la frazione di energia che va dissipata in calore ceduto all’ambiente
(sorgente fredda). Per una macchina termica che lavora tra due sorgenti (bagni
termici) a temperatura fissata, si ha
η≡
W
|Q2 | − |Q1 |
|Q1 |
=
=1−
|Q2 |
|Q2 |
|Q2 |
Nel caso di un ciclo di Carnot, a causa della relazione tra calori scambiati e
temperature il rendimento vale
η =1−
3
|Q1 |
T1
=1−
|Q2 |
T2
Macchine frigorifere e pompe di calore
Il ciclo di Carnot – che è , lo ricordiamo, un’idealizzazione e un caso limite – è
per costruzione formato da quattro trasformazioni reversibili che possono quindi
essere percorse in senso opposto. Si ha in questo caso un ciclo “invertito” o
“inverso”, che estrae calore |Q1 | dalla sorgente fredda a temperatura T1 e cede un
calore |Q2 | a quella calda alla temperatura T2 , ricevendo dall’esterno un lavoro
meccanico netto |W | = |Q2 | − |Q1 | (usiamo anche qui i valori assoluti per non
confonderci con i segni). Rimane naturalmente valida la relazione fondamentale
trovata sopra
5
|Q1 |
T1
=
|Q2 |
T2
Il ciclo di Carnot inverso è un esempio di macchina frigorifera o di pompa di
calore , secondo lo scopo che ci si prefigge: nel primo caso l’obiettivo è sottrarre
calore a una sorgente fredda (per esempio per mantenerla a una temperatura più
bassa rispetto all’ambiente esterno, come nel caso di un condizionatore d’aria
o di un frigorifero); nel secondo caso lo scopo è consumare meno lavoro meccanico per fornire calore a un ambiente caldo, sfruttando in parte l’estrazione di
calore da un ambiente più freddo (tipicamente l’ambiente esterno nel caso del
riscaldamento di una casa).
T2 |Q2| |Q1| T1 |W| Figura 4: Schema di una macchina frigorifera o pompa di calore che lavora tra
due sorgenti, estraendo calore da una sorgente fredda e cedendolo a una calda,
a spese di un lavoro meccanico.
Nel caso di una macchina frigorifera il rapporto rilevante per misurare la
bontà della macchina (coefficiente di prestazione o COP) è quello tra il calore
sottratto alla sorgente fredda e il lavoro esterno (proporzionale al consumo in
termini di energia elettrica o carburante, per esempio)
COP ≡
|Q1 |
|W |
1
che, per un ciclo di Carnot inverso, vale T2T−T
e può assumere in teoria
1
qualunque valore positivo tra 0 e +∞.
Nel caso di una pompa di calore, invece, il coefficiente di prestazione è rappresentato dal rapporto è quello tra il calore ceduto alla sorgente calda e il lavoro
esterno (consumo).
COP ≡
6
|Q2 |
|W |
che, per un ciclo di Carnot inverso, vale
4
T2
T2 −T1
e può variare2 tra 1 e +∞.
Il Secondo Principio della Termodinamica
Il ciclo di Carnot, pur essendo un “esperimento mentale” completamente idealizzato, ha il grossissimo vantaggio di permettere una formulazione quantitativa
di una legge fisica di cui si avevano solo nozioni vaghe e qualitative, il secondo
principio della termodinamica, corrispondente alla constatazione sperimentale
che in natura gli scambi di calore avvengono spontaneamente solo in un senso,
e precisamente dai corpi più caldi a quelli più freddi.
Le due formulazioni storiche del principio, successive alla teorizzazione del
ciclo di Carnot, risalgono alla metà dell’Ottocento e sono dovute rispettivamente
a lord Kelvin e Rudolph Clausius:
Enunciato di Kelvin È impossibile realizzare una trasformazione ciclica di un sistema che abbia come unico risultato netto la conversione
in lavoro del calore assorbito da un’unica sorgente.
Enunciato di Clausius È impossibile realizzare una trasformazione
ciclica che abbia come unico risultato netto il trasferimento di calore
da una sorgente più fredda a una più calda.
Il passaggio spontaneo di calore dal freddo al caldo (mai verificato in natura)
sarebbe un caso particolare di violazione del principio nella seconda formulazione: in quel caso non ci sarebbe alcun apparato da mettere a punto e il passaggio
di calore “proibito” avverrebbe spontaneamente.
Grazie alla reversibilità, l’“esperimento mentale” del ciclo di Carnot permette di dimostrare innanzitutto che le due formulazioni sono esattamente equivalenti: ciascuna delle due implica l’altra o, equivalentemente, la violazione di una
delle due implicherebbe la violazione dell’altra.
Figura 5: Combinando un ciclo di Carnot diretto con un’ipotetica macchina che
vı̀ola il secondo principio nella formulazione di Clausius, si potrebbe annullare il
calore ceduto alla sorgente fredda ottenere una trasformazione ciclica che estrae
calore da una sola sorgente e lo trasforma tutto in lavoro.
Se infatti fosse violato l’enunciato di Clausius e fosse possibile con una trasformazione ciclica trasferire un certo calore |Q| dalla sorgente fredda a quella
2 Osserviamo
che i coefficienti di prestazione tendono a infinito nel limite in cui le due
temperature delle sorgenti sono uguali. Ma in questo caso frigoriferi e pompe di calore sono
ben poco utili!
7
Figura 6: Combinando un ciclo di Carnot inverso con un’ipotetica macchina che
vı̀ola il secondo principio nella formulazione di Kelvin, si potrebbe annullare il
lavoro compiuto ottenere una trasformazione ciclica che estrae calore da una
sorgente fredda e lo cede a una sorgente calda.
calda, basterebbe applicare al sistema un ciclo di Carnot diretto che estrae |Q2 |
dalla sorgente calda e cede esattamente |Q| a quella fredda, compiendo il lavoro
W = |Q2 |−|Q|. Il risultato finale netto di questa trasformazione sarebbe l’estrazione dalla sorgente calda di un calore |Q2 |−|Q| e la sua completa trasformazione
in lavoro, in violazione del principio nell’enunciato di Kelvin (figura 5).
Allo stesso modo, se esistesse una trasformazione che vı̀ola il nell’enunciato
di Kelvin, basterebbe farla seguire da un ciclo di Carnot inverso annullando
il lavoro compiuto, e si otterrebbe una violazione dell’enunciato di Clausius
(figura 6).
4.1
Teorema di Carnot e rendimenti delle macchine reali
Il ciclo ideale di Carnot permette di dimostrare anche l’importantissimo teorema
che porta lo stesso nome:
Nessuna macchina termica operante tra due sorgenti a temperatura definita può avere un rendimento maggiore di quello del ciclo di
Carnot reversibile
Infatti, se per assurdo esistesse una macchina con rendimento maggiore, questa estrarrebbe dalla sorgente calda un calore |Q02 | e cederebbe alla fredda |Q01 |
con
η0 = 1 −
cioè
|Q1 |
|Q01 |
>1−
|Q02 |
|Q2 |
|Q02 |
|Q2 |
T2
>
=
|Q01 |
|Q1 |
T1
dove |Q1 | e |Q2 | sono le generiche quantità di calore scambiate con le due
sorgenti da un ciclo di Carnot.
Basterebbe quindi far seguire a un ipotetico ciclo della macchina superefficiente un ciclo di Carnot inverso, che riestragga dalla sorgente fredda il calore
|Q1 | = |Q01 | ceduto dal ciclo precedente, annullando il calore netto ricevuto dalla
sorgente fredda. Questo secondo ciclo cederebbe alla sorgente calda un calore
|Q2 | = |Q1 | TT21 < |Q02 |. Il risultato netto sarebbe la cessione di una quantità
8
di calore |Q02 | − |Q2 | > 0 da parte della sola sorgente calda, e la sua totale
trasformazione in lavoro, in violazione del secondo principio (figura 7).
Figura 7: Se esistesse una macchina ciclica con rendimento maggiore di quello
di Carnot, basterebbe farla seguire da un ciclo di Carnot inverso per ottenere
una violazione del secondo principio nell’enunciato di Kelvin.
In maniera del tutto analoga si dimostra che qualunque ciclo reversibile che
lavori tra due sorgenti deve avere lo stesso rendimento del ciclo di Carnot (se
fosse inferiore, basterebbe applicarlo al contrario dopo ciclo di Carnot diretto,
in maniera identica a quella seguita sopra).
La conclusione è che qualunque macchina termica che opera tra due sorgenti
con un ciclo irreversibile (quindi qualunque macchina termica reale) avrà rendimento inferiore a quello della macchina di Carnot. Tenendo conto dei segni dei
calori scambiati dalla macchina termica, presi positivi quando sono assorbiti, il
teorema di Carnot (equivalente al secondo principio) si può riscrivere come
Q2
Q1
+
≤0
T1
T2
(1)
per una qualunque trasformazione ciclica che scambia calore tra due sorgenti
di temperatura T1 e T2 .
Non è difficile dimostrare che, in conseguenza, anche per le pompe di calore o
per le macchine frigorifere vale che il coefficiente di prestazione di una macchina
reale è sempre inferiore a quello di una macchina ideale rappresentata da un
ciclo di Carnot inverso.
5
Entropia e freccia del tempo
La disequazione 1 ha un’importanza enorme perché può essere estesa a qualunque trasformazione ciclica, reversibile o no, e permette di legare il secondo
principio della termodinamica definire al concetto fondamentale di entropia, che
purtroppo non abbiamo il tempo di esplorare in questa sede. È sufficiente dire
che si tratta di una funzione di stato (che quindi non varia per le trasformazioni cicliche) e che il secondo principio della termodinamica è equivalente ad
affermare che per un sistema termodinamico isolato l’entropia non può
mai diminuire.3
In tutti i processi spontanei, in particolare, l’entropia di un sistema isolato
aumenta, ed è questo a dare una direzione privilegiata nel tempo ai processi
3 Nel caso di una macchina ciclica reale, la sua entropia alla fine di un ciclo rimane invariata,
essendo una funzione di stato: ad aumentare è l’entropia dell’ambiente esterno (le sorgenti).
9
macroscopici che coinvolgono un numero enorme di particelle (sistemi termodinamici). A differenza dei processi elementari in cui, dato un moto, lo stesso
moto “visto all’indietro facendo girare il filmato al contrario” è perfettamente
possibile, per i processi macroscopici questo non è più vero: se guardiamo il
filmato di un satellite che orbita attorno alla Terra, o di un pendolo che oscilla
in assenza di attriti, non sappiamo distinguere se il filmato va in avanti o all’indietro nel tempo. Se invece introduciamo gli attriti (scambi di calore e quindi
termodinamica) e vediamo il pendolo fermarsi, o un bicchiere andare in frantumi, sappiamo che il filmato sta procedendo nel verso corretto, e ci accorgeremmo
subito se fosse fatto scorrere al contrario.
Tutto questo è legato all’aumento dell’entropia nei processi spontanei, che
misura la tendenza dei sistemi macroscopici a evolvere verso stati di maggiore
disordine.
La meccanica statistica è il settore della fisica che lega le leggi macroscopiche
dei sistemi termodinamici a quelle microscopiche che regolano le interazioni tra
singole particelle. In meccanica statistica l’entropia misura il grado di disordine
di un insieme di molte particelle di cui conosciamo solo variabili medie, o meglio
il nostro grado di ignoranza dei dettagli di un sistema siffatto.
La legge dell’aumento dell’entropia, o secondo principio della termodinamica, è in realtà un fatto puramente statistico, dovuto al numero elevatissimo di
particelle contenute nei sistemi macroscopici di cui ci occupiamo, e legato al
fatto che gli stati macroscopici più disordinati sono enormemente più probabili
di quelli ordinati. Dunque non si tratta di una legge assoluta della fisica, ma di
una legge probabilistica: non è impossibile violare il secondo principio, è solo
molto, ma molto, ma molto improbabile.
10