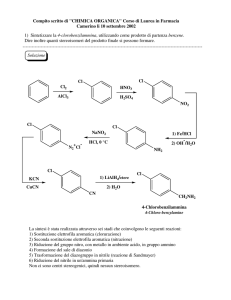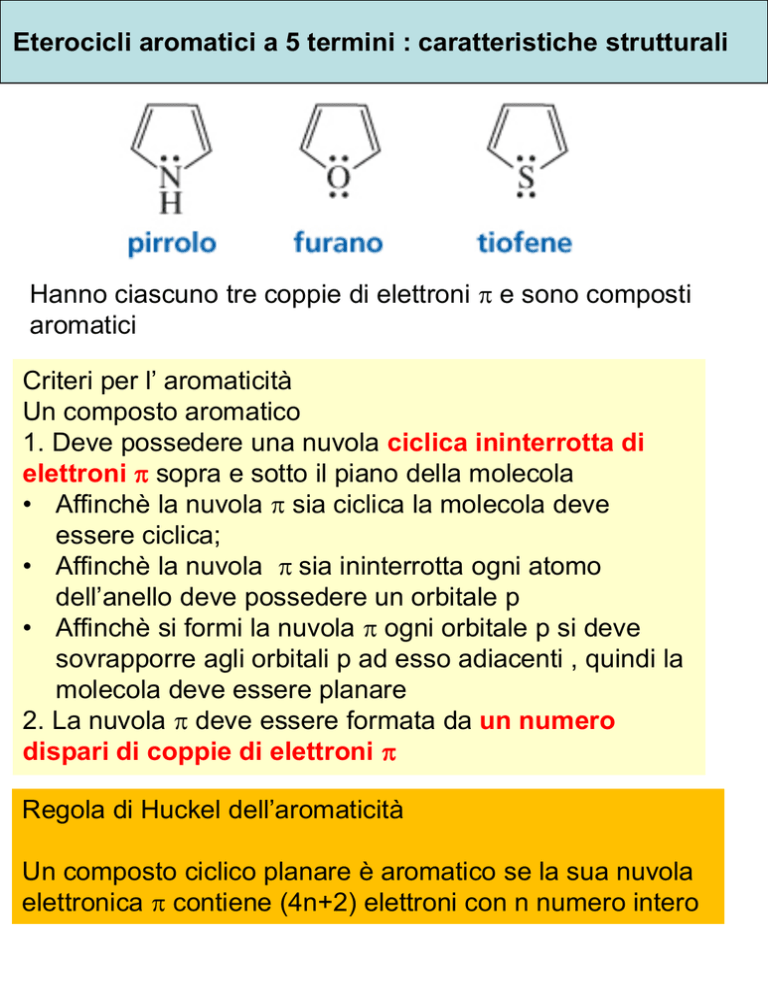
Eterocicli aromatici a 5 termini : caratteristiche strutturali
Hanno ciascuno tre coppie di elettroni p e sono composti
aromatici
Criteri per l’ aromaticità
Un composto aromatico
1. Deve possedere una nuvola ciclica ininterrotta di
elettroni p sopra e sotto il piano della molecola
• Affinchè la nuvola p sia ciclica la molecola deve
essere ciclica;
• Affinchè la nuvola p sia ininterrotta ogni atomo
dell’anello deve possedere un orbitale p
• Affinchè si formi la nuvola p ogni orbitale p si deve
sovrapporre agli orbitali p ad esso adiacenti , quindi la
molecola deve essere planare
2. La nuvola p deve essere formata da un numero
dispari di coppie di elettroni p
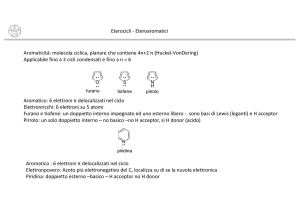
Regola di Huckel dell’aromaticità
Un composto ciclico planare è aromatico se la sua nuvola
elettronica p contiene (4n+2) elettroni con n numero intero
Eterocicli aromatici a 5 termini : caratteristiche strutturali
PIRROLO
Il pirrolo è una base molto debole perché gli elettroni
coppia solitaria dell’azoto fanno parte del sistema p.
L’acido coniugato del pirrolo è molto forte pKa -3.8
Eterocicli aromatici a 5 termini : caratteristiche strutturali
FURANO
Determinazione dell’energia di risonanza dei sistemi aromatici
Il caso del benzene:
Il benzene è un composto particolarmente stabile a causa della sua
energia di delocalizzazione molto elevata.
L’energia di delocalizzazione è una misura di quanto una molecola
con elettroni delocalizzati è più stabile di una ipotetica molecola uguale,
ma con gli elettroni localizzati.
Si può determinare l’energia di risonanza del benzene paragonando la
stabilità del benzene con quella del cicloesatriene una molecola
ipotetica con tre legami p localizzati
Determinazione dell’energia di risonanza dei sistemi aromatici
Il caso del benzene:
Il DH° del benzene è molto più basso di quello dell’ipotetico
cicloesatriene
Poiché in entrambe le reazioni si ottiene il cicloesano la
differenza 36 Kcal/mol rappresenta la energia di
risonanza del benzene
Eterocicli aromatici a 5 termini : caratteristiche strutturali
Le energie di risonanza di pirrolo furano e tiofene non sono
cosi’ grandi come quelle del benzene o dell’anione
ciclopentadienile le cui strutture limiti di risonanza sono tutte
equivalenti
Il tiofene che
possiede
l’eteroatomo meno
elettronegativo ha
la più alta energia
di risonanza,
mentre il furano
che possiede
l’eteroatomo più
elettronegativo ha
la minore energia
di delocalizzazione
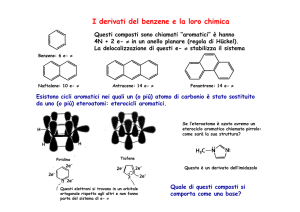
Sostituzione elettrofila aromatica
Essendo aromatici pirrolo, furano e tiofene danno reazione di
sostituzione elettrofila aromatica
Il meccanismo è analogo a quello visto nel caso del benzene
Sostituzione elettrofila aromatica
Regioselettività della reazione
La sostituzione avviene preferenzialmente al C-2 perché
l’intermedio ottenuto per attacco a questa posizione è più
stabile di quello ottenuto per attacco al C-3
Posizione 2 (alfa)
Posizione 3 (beta)
Se entrambe le posizioni 2 sono occupate la sostituzione
avviene al C-3
Sostituzione elettrofila aromatica
Reattività relativa nella sostituzione elettrofila aromatica
Pirrolo, furano e tiofene sono più
reattivi del benzene perché
stabilizzano meglio la carica positiva
sul carbocatione intermedio, in quanto
l’eteroatomo può donare elettroni
all’anello per risonanza.
Questo avviene in minor misura per il
furano che per il pirrolo perché l’O è
più elettronegativo
Il tiofene è meno reattivo del furano
perché gli elettroni dello zolfo sono in
un orbitale 3p che si sovrappone
meno efficientemente dell’orbitale 2p
di N o O
Sostituzione elettrofila aromatica
Reattività relativa nella acilazione di Friedel Craft
Il benzene richiede un acido di Lewis forte come
catalizzatore, il tiofene un acido meno forte, il
furano ancora meno forte, il pirrolo non necessita
di catalizzatore
Acidità, basicità del pirrolo
Acidità del pirrolo
Il pirrolo è più acido della pirrolidina perché l’N è
ibridato sp2 ed è quindi più elettronegativo dell’N sp3
di un’ammina satura
Basicità del pirrolo
L’ibrido di risonanza del pirrolo ha una parziale carica
positiva sull’N, pertanto il pirrolo viene protonato al C-2
piuttosto che sull’N. In realtà il protone è un elettrofilo e
attacca preferenzialmente in posizione 2
Una volta protonato il pirrolo polimerizza. Il pirrolo è quindi
instabile in soluzioni acide
Sintesi di Paal–Knorr di furano, pirrolo e tiofene.
Utilizza come materiali di partenza gli 1,4-dichetoni. E’ un
metodo utile per ottenere pirroli e furani sostituiti. Proposta
indipendentemente da Carl Paal and Ludwig Knorr alla fine
dell’800.
La reazione si conduce in presenza di un acido protico
o un acido di Lewis
Sintesi di Paal–Knorr di furano, pirrolo e tiofene.
Il meccanismo della reazione è stato chiarito solo nel 1990 da
V. Amarnath
Furano
Il carbonile protonato è attaccato dall’enolo in formazione, con
meccanismo concertato. Seguono stadi di disidratazione
Pirrolo
Il carbonile protonato è attaccato dall’ammina a dare un
emiaminale. L’ammina attacca l’altro carbonile con formazione di un
2,5-diidrossitetraidropirrolo che subisce quindi disidratazione a dare
il pirrolo
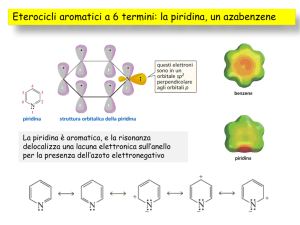
Eterocicli aromatici a sei termini: la piridina
La piridina è aromatica
Può essere descritta da due strutture limiti di risonanza non
cariche e tre strutture limiti cariche perché l’N è elettronattrattore
Piridina: caratteristiche acido-base
Lo ione piridinio è un
acido più forte di un
ione ammonio
perché il protone è
legato ad un N
ibridato sp2 più
elettronegativo di un
azoto ibridato sp3
Ovvero la piridina è una base più debole di un’ammina
eterociclica non aromatica
La piridina dà le reazioni caratteristiche delle ammine terziarie
L’azoto è la parte negativa del dipolo
Piridina: Sostituzione elettrofila aromatica
A causa della sua aromaticità la piridina dà reazioni di
sostituzione elettrofila aromatica
Reattività posizionale: la sostituzione avviene
preferenzialmente sulla posizione 3 perché l’attacco
dell’elettrofilo porta all’intermedio più stabile
meno stabile
meno stabile
Piridina: Sostituzione elettrofila aromatica
Reattività relativa nella sostituzione elettrofila aromatica
La piridina è poco reattiva, meno del nitrobenzene!!
Sono richieste condizioni molto drastiche
Reattività posizionale
Piridina: Sostituzione nucleofila aromatica
La piridina è più reattiva del benzene nella sostituzione
nucleofila aromatica in quanto l’azoto elettronegativo
stabilizza l’intermedio della reazione
La sostituzione avviene preferenzialmente alle posizioni C-2
e C-4
più stabile
più stabile
Piridina: Sostituzione nucleofila aromatica
Se vi sono gruppi diversi al C-2 e C-4 il nucleofilo
entrante sostituisce la base più debole
Piridina: la reazione di Chichibabin
E’ un metodo per produrre 2-amminopiridine per reazione
della piridina con sodio ammide
Trasformazione delle amminopiridine
La diazotazione delle amminopiridine porta ad a-piridone
o g-piridone
Piridina: acidità degli idrogeni su sostituenti in C-2 e C-4
Gli idrogeni sui carboni legati alle posizioni 2 e 4 dell’anello
piridinico sono piuttosto acidi per effetto dell’N elettronattrattore
e la possibilità di delocalizzare la carica negativa.
Questi idrogeni possono essere rimossi anche da basi
acquose ed i carbanioni risultanti agiscono da nucleofili
Ammine eterocicliche di importanza biologica: l’imidazolo
Imidazolo è un composto aromatico
Imidazolo proprietà acido basiche
L’imidazolo è molto più basico del pirrolo perché la
coppia solitaria nell’orbitale sp2 non partecipa al
sistema p
A pH fisiologici l’imidazolo esiste sia in forma protonata
che in forma deprotonata
Sia l’imidazolo protonato che l’anione hanno due
strutture limiti di risonanza. Quindi i due atomi di
azoto diventano equivalenti quando l’imidazolo è
protonato o deprotonato.