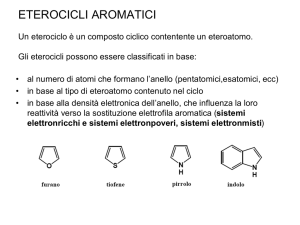
Eterocicli - Eteroaromatici
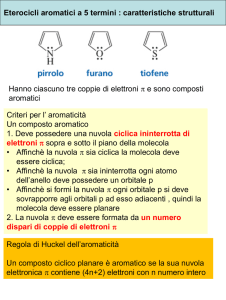
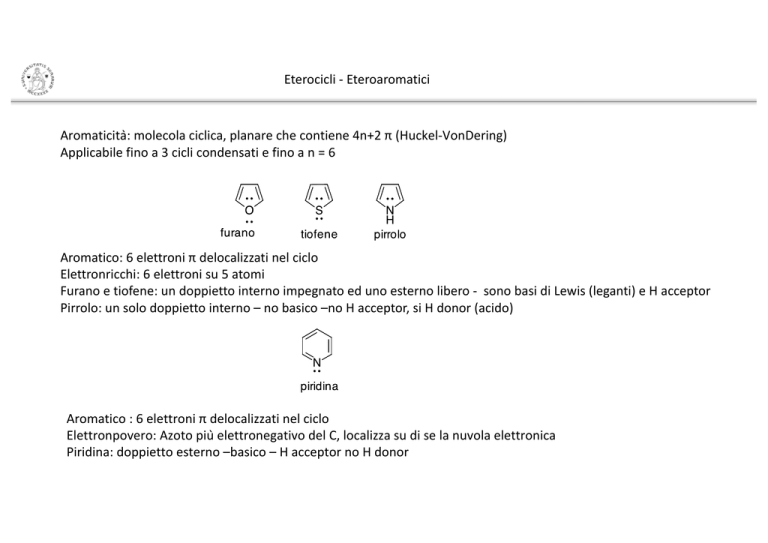
Aromaticità:molecolaciclica,planarechecontiene4n+2π(Huckel-VonDering)
Applicabilefinoa3ciclicondensatiefinoan=6
Aromatico:6elettroni πdelocalizzati nel ciclo
Elettronricchi:6elettroni su 5atomi
Furano etiofene:undoppietto interno impegnato ed uno esterno libero- sono basi diLewis(leganti)eHacceptor
Pirrolo:unsolodoppietto interno – nobasico –noHacceptor,si Hdonor(acido)
Aromatico:6elettroniπdelocalizzatinelciclo
Elettronpovero:AzotopiùelettronegativodelC,localizzasudiselanuvolaelettronica
Piridina:doppiettoesterno–basico–HacceptornoHdonor
Eterocicli - Eteroaromatici
Azoli
N
N
H
N
H
imidazolo
N
N
H
pirazolo
N
N
N
N
N
H
1,2,3-triazolo
N
O
S
ossazolo
tiazolo
N
S
N
H
N
O
N
N
isossazolo isotiazolo 1,2,3 oxadiazolo
N N
N
N
H
N N
N
N
H
1,2,4-triazolo 1,2,5-triazolo
N
O
N
1,2,3,4-tetrazolo
1,3,4-triazolo
N
O
N
1,2,4-oxadiazolo
N
O
N
furazolo
Elettronricchi.PresentanosempreunO,SoNHchecontribuisceconildoppiettointernoall’aromaticità.
Hannopoiuno(opiù)azotiditipo“piridinico”conundoppiettodoppiettoesternobasico:possono
essereHacceptoreHdonor(sefornitidiNH).
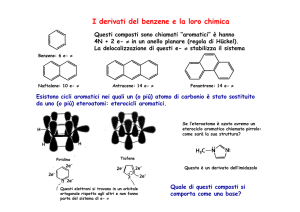
L'introduzionedieteroatomidiminuiscel'aromaticitàglobaleinquanto"localizza"glielettroni
pepolarizzailegami.
PertantoinucleiazolicipossonoancheessereapertiperattacconucleofiloalC
Eterocicli - Eteroaromatici
Azoli benzocondensati
O
dibenzofuran
N
H
9H-carbazole
N
8aH-carbazole
N
H
N
H
1,7-dihydropyrrolo
[3,2-f]indole
N
H
O
7H-furo[3,2-f]indole
Eterocicli - Eteroaromatici
Azine
N
N
N
pyridazine
N
N
N
N
N
N
pyrimidine
pyrazine
1,2,3-triazine
N
N
N
N
1,2,4-triazine
N
N
1,3,5-triazine
N
N
N
N
1,2,4,5-tetrazine
L’introduzionediNaggiuntividiminuiscelabasicitàdegliNpiridiniciel’aromaticitàdelsistema,
ancheseingeneraleisistemiaseiterminisonopiùresistentiall’aperturadiquellia5
Eterocicli - Eteroaromatici
Azine condensate
N
4H-quinolizine
isoquinoline
quinoline
5
N
N
N
N
N
N
N
cinnoline
phthalazine
N
1,8-naphthyridine
N
N
N
N
N
pyrido[2,3-c]pyridazine pyrido[2,3-d]pyrimidine
N
pyrido[3,4-d]pyrimidine
quinoxaline
N
N
N
N
quinazoline
4
N
N
N
N
N
N
pyrido[2,3-b]pyrazine
N
N
N
N
pteridine
Furano,tiofene epirrolo,rettività.
Comportamento acido-basedelpirrolo.
Furano,tiofene epirrolo,rettività.
Section one - Chemistry of Heteroaromatics
electron densities:
1.090
1.2
1.067
1.087
N
H
Reattività rispetto alle SEAr pirrolo >furano >tiofene >>benzene
1.710
ivity
H
H
El
El
El
C-3
X
X
minor
X
El
X
H
El
X
H
X
Preferred for X=NH, NR, S
X
El
-H+
X
El
Preferred for X=O
El
Densità elettroniche calcolate
1.078
O
1.647
1.000
H
major
El
Furano,tiofene epirrolo,rettività.
Polipirrolo oneri dipirrolo (pyrroleblack)
Furano,tiofene epirrolo,rettività.
Furano,tiofene epirrolo,rettività.
Furano,tiofene epirrolo,rettività.
Furano,tiofene epirrolo,sintesi delnucleo
LudwigKnorr
1859-1921
CarlPaal
1860-1935
Azoli:reattività
h systems have lower resonance energies than pyrrole (i.e. <90 kJmol )
Electron
density:
relative
pyrrole,
the additional
o pyrrole, the additional (electronegative)
N atom
decreases
thetooverall
electron
density(electronegative) N atom decreas
on the remaining carbons. The precise distribution is rather uneven:
The precise distribution is rather uneven:
for imidazole: C4 & C5 are electron rich, C2 is electron deficient
C5 are electron rich, C2 is electron deficient
Azoli:reattività
for pyrazole: C4 is electron rich, C3 & C5 are electron deficient
ectron rich, C3 & C5 are electron deficient
sities:
1.056 4
1.056 5
N 1.502
2 0.884
N 1.502
H
imidazole
1.105 4
0.957 5
3 0.972
N 1.278
N 1.649
H
pyrazole
p-electron 1.090
densities:
1.087
1.647
N
H
pyrrole
1.056 4
1.056 5
N 1.502
2 0.884
N 1.502
H
imidazole
1.105 4
0.957 5
3 0.972
N 1.278
N 1.649
H
pyrazole
imidazole are:
→ both pyrazole and imidazole are:
s reactive towards electrophilic aromatic substitution
(SEAr) than
(buttowards
>benzene)
significantly
lesspyrrole
reactive
electrophilic aromatic substitution (SEA
s nucleophilic aromatic substitution (SNAr) at certain
Cs (cf.
pyrrolenucleophilic
which does not
react substitution (SNAr) at certain Cs (c
reactive
towards
aromatic
es)
with nucleophilies)
Azoli:sintesi
ammidina
pirazolone
Azoli:sintesi eapplicazioni sintetiche
Indolo:reattività
Indolo:sintesi
Azine,rettività.
N
N
N
pKa 4.9
pKa 5.2
pKa 5.5
Azine,rettività.
Electrophilic Ar subst
E
N
Benzene more electron rich
than pyridine
N
E
Major isomers shown
E
E
N
N
Section one - Chemistry of Heteroaromatics
Azine,sintesi
Top Ten Methods to Synthesize Pyridines
1. Hantzsch Pyridine Synthesis
R
2
O
O
O
H
O
NH3
3
+
OR
R
O
R 3O
R2
R2
O
OR3
N
H
oxid
R
O
R 3O
OR3
R2
R2
N
R2
Watanabe, Y.; Shiota, K.; Hoshiko, T.; Ozaki, S. Synthesis 1983 761; Pfister, J. R.Synthesis 1990, 689;
Singer, A; McElvain, S.M. Org. Synth., Coll. Vol. II 1943, 214-216.
A mixture of aldehyde, β-ketoester, 60 mL of ethanol, and 10 mL of concentrated aqueous ammonia was heated
for 3 h on a steam bath. To a solution of the above compound in 15 mL of acetone is added a solution of ceric
ammonium nitrate in 3.5 mL water. The orange color of the reagent disappears immediately on addition of each
drop. After stirring for 10 min, the resulting solution is concentrated to a small volume under reduced pressure.
To this mixture is added 20 mL of water and the mixture is extracted with methylene chloride. The organic phase
is washed with brine, dried over MgSO4, and evaporated under reduced pressure.
2. Guareschi-Thorpe Condensation
OR
R
RO
O
O
N
+
RO
O
NH3
or NH4OAc,
AcOH
N
R
HO
N
OH
Holder, R.W.; Daub, J.P.; Baker, W.E.; Gilbert, R.H.; Graf, N.A. J. Org. Chem. 1982, 47, 1445-1450.
I. Guareschi, Mem. Reale Accad. Sci. Torino II 1898, 46, 7, 11, 25.
ArthurRudolfHantzsch
1857-1935
Azine,sintesi
Skraup reaction
Bischler–Napieralski reaction
Azine,sintesi
Lipidi
Ilipidi costituiscono lafrazione solubile insolventi apolari derivata dauntessuto.Sono una famiglia eterogenea di
molecole organiche principalmente apolari costituite perlamaggior parteda
Cere
Trigliceridi
Steroidi
Fosfolipidi
Terpeni
Trigliceridi
Fosfogliceridi
Steroidi
Steroidi:tutti sintetizzati apartire dalanosterolo ecolesterolo.Sono coinvolti nella differenziazione cellulare,crescita
eproliferazione.
Steroidi
Steroidi
Steroidi
Terpeni
Terpeni,acido retinoico ederivati.Sono coinvolti nella differenziazione cellulare proliferazione,apoptosi emediatori della
interazione cellula/cellula.Sono ottenuti permetabolismo ossidativo dalcaroteneodaaltre luteine/xantophille.Ilretinolo
è coinvolto nel fenomeno della visione.
Carboidrati
Cn(H2O)n Monosaccaridi,oligosaccaridi,polisaccaridi.Poliidrossi aldeidi (aldosi)epoliidrossichetoni (chetosi),
treosi,tetrosi,pentosi,esosi,eptosi
gliceraldeide
glicerolo
D-monosaccaride: unmonosaccaride che halastessa
configurazione della D-gliceraldeide nel penultimo C(lo
stereocentro più lontano dalC=O).Cioè hal’OH adestra nella
proiezione diFischer.
L-monosaccaride: unmonosaccaride che halastessa
configurazione della L-gliceraldeide nel penultimo C(lo
stereocentro più lontano dalC=O).Cioè hal’OH asinistra nella
proiezione diFischer.
4
Carbohydrates: Occurrence, Structures and Chemistry
Carbohydrates: Occu
Figu
b-an
form
C-hy
Figure 4. The D-ketohexose (or D-hexulose) family tree:
Trivial names, systematic designation (in brackets) and
Figure 3. The D-aldose family tree (up to aldohexoses) in their acyclic forms: Common names and Fischer projection formulas,
Fischer projection formulas
with secondary hydrogen atoms omitted for clarity
† Not regarded as being a sugar, due to absence of an
asymmetric carbon atom.
and
thro
only
T
ring
abov
four
in w
othe
ener
Carboidrati
Carboidrati
1
HOCH2
5
H
H
HO
O
1
HO
H
CH 2OH
2
OH (a)
a-D-Fructofuranose
(a-D-Fructose)
2
CH 2OH
C=O
HO
H
4
H
OH
5
H
OH
6
CH 2OH
D-Fructose
3
HOCH2
5
H
H
HO
O
OH (b)
HO
H
2
CH 2OH
1
b -D-Fructofuranose
(b-D-Fructose)
Carboidrati
6
Carbohydrates: Occurrence, Structures and Chemistry
Ilglucosio è presente infase solida informaciclica
(piranosidica).Almomento che viene disciolto in
acqua,si innesca unlentoprocesso di
apertura/chiusura delsistema emiacetalico che
portadopo 24adunequilibro tra leforme infigura.
Laprevalenza è della formabeta(circa63%)
rispetto alla alpha(circa37%)esolotracce della
formaaperta edelle forme furanosidiche
Figure 7. Cyclic hemiacetal forms of D-glucose in configurational representation. In solution, these forms rapidly
interconvert through the energetically unfavorable acyclic
form; in water at 25 ! C the two pyranoid forms are nearly
exclusively adopted, the equilibrium mixture amounting
to 62 % of the b-p and 38 % of the a-p anomers. From
water, D-glucose crystallizes in the a-pyranose form
Figure 8. Forms of D-fructose in solution. In water, the
major conformers are the b-pyranose (b-p, 73 % at 25 ! C)
and b-furanose (b-f, 20 %) forms [18]. On crystallization
from water, D-fructose adopts the 2 C 5 chair conformation in
the crystal lattice as evidenced by X-ray analysis [17]
Carboidrati:red-ox
Glucosidi
Disaccaridi
saccarosio
lattosio
maltosio
Polisaccaridi
◆
Amido:usato perimagazzinare glucosio nelle piante
• Può essere separato inamilosio eamilopectina:l’idrolis completa (enzimatica oacida)portaaDglucosio
• Amyiosio:unpolisaccaride costituito dacirca4000unità lineari diglucosio legateconlegami 1-4
alpha(assiale).
• Amilopectina:Aunpolisaccaride costituito da5000-10000unità diglucosio conlegami 1-4alphae
ramificate sulla posizione 6-1alphada24-30unità diglucosio 1-4alpha
Glicogeno:lariserva animale di
carboidrati.
Polimero nonlineare diDglucosio conconnessioni alpha14ed alpha1-6.Polimero molto
grande spesso che arriva fino a
3000unità Iglucosio.
Polisaccaridi
Cellulosa Unpolimero lineare diD-gucosio 1-4betacostituito dacirca3000unità diglucosio.Peridrolisi
acida spinta (oidrolisi enzima)tica)si ottiene D-Glucosio.E’usata comesostegno dalle piante
Illlegno è costituito dafasci dicellulosa tenutoinsieme dalignina.
Ilcotone è costituito al90%dacellulosa
Polisaccaridi
Acido ialuronico:polisaccaride acido contenuto nel tessuto connettivo
Legame 1-4betatra acido glucuronico eN-acetil glucosamina.Ilsuo MWvaria tra 5.000e20.000.000Da.
Eparina:polisaccaride naturale usato comefarmaco anticolagulante
Amminoacidi
Amminoacidi (aminoacids):Molecole che contengono ungruppo acido (-COOH,-SO3H)ed uno basico
(NH2).
Amminoacidi naturali.Comesopra madiorigine naturale (sono migliaia).
α-Amminoacidi.Molecole doveil gruppo acido (COOH)equello basico (NH2)sono legati allo stesso atomo
dicarbonio (ibridato sp3)(sono migliaia).
Amminoacidi codificati.Costituenti principali delle proteine.Esiste perognuno diessi uncodice (tripletta)
nel DNA.Vengono introdotti nelle proteine durante lasintesi proteica che avviene nei ribosomi.Sono 22
(20+2).
Sono tutti α-amminoacidi,sono tutti singoli enantiomeri,sono tutti della serie L.
Ilvalore medio dipKa perungruppo α-carbossile diuna.a.protonato è 2.19.Ilgruppo α-carbossile diuna.a.è
MOLTOpiù ACIDOdell’acido acetico (pKa =4.76).Lamaggiore acidità è attribuibile all’effetto induttivo elettronattrattore delgruppo –NH3+adiacente Ilvalore medio dipKa perungruppo α-ammonio diuna.a.è 9.47.Ilgruppo
α-ammonio diuna.a.è unacido leggermente più fortediuno ione ammonio derivante daun’ammina primaria
alifatica (pKa =10.76).Ungruppo α-amminico è una baseleggermente più debole diun’ammina alifatica primaria.
Amminoacidi codificati
Peptidi eproteine
Struttura secondaria.Organizzazione delfilamento dovuta ai
legami aidrogeno che si realizzano tra i C=Oegli NHdel
filamento.NB.Legame aHmassimo conD-H-A180°
Proteine
Proteine:sequenze dialmeno 50aa
Struttura Terziaria – FoldingMisura delfolding:diminuzione dell’entropia
conformazionale bilanciata appena daunguadagno entalpico
Attenzione:Nonconfondere lamisura conlecausedelfenomeno.
Forze diinterazione che controllano il folding:
Interazioni idrofobiche (ointerazioni lipofiliche preferenziali)
Legami aH(diretti oattraverso molecole diacqua)
Legami Ionici
Legami diCoordinazione (attraverso metalli)
Legami adisolfuro
Struttura quaternaria
Cinetica enzimatica
Cinetica enzimatica
Cinetica enzimatica
Nucleotidi / oligonucleotidi / acidi nucleicii
Gli Oligonucleotidi con gli occhi del chimico
NH2
N
N
O
NH2
N
N
N
O
O
O
O P OO
O
N
N
N
NH
N
NH2
N
NH2
O
O P OO
O
N
N
O
O
HN
O
N
O P O- O
O
O
O
O P OO
DNA Struttura rigida. Duoble strained. Acido e
chimicamente stabile
HO
O
O
OH
O P O
O
O
N
NH2
N
N
O
O
N
O
OH
O P OO
O
N
NH
N
NH2
O
OH
O P OORNA Struttura flessible. Single strained. Acido
e chimicamente instabile
(transesterificazione)
Oligonucleotidi
L’accoppiamento delle basi
Perché il desossiribosio nello stampo ed il ribosio nel messaggero ?
IlDNAnonhasitireattivisulloscheletro,nonhalapossibilitàdidarelegamiaidrogeno.Leunichepossibilitàdiinterazione
sonotragliH dellenucleobasi.
Quindi,ilDNAsisviluppacomestrutturaestesaofibrosa. Ilfilamentopuòripiegarsipermassimizzareleinterazionitrale
basicomplementarioppureappaiarsiconunfilamentoaffine.Ilsistemaèstabileinassenzadigruppinucleofiliche
interagisconosulfosfato.
L’RNAhal’OHinposizione2’cheinteragisceconaltriOH
(direttamenteoattraversomolecolediacqua)eguidail
ripiegamentodelfilamentoconformazionedipossibili
interazionitralebasi.
Quindi l’RNAsisviluppacomeunastrutturaglobulare.
Infunzionedell’ambienteincuisitroval’RNAsubisce
modificheconformazionalichepossonopermetterela
transesterificazione dellegamefosfatoconmodifica
dellasequenzadell’RNA(splicing).
Perchéribo- enongluco- ?