157
ETEROCICLI A SEI TERMINI
PIRIDINA
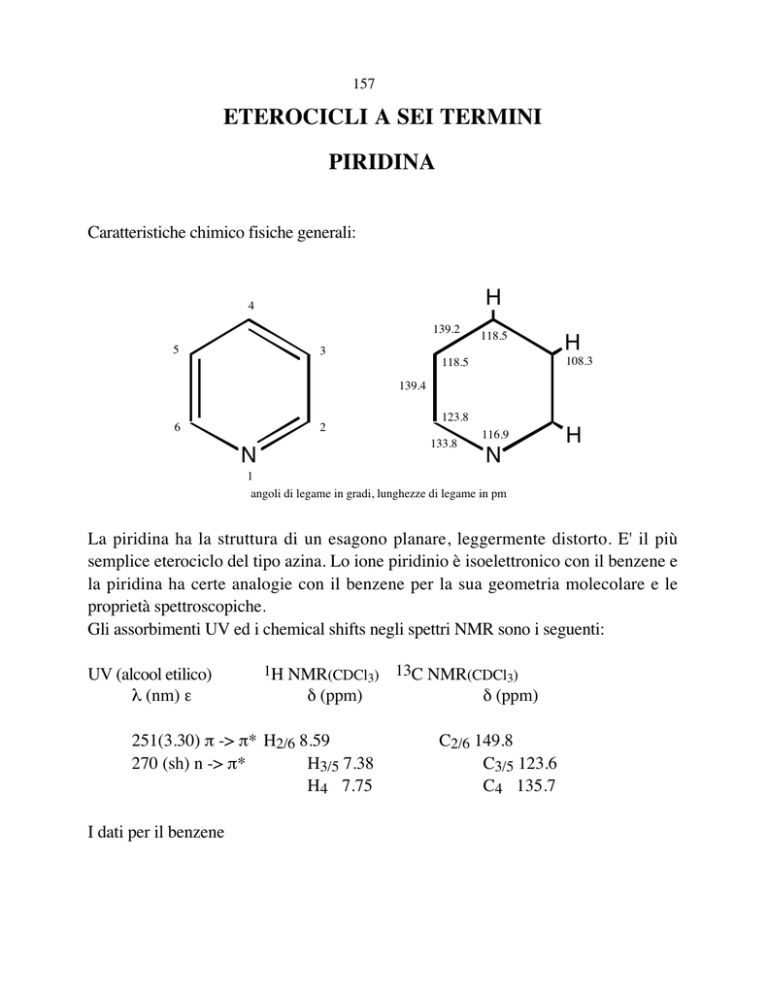
Caratteristiche chimico fisiche generali:
H
4
139.2
5
118.5
3
H
108.3
118.5
139.4
6
2
123.8
133.8
N
116.9
N
H
1
angoli di legame in gradi, lunghezze di legame in pm
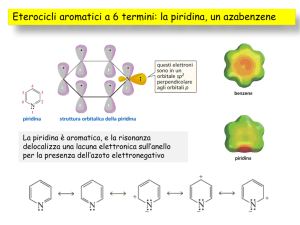
La piridina ha la struttura di un esagono planare, leggermente distorto. E' il più
semplice eterociclo del tipo azina. Lo ione piridinio è isoelettronico con il benzene e
la piridina ha certe analogie con il benzene per la sua geometria molecolare e le
proprietà spettroscopiche.
Gli assorbimenti UV ed i chemical shifts negli spettri NMR sono i seguenti:
UV (alcool etilico)
λ (nm) ε
1H NMR(CDCl3)
δ (ppm)
251(3.30) π -> π* H2/6 8.59
270 (sh) n -> π*
H3/5 7.38
H4 7.75
I dati per il benzene
13C NMR(CDCl3)
δ (ppm)
C2/6 149.8
C3/5 123.6
C4 135.7
158
208 (3.90)
362 (2.41) π -> π*
H
7.26
C
128.5
Questi dati confermano che la piridina è un eteroarene 6π-delocalizzato con una
corrente di anello diamagnetica. La piridina può esser descritta mesomericamente da
strutture canoniche nelle quali la densità degli elettroni π è più bassa sulle posizioni
2,4 e 6, e più elevata sull'atomo di N.
N
N
N
N
Il sistema piridinico è caratterizzato da un'energia di risonanza empirica di ∆Eπ =
134 kJ mol-1 (cfr. benzene 150 kJ mol-1).
REATTIVITA'
Per la piridina, sulla base della struttura elettronica, possono esser previste le seguenti
reazioni:
• I reattivi elettrofili attaccano in prevalenza sull'azoto: nel caso di attacco sul nucleo,
la posizione meno sfavorita risulta essere la ß.
• I reattivi nucleofili prediligono le posizioni α− e γ.
• La piridina dà le reazioni di sostituzione elettrofila (SEAr) più difficilmente del
benzene.
• La piridina dà le reazioni di sostituzione nucleofila (SN Ar) più facilmente del
benzene.
• La piridina dà isomerizzazione di valenza sia termica che fotochimica (reazioni
radicaliche) analogamente al benzene.
Reazioni elettrofile sull'azoto:
159
N
X
R
N
N
X
X
H
Ar
RX
HX
ArX
A.HX
L
acido di Lewis
N
N
N
X
X
L
A
KO3SONH2
RCOX
KI
N
N
I
X
NH2
N
O
R
O
Reazioni di sostituzione elettrofila
H
E
E
+
N
E
-H
N
N
160
Le reazioni di sostituzione elettrofila avvengono con difficoltà e forniscono prodotti
di sostituzione in posizione 3. Sotto drastiche condizioni, la nitrazione a 300°C
avviene fornendo la 3-nitropiridina con resa non superiore al 15%. La solfonazione
avviene a temperature superiori a 250°C con oleum, in presenza di sali di mercurio
come catalizzatori, fornendo risultati differenti a seconda delle condizioni:
SO3H
SO3H
oleum,
HgSO4
360°C
250°C
N
N
N
Reazioni di sostituzione nucleofila
-X
Nu
X
N
X
N
Nu
X = alogeno, H
Nu = NH2, OH, RO, RS, RLI, AlH4, NH3, ammine
N
Nu
161
N-Ossidi di piridina
E' abbastanza interessante, da un punto di vista applicativo, lo studio della reattività
di N-ossidi di piridina:
R
R
R
PX3
RCO3H
-X3P=O
N
N
N
O
Gli N-ossidi della piridina danno le reazioni di sostituzione elettrofila (e nucleofila) alle
posizioni 2- e 4-:
N
N
O
O
N
O
N
N
O
O
162
La reattività dell'N-ossido nei confronti di alcune sostituzioni elettrofile è notevole.
La reazione di nitrazione procede velocemente già a temperatura ambiente, ed apre
così la possibilità di avere sostituenti in posizione 4. Le reazioni di solfonazione ed
alogenazione richiedono comunque condizioni più drastiche.
NO2
H
NO2
N
N
N
O
O
O
PCl3
H2/Pd
NH 2
RONa
NH2
OR
NO2
N
N
N
O
O
PCl3
N
163
METODI DI PREPARAZIONE
Alcune proposte di retrosintesi dell'anello della piridina.
+H 2O, - H
N
H
N
OH
NH HO
+
N
NH
O
O
O
NH 2 O
O
O
NH 2 O
NH 2 O
164
Guardiamo con un poco di attenzione qualche metodo di sintesi più moderno:
Reazioni di ciclocondensazione:
R2
R
R2
R3
O
EtOOC
+
R1
2
EtOOC
EtOOC
∆
R2
-H2O
R1
NH2
R3
NH2
R1
R3
N
O
O
R3
O
Reazione di composti 1,5-dicarbonilici con ammoniaca:
ossidazione
NH 3
R
O
O
R
R
NH2OH
N
H
R
R
H
H H
-H2 O
R
N
OH
R
N
R
165
Piridine per cicloaddizione:
[CpCo(CO)2]2
R
130°C
R
N
N
R= alchile, vinile, fenile
Interessante, a questo proposito, è il meccanismo di reazione:
CpCo
Cp
CpCo(I)
Co
prodotto
secondario
R
Cp
Co
N
N
R
(prodotto principale)
R
N
166
APPLICAZIONI ALLE SINTESI DI COMPOSTI ORGANICI
1) O-Acilazioni di ß-chetoesteri.
Sebbene molti esteri possano esser preparati da cloruri acidi, alcooli, e piridina,
il ruolo giocato da quest'ultima non è legato alla sua natura di eterociclo, bensì a
quella di ammina terziaria. Un caso nel quale la piridina ha un ruolo fondamentale
come "eterociclo" risulta la O-acilazione di ß-chetoesteri, in cui la piridina funziona
come tmplato (intermedio). La reazione è del tutto generale, ma solo nel caso della
reazione del benzoilcloruro con il benzoilacetato d'etile per dare l'etil
benzoilcinnamato, è stato isolato l'addotto con la piridina mostrato nello schema.
O
O
+
Ph
N
CO2Et
Ph
N
CO2Et
Cl
Ph
O
Ph
O
CO2Et
O
Ph
O
Ph
2) Sintesi di aldeidi.
La prima conversione diretta di un alogenuro alchilico, contenente il gruppo CH2X,
ad aldeidi con ugual numero di atomi di carbonio è stata riportata addirittura nel
1936.
167
X
R
RCH2X
+
N
N
R
R
N
+ Me 2N
NO
N
NMe 2
O
H3O
RCHO
Da allora, il metodo è stato ampiamente impiegato per la preparazione di un'ampia
varietà di aldeidi in rese da moderate a buone. In questa reazione funzionano bene
alogenuri alchilici, benzilici ed allilici e tosilati con funzionalità presenti in catena.
Più recentemente la reazione è stata applicata con successo, utilizzando però l'Nossido della piridina come unico reattivo, e semplificando così la procedura
sperimentale:
-BH
RCH2 X
N
O
N
+ RCHO
N
R
O
H
B
La reazione è stata quindi applicata con successo anche agli epossidi, per la
formazione con rese elevate di α-chetoalcooli.
168
R
O
-BH
O
+
R
N
N
CH2OH
N
Ph
O
O
H
O
L'impiego dell'N-ossido di piridina risulta essenziale anche nella procedura di
conversione di α−bromo acidi in aldeidi aventi un atomo di carbonio in meno
rispetto al substrato di partenza:
Br
R
∆
RCHO + CO2 +
COOH
N
N
O
O
Br
H
R
R
COOH
O
- HBr
O
O
N
N
RCHO
La reazione ha un preciso meccanismo ed il metodo degradativo comporta la
formazione di anidride carbonica.
169
3) Preparazione di 2-alchilpiridine
Un'altro uso importante degli N-ossidi di piridina comporta, per reazione con reattivi
di Grignard, la formazione di ossime insature ω−sostituite, che possono esser poi
riconvertite in 2-alchilpiridine per trattamento con anidride acetica.
R
RMgX
R
N
N
O
OMgX
N
H
OMgX
R
Ac2O
N
N
R
OH
Da notare, per finire, che la formazione dell'ossima è stereospecifica e la sua precisa
configurazione è stata stabilita mediante spettroscopia NMR ed IR.
COMPOSTI DI INTERESSE BIOLOGICO O NATURALI
Molti composti di origine naturale contengono l'anello piridinico, che risultano
essenziali in molti casi.
L'acido nicotinico (acido piridin-3-carbossilico), che è prodotto commer-cialmente
dalla 5-etil-2-metilpiridina, e la sua ammide (nicotinammide) appartengono al
gruppo B delle vitamine (vitamina B5 ). Il fabbisogno di un adulto è di ca. 20
mg/giorno e la mancanza dell'acido nicotinico causa la pellagra.
170
COOH
CONH 2
N
CH3
N
N
N
nicotinammide
acido nicotinico
nicotina
N
N
H
N
CH3
N
H
N
N
nicotirina
nornicotina
anabasina
La nicotina, la nornicotina, la nicotirina, l'anabasina sono alcuni dei prodotti
naturali che contengono piridina. Importanti sono anche il piridossale e la
piridossamina, entrambi appertenenti al gruppo delle vitamine B6.
CH2NH 2
CHO
HOH 2C
OH
N
piridossale
CH3
HOH 2C
OH
N
CH3
piridossammina
Il componente principale delle ossidoriduttasi (enzimi biologici) è costituito da
nicotinammide adenina dinucleotide (NAD, forma ridotta NADH). Il meccanismo di
azione procede attraverso un trasferimento reversibile di idrogeno alla posizione 4
del sistema nicotinammidico del coenzima NAD:
171
O
NH2
O
O
adeni na
P
O
O
N
O
O
O
OH
OH
OH
NAD
OH
OH
OH
O
O
H
NH2
N
R
H
NH2
+ H , + 2e
-H , - 2e
N
R