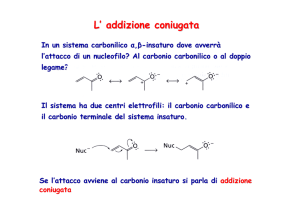
La chimica dei composti eterociclici
Gli eterocicli sono composti ciclici nei quali
almeno un atomo del ciclo non è carbonio
Gli eterocicli più
ù comuni contengono azoto, ossigeno o zolfo ma
anche derivati contenenti boro, silicio, fosforo o arsenico stanno
assumendo una certa importanza.
Gli eterocicli vengono classificati come aliciclici o aromatici.
Negli eterocicli aromatici un doppietto elettronico dell’eterociclo
può partecipare al sistema aromatico o essere ortogonale.
Eterocicli contenenti azoto sono molto importanti nei sistemi
biologici.
La presenza dell’eteroatomo facilita la formazione e la rottura
del ciclo mentre la presenza del ciclo ne orienta i doppietti
elettronici influenzando la reattività e la conformazione
dell’eterociclo.
La chimica dei composti eterociclici
Nomenclatura degli eterocicli saturi
La nomenclatura degli eterocicli saturi divide il nome in tre parti:
Eteroatomo
dimensioni dell’anello grado di insaturazione
az (N)
oss (O)
ti (S)
AzAz
-ir
ir-idina
ir = 3
et = 4
ol = 5
= 6
ep = 7
oc = 8
azaz
-et
et-idina
ene o ine se insaturi
idine o ane se saturi
ossoss
-ir
ir-ano
didi
-oss
oss-ol
ol-ano
1
Eterocicli saturi
Cicli a tre atomi: ossirani, aziridine e tiirani
Gli eterocicli a tre atomi, a causa della tensione di anello,
reagiscono facilmente con nucleofili.
Epossidi o ossirani (eteri ciclici)
2
Reazioni di sostituzione stereospecifica (SN2)
Controllo regiochimico della reazione
Sostituzione alla posizione meno sostituita -meno ingombrata
3
Apertura di anello nucleofila, acido catalizzata
opposta regiochimica
Controllo della regiochimica della sostituzione
pH 7
pH
H 3.8
3 8
4
Sintesi di epossidi
Sostituzione nucleofila
Ossidazione elettrofila
Ossidazione nucleofila
Aziridine (ammine cicliche)
Sintesi
L’addizione a aziridine avviene in maniera analoga a quanto
avviene con gli epossidi
5
Racemizzazione delle Aziridine
(processo molto più lento rispetto alle ammine lineari)
Le aziridine possono essere a loro volta dei nucleofili
Cicli a tre atomi: ossirani, aziridine e tiirani
6
Cicli a quattro atomi: ossetani, azetidine e tietani
Gli eterocicli a quattro atomi sono anch’essi in grado di reagire
con nucleofili anche se la reattività è molto inferiore.
Cicli a cinque/sei atomi:
tetraidrofurano, pirrolidina e tetraidrotiofene
Gli anelli a 5/6 atomi sono essenzialmente inerti alla sostituzione
nucleofila. Questi derivati si comportano esattamente come gli analoghi
derivati lineari.
Pr d tt c
Prodotto
contro
ntr il m
mall di macchina
m cchin
tranquilizzante
7
Sintesi di enammine (Pirrolidina)
Queste enammine sono piuttosto stabili poiché la pirrolidina o la
piperidina sono più nucleofile delle corrispondenti ammine
alifatiche.
Questo è comune a tutte le ammine cicliche ed è un effetto di
origine
g
sterica
Nucleofilicità di ammine terziarie
Confrontate i valori delle pKa delle ammine terziarie con quelle
secondarie:
8
Un protone è troppo piccolo per risentire degli effetti sterici.
Invece la presenza di altri eteroatomi sull’anello influenza
notevolmente la pKa. La presenza di un gruppo elettron
attrattore diminuisce la densità elettronica sull’azoto
rendendolo meno basico e meno nucleofilo.
Per cui la morfolina può essere una base mlto utile: meno
basica
b i d
della
ll ttrietilammina
i til
i ma più
iù basica
b i d
della
ll piridina
i idi
(pKa=5.2).
I due valori di pKa della piperazina e del DABCO (8.8 e 3.0)
sono così diversi per l’effetto elettronelettron-attrattore dell’ammina
protonata sulla non protonata.
La reazione di BaylisBaylis-Hillmann
DABCO buon nucleofilo e buon gruppo uscente
9
Basi forti non nucleofile
LDA
Ancora più selettiva dell’LDA
1,31,3
-ditiani (acil anioni equivalenti)
Un atomo di zolfo è in grado di stabilizzare un anione
adiacente.. L’anione può essere generato per semplice reazione
adiacente
con un alchil litio.
litio. Questi sistemi vengono definiti acil anioni
equivalenti
i l ti o acil
il sintoni
i t i
L’anione dell’analogo ciclo a 5
termini, 1,3-ditiolano, non è
stabile e decompone
10
1,31,3
-ditiani (acil anioni equivalenti)
E’ come se, formalmente, avesse
reagito un acil anione, sistema che
non esiste
Umpolung della reattività
Passando da chetone a ditiano si inverte la polarità
dell’atomo di carbonio da elettrofilo a nucleofilo
11
Rimozione gruppo ditianico (più stabili dei diossani all’idrolisi)
Esercizio: sebbene l’anione del ditiolano decompone, la reazione
mostrata avviene. Suggerire un possibile meccanismo
12
Dire se queste reazioni sono SN1 o SN2 e motivare la regiochimica osservata
Indicare la stereochimica dei prodotti ottenuti
Individuare gli intermedi di questa sintesi e proporre un meccanismo
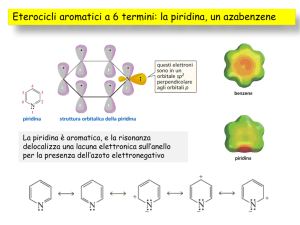
Piridina: eterociclo analogo al benzene che può comportarsi da
base e da nucleofilo
Il doppietto elettronico
non condiviso della piridina
giace nel piano dell
dell’anello
anello,
lo stesso su cui giacciono i
legami C
C-H
13
Il fatto che il doppietto elettronico non condiviso dell’ azoto giaccia
sul piano dei legami CH ha un importante ricaduta sulla sua reattività:
la piridina può agire da base o nucleofilo senza che questo rompa il
sistema aromatico
La piridina può essere usato come un solvente. Oltre a solubilizzare i
composti, la piridina può anche agire da base (ione piridinio, pKa=
5.2).
La piridina può anche agire da nucleofilo con alchil alogenuru primari e
secondari (meglio con MeI e PhCH2X)
14
La piridina agisce anche da legante per metalli di transizione.
per esempio il complesso di Collins CrO3/Py2 che viene usato per
l’ossidazione selettiva di alcoli primari ad aldeidi
La principale differenza nella reattività della piridina rispetto al benzene
è che non subisce sostituzione aromatica elettrofila facilmente
Se si analizzano le formule di risonanza della piridina si vede come in
di
diverse
di esse vii sia
i una carica
i negativa
ti sull’azoto.
ll’
t
La piridina non reagisce nei confronti delle sostituzioni aromatiche
elettrofile per due ragioni principali:
1. L’anello è elettron deficente a causa della presenza dell’azoto (EWG)
2. Il centro più nucleofilo della piridina è l’atomo di azoto. Se un
elettrofilo reagisce con l’azoto l’anello diventa ancor più elettronelettron-povero
e quindi ancor meno reattivo.
reattivo
Si ha reazione solo in condizioni molto drastiche
15
La sostituzione avviene solitamente in posizione 3, che è la meno
povera di elettroni.
La presenza di gruppi elettron donatori attiva la molecola nei confronti degli
elettrofili e le reazioni possono avvenire in condizioni più blande
Se in 3 vi è un sostituente la posizione che viene attivata dipende dalla
natura del sostituente: se è un forte gruppo attivante questo prevale
(primo caso) se invece è poco attivante si ha la sostituzione in posizione
meta (secondo caso).
16
Esercizio: quale è il prodotto maggioritario atteso nelle seguenti
reazioni?
Le piridine non sono buoni substrati per le sostituzioni elettrofile per
cui non sono inerti nei confronti dei nucleofili. Vi è una certa analogia
tra la reattività delle piridine e quella dei composti carbonilici.
17
Addizione nucleofila di composti organometallici e/o basi forti
Un nucleofilo carico reagirà con una
2-alopiridina portando al prodotto di
sostituzione.
Questo processo è assimilabile alla reazione di un acil cloruro con un
nucleofilo
Come
om qualsiasi
qua s as reazione
r az on di addizioneaddizione
a z on eliminazione di derivati degli acidi
carbossilici, si ha la formazione di un
intermedio tetraedrico stabilizzato
per risonanza, seguito dall’
eliminazione dello ione Br- che
ripristina il sistema aromatico.
Esercizio: 4
4-alopiridine reagiscono facilmente con nucleofili. Proporre
un meccanismo per la reazione seguente e spiegare perché la
trasformazione avviene così facilmente.
18
Un esempio più sorprendente dell’addizionedell’addizione-eliminazione nucleofila è la
sintesi delle 2
2-amino piridine, ottenute per trattamento della piridina
con sodio ammide.
La reazione avviene in maniera analoga alle 22-alopiridine,
alopiridine solo che in
questo caso il gruppo uscente è uno ione idruro.
In questo caso la driving force
che permette di eliminare un
idruro è il ripristino della
aromaticità del sistema
Lo ione idruro che viene
eliminato reagisce con il nuovo
gruppo amminico (pKa=35)
generando H2 e spostando a
destra l’equilibrio
Gli alchil litio reagiscono nello
stesso modo. In questo caso gli
ioni
i i id
idruro vengono eliminati
li i
i con il
workwork
-up acquoso
19
Non tutti i nucleofili reagiscono in posizione 2 alla piridina. In particolare
nucleofili meno forti di un’ammide o un reagente organo litio non reagiscono
con la piridina stessa ma con suoi derivati carichi positivamente quali un Nossido e un sale di N-alchil piridinio. Di fatto si ha competizione tra la
reattività in posizione 2 e l’addizione coniugata, analogamente a quanto
avviene con gli enoni.
L’addizione coniugata può anche
avvenire su gruppi insaturi
esociclici
L’addizione di uno ione idruro a un anello piridinico è alla base di molto
processi riduttivi in ambiente biologico
Il NAD+ è in grado di ossidare alcoli a composti carbonilici mediante
formale addizione di un idruro al NAD+. La reazione avviene in posizione 4
poiché il processo avviene all’interno di un sito attivo enzimatico, ma il
processo è del tutto analogo a quanto visto in precedenza.
20
Con sistemi artificiali l’addizione avviene generalmente in posizione 2
La riduzione più proseguire portando alla tetraidro piridina neutra
Deprotonazione di alchil piridine
Alcune alchil piridine possono essere deprotonate in presenza di basi forti
(pKa=20). Si genera un carbanione analogo ad uno ione enolato.
Possono fornire reazioni di sostituzione o addizione a carbonili
21
I derivati carichi delle 2
2-alchil piridine sono ancor più acidi. La reazioni
con aldeidi fornisce il prodotto insaturo, analogamente a quanto avviene
nella condensazione aldolica mista.
Le diazine manifestano reattività simili alla piridina
NH2
O
N
N
H
O
NH
O
Citosina
N
H
Timina
NH
O
N
H
O
La pirimidina è il più importante eterociclo di
questo gruppo poiché questo sistema è alla
base di tre delle basi degli acidi nucleici.
Uracile
Questi derivati sono basi più deboli della piridina e praticamente
inerti nei confronti delle sostituzioni elettrofile aromatiche.
Al contrario sono molto più reattive nei confronti di basi e nucleofili,
in particolar modo la pirimidina nella quale una posizione è in alfa a
due atomi di azoto.
Le reazioni di sostituzioni avvengono fino ad un milione di volte più
velocemente rispetto all’analoga piridina
22
Anche altre trasformazioni sono facilitate alla posizione 2 (per
esempio la condensazione aldolica catalizzata da acidi di Lewis)
Esercizio: Proporre un meccanismo ragionevole per la seguente
reazione di addizioneaddizione- eliminazione
Le chinoline e isochinoline sono piridine con anelli benzenici fusi che
sono correlati strutturalmente con il naftalene
Hanno sistemi Π estesi simili al naftalene e condividono le proprietà
del sistema benzenico e piridinico.
I sistemi policiclici aromatici hanno una energia di stabilizzazione
inferiore rispetto a quella attesa (4n+2 elettroni)
23
Grazie alla presenza dell’anello
dell anello benzenico la chinolina e la isochinolina
subiscono facilmente sostituzione elettrofila alla porzione carbociclica
Reazioni nucleofile invece avvengono all’anello piridinico
Per le isochinoline l’atomo di carbonio tra l’azoto e l’anello benzenico
è più attivata e quindi la reazione nucleofila avviene prevalente in
questa posizione.
24
Sintesi di chinoline
Mentre le piridine vengono preparate da precursori adatti che si ottengono
dal carbone o derivati del petrolio, le chinoline vengono generalmente
ottenute a partire da derivati dell’anilina.
Sintesi di Skraup:
p in q
questa sintesi si p
parte dall’addizione coniugata
g
dell’anilina all’acroleina.
Nelle condizioni fortemente acide richiesta dalla reazione, si genera
un intermedio carbocationico.
L’intermedio carbocationico subisce un’alchilazione elettrofila all’anello
benzenico seguita da una deidratazione che fornisce una diidrochinolina.
La chinolina viene ottenuta in seguito a ossidazione
25
Sintesi di Friedlander: inizialmente si ottiene un ammino chetone via
condensazione aldolica mista.
L’ammino chetone
autocondensa generando
l’anello con la concomitante
formazione di un doppio
legame C=N (legami
imminico)
Esercizio: proporre un meccanismo per la seguente reazione di
Friedlander.
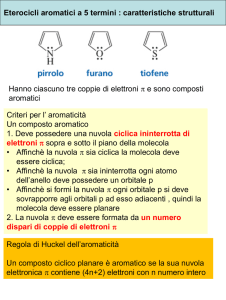
Il pirrolo è un eterociclo pentaatonico contenente un atomo di azoto.
Ha una struttura simile all’anione ciclopentadienile
Il doppietto elettronico è coinvolto nel sistema aromatico: il pirrolo è un
derivato aromatico ed è una base debole. Viene protonato difficilmente
(protonazione al carbonio è favorita). pKa pirrolo protonato= -4
26
Analizzando le strutture di risonanza del pirrolo si vede che tutti i
carboni hanno parziale carica negativa. Questo lo rende reattivo nei
confronti degli elettrofili.
Il pirrolo gioca un ruolo fondamentale nei sistemi biologici che sono in
grado di chelare i metalli quali le porfirine e le clorine
clorine:: il sistema a base
di queste strutture è la porfina
porfina,, un sistema coniugato planare a 18
elettroni
Il complesso di ferro della protoporfirina IX, comunemente chiamata
eme,, è il sistema funzionale presente nell’emoglobina e nella mioglobina,
eme
usata dai mammiferi per il trasporto e accumulo di O2.
La clorofilla ha un macrociclo dello stesso tipo chiamato clorina, nel quale
un doppio legame di uno dei pirroli è stato ridotto. Il sistema rimane
comunque aromatico.
27
Il pirrolo può essere preparato in molti modo, ma il più semplice è quello
di far reagire un dichetone con un’ammina. Nel processo si ha la
formazione di un’immina, un’addizione nucleofila dell’azoto al secondo
composto carbonilico, eliminazione d’acqua e deprotonazione
Furano e tiofene hanno strutture simili al pirrolo
L’eteroatomo contribuisce all’aromaticità del sistema con uno dei doppietti
di elettroni non condivisi. Il secondo doppietto è perpendicolare al
sistema Π.
L’energia di stabilizzazione del sistema aromatico per il furano è di 11
kcal/mol
k l/ l (b
(benzene: 36 k
kcal/mol).
l/ l) P
Per cuii il f
furano subisce
bi
reazioni
i i di
addizione piuttosto che sostituzione.
28
Il furano viene facilmente idrolizzato in condizioni acide. La protonazione
dell’ossigeno, seguita da attacco nucleofilo dell’acqua porta alla fomazione
di due funzioni carboniliche (1,4 dichetone).
Il furano subisce reazioni tipiche dei dieni: addizione a bromo in 1,4 e
reazioni di cicloaddizione (reazione di DielsDiels-Alder)
29
Un diene può dare addizioni 1,2 e 1,4. I due doppi legami di un diene
sono coplanari e vi è un certo overlap tra gli orbitali p (evidenziato dalle
formule di risonanza minori). Vengono quindi definiti dieni coniugati.
Addizione di HBr.
Lo ione bromuro può reagire sia in posizione 2 che 4 del catione allilico.
Se si effettua la reazione a
0°C si ottengono i due
prodotti, 3
3-bromo
bromo-1-butene e
1-bromo
bromo-2-butene,
butene in un
rapporto 70:30.
A temperature più elevate,
40°
40
°C, il rapporto si inverte e
diventa 15:85.
30
Controllo cinetico verso controllo termodinamico della reazione
31
Mentre il furano reagisce generalmente come un diene, il pirrolo lo fa
raramente. L’anello del pirrolo è elettron ricco e facilmente subisce
reazioni di sostituzione elettrofila (a differenza della piridina).
Per esempio reagisce con anidride acetica per dare il 2
2-acetil pirrolo
senza bisogno di catalizzatore (acilazioni di FriedelFriedel-Craft)
Perchè la reazione avviene in 2?
Sistema più stabilizzato per risonanza
Le reazioni del pirrolo con reagenti elettrofili vengono complicate dalla sua
instabilità in presenza di acidi minerali, che spesso portano a
polimerizzazione. La nitrazione, ad esempio, viene effettuata in
condizioni più blande utilizzando acetil nitrato.
Una delle applicazioni più interessanti delle addizioni elettrofile al pirrolo
è la sintesi del nucleo porfirinico.
32
I passaggi fondamentali sono i seguenti:
Formazione dell’elettrofilo
Sostituzione al pirrolo in 2
Protonazione all’alcol e uscita di acqua genera un nuovo carbocatione
Sustituzione al pirrolo in 2
dipirrilmetano
Incorporazione di un altro pirrolo via sostituzione elettrofila
33
Con sequenze di reazioni analoghe si ottiene un tetrapirrolo lineare che
ciclizza per portare ad un precursore della porfirina
Un’ossidazione converte il tetrapirrolo nella tetrafenil porfirina aromatica
34
Il furano e il tiofene anche subiscono facilmente sostituzioni
elettrofile. Il furano reagisce con l’anidride acetica ma in presenza
di un acido di Lewis
L’acetil nitrato reagisce con il furano via addizione 1,4. In
presenza di una base, si può rimuovere il protone in α al gruppo
nitro rigenerando il sistema aromato mediante eliminazione di uno
ione acetato.
Il tiofene è un po’ meno sensibile all’ambiente acido. E’ comunque più
reattivo del benzene.
35
L’indolo è l’analogo del pirrolo analogamente alla chinolina e piridina
In questo caso il benzene ha una maggiore influenza sulla reattività
dell’eterociclo, come si vede dalle formule di risonanza riportate di
seguito.
In questo caso il benzene ha una maggiore influenza sulla reattività
dell’eterociclo, come si vede dalle formule di risonanza riportate di
seguito.
Le strutture evidenziate mostrano come la posizione in 3 sia la più
reattiva nei confronti di un elettrofilo, al contrario del pirrolo nel quale la
posizione più reattiva è quella in 2.
36
Reazione di Mannich:
Predirre la regiochimica delle reazione di sostituzione per l’indolo non è
così facile come per altri eterocicli. I risultato spesso dipendono dalle
condizioni di reazione.
E’ interessante vedere che l’anello indolico nel
triptofano ha la catena laterale attaccata in
posizione 3. Questa catena origina da una serina
37
La sostituzione elettrofila con l’indolo porta, dopo idrolisi ad ottenere il
triptofano.
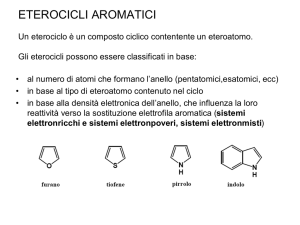
Gli azoli sono composti eterocicli pentaatomici che hanno 2 eteroatomi
Nell’imidazolo un azoto è simile al pirrolo, partecipa al sistema Π e ha
un CH nel piano, mentre l’altro ha un doppietto lontano dall’anello,
analogamente alla piridina.
E’ più basico della piridina: perchè?
38
Un azolo reagisce facilmente come nucleofilo,
grazie all’azoto basico. Si possono facilmente
isolare i sali per reazione con alchil alogenuri
L’imidazolo
L imidazolo può essere trattato con una base per fornire un nucleofilo
ancor più forte. La reazione con in RX fornisce un alchil imidazolo
Regiochimica
Se l’azoto è già alchilato, in presenza di una base forte si ha
deprotonazione al carbonio in 2. Alchil litio puà reagire con un
elettrofilo quale un C=O. Il tiazolo reagisce analogamente.
Questa reattività è profondamente diversa da quanto si ottiene con la
piridina.. Un alchil litio da una reazione di sostituzione in 2.. Per
p
avere una piridina litiata bisogna eseguire uno scambio alogenoalogeno-metallo
39
Gli azoli subiscono reazioni di sostituzione elettrofila aromatica.
A causa della loro aromaticità gli azoli possono fornire reazioni di
sostituzione elettrofila aromatica. L’imidazolo ha una reattività
intermedia tra il pirrolo e la piridina ed è più reattivo del tiazolo e
dell’ossazolo. La posizione 4 è più reattiva.
Le posizione 4 e 5 dell’imidazolo sono equivalenti poichè il protone può
dissociare dall’ N1 e reagire con l’N3. E’ un processo di tautomeria.
Preparazione degli azoli: generalmente si utilizzano clorometil o
aminometilchetoni con amidi, urea o tiourea
Un tiazolo alchilato è un’importante porzione della vitamina B1
40