1/7
MINI SCHEDA HTA BEVACIZUMAB (AVASTIN®)
INDICAZIONE CARCINOMA OVARICO
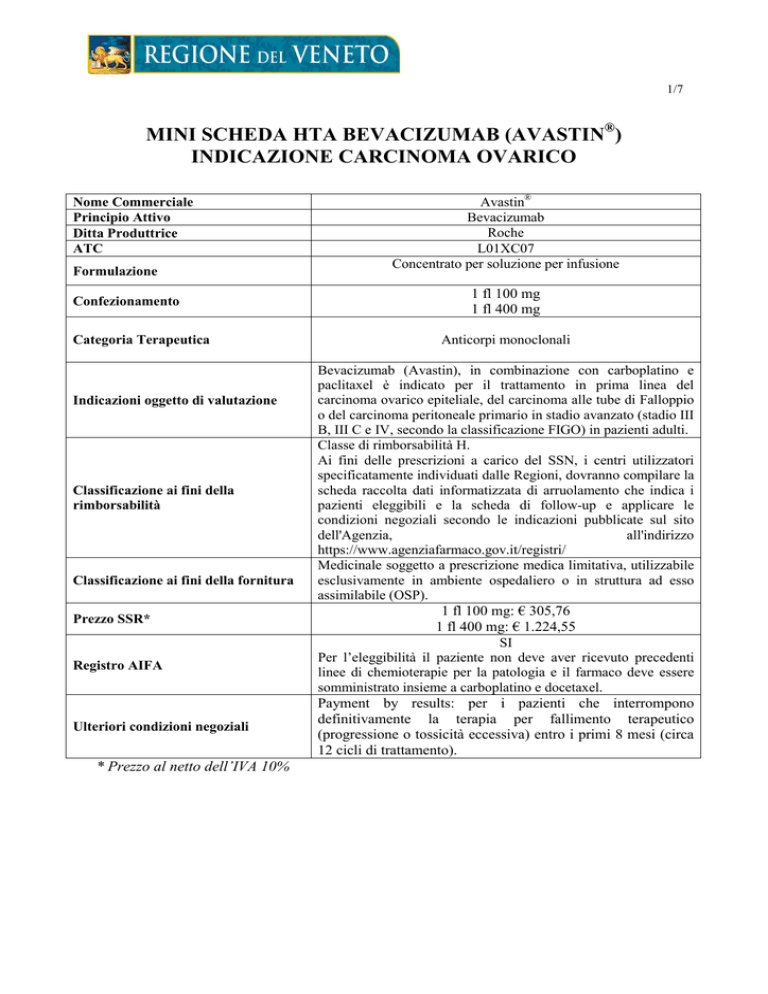
Nome Commerciale
Principio Attivo
Ditta Produttrice
ATC
Formulazione
Confezionamento
Categoria Terapeutica
Indicazioni oggetto di valutazione
Classificazione ai fini della
rimborsabilità
Classificazione ai fini della fornitura
Prezzo SSR*
Registro AIFA
Ulteriori condizioni negoziali
* Prezzo al netto dell’IVA 10%
Avastin®
Bevacizumab
Roche
L01XC07
Concentrato per soluzione per infusione
1 fl 100 mg
1 fl 400 mg
Anticorpi monoclonali
Bevacizumab (Avastin), in combinazione con carboplatino e
paclitaxel è indicato per il trattamento in prima linea del
carcinoma ovarico epiteliale, del carcinoma alle tube di Falloppio
o del carcinoma peritoneale primario in stadio avanzato (stadio III
B, III C e IV, secondo la classificazione FIGO) in pazienti adulti.
Classe di rimborsabilità H.
Ai fini delle prescrizioni a carico del SSN, i centri utilizzatori
specificatamente individuati dalle Regioni, dovranno compilare la
scheda raccolta dati informatizzata di arruolamento che indica i
pazienti eleggibili e la scheda di follow-up e applicare le
condizioni negoziali secondo le indicazioni pubblicate sul sito
dell'Agenzia,
all'indirizzo
https://www.agenziafarmaco.gov.it/registri/
Medicinale soggetto a prescrizione medica limitativa, utilizzabile
esclusivamente in ambiente ospedaliero o in struttura ad esso
assimilabile (OSP).
1 fl 100 mg: € 305,76
1 fl 400 mg: € 1.224,55
SI
Per l’eleggibilità il paziente non deve aver ricevuto precedenti
linee di chemioterapie per la patologia e il farmaco deve essere
somministrato insieme a carboplatino e docetaxel.
Payment by results: per i pazienti che interrompono
definitivamente la terapia per fallimento terapeutico
(progressione o tossicità eccessiva) entro i primi 8 mesi (circa
12 cicli di trattamento).
2/7
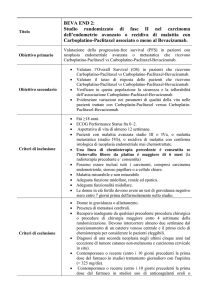
Parere CTRF
Il trattamento con bevacizumab, aggiunto ad un regime standard di chemioterapia a base di
carboplatino e paclitaxel nel carcinoma ovarico, ha dimostrato un modesto miglioramento in termini
di PFS rispetto alla sola terapia standard. Nello studio COG-0218 la differenza nella PFS mediana è
stata di 3,8 mesi a favore del braccio sperimentale, mentre nello studio ICON-7 la differenza è stata
di 2,4 mesi. Un’analisi dello studio ICON-7 in un sottogruppo predefinito di pazienti ad alto rischio
di progressione della malattia (malattia di stadio FIGO IV o FIGO malattia in stadio III e > 1,0
centimetro di malattia residua dopo debulking chirurgico) ha dimostrato un maggior beneficio: la
PFS è stata di 16 mesi nel gruppo bevacizumab rispetto a 10,5 mesi nel gruppo con terapia standard.
Tuttavia questo studio è stato condotto in aperto e la dose di bevacizumab utilizzata (7,5 mg/kg)
non è quella registrata. In nessuno dei due studi le differenze in termini di sopravvivenza generale e
di tasso di risposta obiettiva si sono dimostrate statisticamente significative. Il profilo di tollerabilità
di bevacizumab è risultato peggiore rispetto al braccio di controllo e gli eventi avversi più comuni
hanno interessato il sistema gastrointestinale (dolori addominali, costipazione, diarrea, nausea e
vomito) ed il sistema nervoso (mal di testa, neuropatia sensoriale periferica). Il costo del trattamento
per 15 mesi è di circa € 67 mila, che si va a sommare ad una chemioterapia di carboplatino e
paclitaxel che ha un costo trascurabile. Nell’ipotesi di trattare 35 pazienti per anno nella Regione
Veneto, considerando anche il meccanismo di Payment by Results a 8 mesi di terapia, si può
stimare un impatto sulla spesa di circa € 1.650.000, una volta che il farmaco andrà a regime.
Sulla base di tali evidenze il rapporto costo/beneficio del farmaco risulta non favorevole. Il
farmaco potrebbe avere un ruolo nella sottopopolazione di pazienti ad alto rischio di
progressione della malattia, in cui sembra aver dimostrato un maggior beneficio.
In conclusione
Efficacia: miglioramento modesto rispetto al comparator utilizzato nello
studio clinico.
Sicurezza: profilo peggiore rispetto al comparator utilizzato nello studio
clinico.
Costo: molto più elevato rispetto alla terapia standard.
Eventuali specifiche raccomandazioni sull'utilizzo potranno
perfezionate dalla Rete Oncologica Veneta.
essere
3/7
Meccanismo d’azione e posologia
Il bevacizumab, legandosi al fattore di crescita delle cellule endoteliali vascolari (VEGF),
promotore chiave della vasculogenesi e dell’angiogenesi, impedisce a quest’ultimo di legarsi ai suoi
recettori, Flt–1 (VEGFR–1) e KDR (VEGFR–2), sulla superficie delle cellule endoteliali. Il blocco
dell’attività biologica del VEGF fa regredire la vascolarizzazione dei tumori, normalizza la
vascolarizzazione tumorale residua, e inibisce la formazione di nuova vascolarizzazione, impedendo
perciò la crescita tumorale [1].
Bevacizumab è somministrato in combinazione a carboplatino e paclitaxel per 6 cicli di terapia,
seguiti dalla somministrazione di bevacizumab in monoterapia da proseguire per un massimo di 15
mesi o fino a progressione di malattia o fino a che non compaia tossicità inaccettabile, qualsiasi di
queste si manifesti prima.
La dose raccomandata di bevacizumab è di 15 mg/kg di peso corporeo, da somministrarsi una volta
ogni 3 settimane mediante infusione endovenosa.
Linee guida
Le recenti linee guida dell’AIOM sul carcinoma all’ovaio [2] riportano che la terapia standard nelle
pazienti con carcinoma ovarico di fase avanzata (stadio IIb – IV) è rappresentata dall’associazione
di carboplatino e paclitaxel (raccomandazione 1++). L’associazione di bevacizumab con
carboplatino e paclitaxel per 6 cicli e successivamente la monoterapia con bevacizumab viene
raccomandata nelle pazienti con carcinoma ovarico di stadio IIIb/IV (raccomandazione 1++).
Efficacia
L’utilizzo di bevacizumab in combinazione con chemioterapia, nel trattamento di prima linea nel
carcinoma ovarico è supportato da due RCT di fase III: GOG-0218 [3] ed ICON7 [4]. GOG -0218 è
stato condotto su 1873 donne con diagnosi di carcinoma epiteliale dell’ovaio non trattato
precedentemente di stadio III o IV, carcinoma primario peritoneale o carcinoma delle tube. Tutti i
pazienti avevano subito un intervento chirurgico entro 12 settimane dall'entrata studio per stabilire il
sito primario e lo stadio del tumore e per la massima asportazione del tumore. I pazienti sono stati
randomizzati ad uno dei tre gruppi di trattamento:
o Braccio CPP: Placebo in combinazione a carboplatino (AUC 6) e paclitaxel (175 mg/m2)
per 6 cicli seguiti dalla somministrazione di solo placebo fino a 15 mesi di terapia.
o Braccio CPB15: Bevacizumab (15mg/kg q3w) in combinazione a carboplatino (AUC 6) e
paclitaxel (175mg/m2) per 6 cicli seguiti dalla somministrazione di solo placebo fino a 15
mesi di terapia.
o Braccio CPB15+: Bevacizumab (15mg/kg q3w) in combinazione a carboplatino (AUC 6) e
paclitaxel (175mg/m2) per 6 cicli seguiti dalla somministrazione continua di bevacizumab in
monoterapia (15mg/kg q3w) fino a 15 mesi di terapia
Nei due bracci sperimentali la somministrazione di bevacizumab è iniziata dal 2° ciclo di
chemioterapia. La randomizzazione è stata stratificata per Ginecologia Oncology Group (GOG )
performance status (0 vs 1 o 2) e stadio della malattia. L’endpoint primario era la PFS nella
popolazione ITT valutata dai ricercatori considerando la progressione di malattia in base alle
immagini radiologiche, ai livelli del CA 125 o al peggioramento dei sintomi secondo i criteri GCIG.
Il trattamento è stato interrotto alla progressione di malattia, tossicità inaccettabile o al
completamento di tutti i 22 cicli di terapia. I risultati sono riportati in tabella 1. Gli endpoint
secondari erano la sopravvivenza globale (OS) e il tasso di risposta obiettiva (ORR): i risultati non
4/7
hanno evidenziato alcuna differenza significativa tra i gruppi relativamente a questi due endpoint.
Nell'analisi finale (quando il 47 % dei pazienti era morto) l’OS mediana è stata di 40,6 mesi nel
gruppo di controllo, 38,8 mesi nel gruppo CPB15 e di 43,8 mesi nel gruppo CPB15+, ma la
differenza tra il braccio placebo e i due bracci attivi non è stata statisticamente significativa. L’
ORR è stata del 63% nel gruppo di controllo e 66% nei gruppi CPB15 e CPB15+.
Lo studio ICON 7 è un RCT condotto in aperto, con lo scopo di valutare l’effetto dell’aggiunta di
bevacizumab a carboplatino e paclitaxel, dopo intervento chirurgico, in pazienti con: carcinoma
ovarico epiteliale, carcinoma alle tube di Falloppio o carcinoma peritoneale primario in stadio I o
IIA secondo la classificazione FIGO (grado 3 o sottotipo istologico a cellule chiare; n = 142), o
stadio IIB - IV secondo la classificazione FIGO (tutti i gradi e tutti i tipi istologici, n = 1386). Dallo
studio sono stati esclusi i pazienti precedentemente trattati con bevacizumab o terapia
antineoplastica per carcinoma ovarico (ad esempio chemioterapia, terapia con anticorpi
monoclonali, terapia con inibitori delle tirosinchinasi o terapia ormonale) o che avevano
precedentemente ricevuto un trattamento radioterapico dell’addome o della pelvi. Un totale di 1528
pazienti è stato randomizzato, in rapporti uguali, nei seguenti due bracci:
o Braccio di controllo: Carboplatino (AUC 6) e paclitaxel (175mg/m2) per 6 cicli ogni 3
settimane
o Braccio bevacizumab: Carboplatino (AUC 6) e paclitaxel (175mg/m2) per 6 cicli ogni 3
settimane in combinazione a bevacizumab (7,5mg/kg q3w) fino a 12 mesi (la
somministrazione di bevacizumab è iniziata dal 2° ciclo di chemioterapia se il trattamento è
stato iniziato a 4 settimane dall’intervento chirurgico o dal 1° ciclo se il trattamento è stato
iniziato 4 settimane dopo l'intervento chirurgico).
La maggior parte dei pazienti era in stadio III secondo la classificazione di FIGO (68% in entrambi
i bracci) seguito dallo stadio IV secondo la classificazione di FIGO (13% e 14%), Stadio II secondo
la classificazione di FIGO (10% e 11%) e Stadio I secondo la classificazione di FIGO (9% e 7%).
L’endpoint primario era la PFS, valutata dallo sperimentatore utilizzando i criteri RECIST e i
risultati sono riportati in tabella 1.
E’ stata eseguita un’analisi in un sottogruppo pre-definito di pazienti ad alto rischio di progressione
della malattia (malattia di stadio FIGO IV o FIGO malattia in stadio III e > 1,0 centimetro di
malattia residua dopo debulking chirurgico) in 465 pazienti (30% del tot: 234 pazienti nel gruppo di
trattamento standard e 231 pazienti nel gruppo bevacizumab). In questo sottogruppo di pazienti la
PFS stimata è stata di 10,5 mesi nel gruppo terapia standard, rispetto a 16 mesi nel gruppo
bevacizumab (HR 0,73, IC 95% : 0,60-0,93 ). Gli endpoint secondari includevano OS e ORR . In
un'analisi ad interim, 200 pazienti nel gruppo di trattamento standard erano morti, rispetto ai 178
pazienti nel gruppo bevacizumab (HR 0,85 , IC 95% : 0,70-1,04 ). Nei pazienti ad alto rischio di
progressione della malattia , 109 pazienti nel gruppo di trattamento standard erano morti, rispetto a
79 nel gruppo bevacizumab (HR 0.64 , 95% CI: 0,48-0,85 ). Dati di sopravvivenza complessivi
finali sono attesi per il 2013. L'ORR nel gruppo chemioterapia standard è stata del 55% contro il
65% nel gruppo bevacizumab.
5/7
Tabella 1. Dati di efficacia
Referenza
GOG-0218
[3]
ICON-07 [4]
Trattamenti
Misure di esito
Risultati
principali
Dimostrata la superiorità vs
Braccio CPP: Pb + CP (AUC 6) e Pacli (175 Endpoint
CPP solo per il braccio
mg/m2) q3w 6 cicli, poi Pb q3w [N=625] primario
PFS
CPB15+
versus
CPP:
10,3
mesi;
Braccio CPB15: Beva (15mg/kg q3w) + CP
CPB15: 11.2 mesi
(AUC 6) e pacli (175mg/m2) per 6 cicli poi
CPB15+:
14,1
mesi
Pb
q3w.
[N=625]
HR CPB15 vs CP: 0.908 (IC
95% 0,795-1,040; P = 0.16)
Braccio CPB15+: Beva (15mg/kg q3w) +
HR CPB15+ vs CP: 0,717 (IC
2
CP (AUC 6) e pacli (175mg/m ) per 6 cicli
95%: 0,625-0,824, P <0.001)
poi
Beva
q3w
[N=623]
Trattamento fino a 15 mesi
CP (AUC 6) + paclitaxel (175mg/m2) q3w, Endpoint
per
6
cicli
[N=764] primario
PFS
versus
2
CP (AUC 6) + pacli (175mg/m ) per 6 cicli
q3w + beva (dal 2° ciclo; 7,5mg/kg q3w)
fino a 12 mesi [N=764]
CP: carboplatino; pacli: paclitaxel; beva: bevacizumab
Dimostrata la superiorità del
gruppo bevacizumab.
CP+pacli: 17,4 mesi
Beva + CP + pacli: 19,8 mesi
HR 0,87 (IC 95%: 0,77-0,97 )
.
Sicurezza
Nello studio GOG-0218 [3] gli eventi avversi più comuni hanno interessato il sistema
gastrointestinale (dolori addominali, costipazione, diarrea, nausea e vomito) ed il sistema nervoso
(mal di testa, neuropatia sensoriale periferica). I decessi a causa di eventi avversi sono stati riportati
per sei pazienti del gruppo di controllo (1 %), 10 pazienti del gruppo CPB15 (1,6 %) e 14 pazienti
del gruppo CPB15+ (2,3%). Questi eventi avversi hanno incluso le infezioni in pazienti
neutropenici e perforazioni gastrointestinali e sono accadute durante il periodo che il bevacizumab è
stato associato alla chemioterapia. Nello studio ICON7 [4] eventi di perforazione gastrointestinale
sono stati riportati in 10 pazienti nel gruppo bevacizumab rispetto a 3 pazienti nel gruppo
chemioterapia standard ed ipertensione in 46 pazienti nel gruppo bevacizumab rispetto ai 2 pazienti
nel gruppo chemioterapia standard. Sono stati segnalati cinque decessi correlati al trattamento, uno
nel gruppo chemioterapia standard (a causa di ischemia del sistema nervoso centrale) e quattro nel
gruppo bevacizumab (a causa di perforazione gastrointestinale, emorragia intracerebrale,
perforazione intestinale ricorrente e cancro ovarico e sepsi neutropenica e cancro ovarico).
La Scientific discussion dell’EMA [5] riporta che i risultati di sicurezza dagli studi pivotal GOG0218 e BO17707 sono quelli che ci si può aspettare dalle attuali conoscenze del profilo di sicurezza
dei tre farmaci (carboplatino, paclitaxel e bevacizumab) e non sono stati identificati nuovi problemi
di sicurezza dovuti all’associazione dei tre.
Report di HTA
Il NICE [5] ha pubblicato a maggio 2013 la guidance in cui non raccomanda l’utilizzo della terapia
con bevacizumab in prima linea nel carcinoma ovarico. L’Ente inglese ha ritenuto che l’aggiunta di
bevacizumab a paclitaxel e carboplatino non rappresenti una terapia costo-efficace, a causa di un
ICER al di sopra della soglia di accettabilità.
6/7
HAS france [6] esprime un parere positivo all’utilizzo del bevacizumab per la terapia del carcinoma
ovarico in stadio avanzato (FIGO IIIB-IV) attribuendo un miglioramento del servizio medico reso
modesto (ASMR IV1).
Lo Scottish Medicines Consortium (SMC) [7], non raccomanda l’uso di bevacizumab nella terapia
di prima linea del carcinoma ovarico avanzato (FIGO IIIb-IV) poiché l’analisi economica presentata
dall’azienda produttrice non era sufficientemente robusta ed il costo del trattamento non era
giustificato dai maggiori benefici clinici apportati.
Costo dei trattamenti
Il farmaco deve essere somministrato in aggiunta carboplatino e paclitaxel. Lo schema di terapia
con bevacizumab, da un punto di vista finanziario, ha quindi un costo incrementale rispetto alla
terapia standard, rappresentata dall’associazione di carboplatino e paclitaxel. In tabella si riporta
quindi il solo costo di bevacizumab calcolato sia a 12 che a 15 mesi in quanto il trattamento deve
essere somministrato fino a progressione della malattia o comunque fino ad un massimo di 15 mesi
[1] e nello studio GOG-0218 la PFS mediana è stata di 14,7 mesi [3]. La ditta ha contrattato con
AIFA un meccanismo di condivisione del rischio, che prevede un payment by results per i pazienti
che interrompono il trattamento per tossicità o non risposta, con rivalutazione a 8 mesi. Dai dati
degli studi registrativi si può ipotizzare che circa il 30-40% dei pazienti interrompano prima di 8
mesi di terapia, arrivando ad ipotizzare quindi uno sconto addizionale di circa il 30% [3,4].
Nella tabella n°2 non vengono riportati i costi della somministrazione pari a €350 per ognuna.
Tabella 2: Costo del trattamento
Farmaco
Bevacizumab
Schedula
15 mg/kg
q3w
Costo ciclo*
€ 3.061
Durata
trattamento
12 mesi
(18 cicli)
Costo Totale*
€ 55.091
Note
Il calcolo dei costi
non tiene conto del
payment by results,
che si potrebbe
tradurre in uno sconto
addizionale di circa il
30% [3,4]§
15 mesi
€ 67.334
(22 cicli)
*Costo incluso di IVA 10%. Il costo è stato calcolato per una paziente di 65 kg, ipotizzando quindi il
consumo di 2 fiale da 400 mg e 2 fl da 100 mg.
§
Rimborso del costo del farmaco per i pazienti che interrompono definitivamente la terapia per
fallimento terapeutico (progressione o tossicità eccessiva) entro i primi 8 mesi (circa 12 cicli di
trattamento
Popolazione target
Il Registro Tumori Regione Veneto riporta un numero di nuovi casi diagnosticati di carcinoma
dell’ovaio di circa 414 all’anno [9].
La percentuale con carcinoma di fase avanzata (stadio IIIB, IIIC e IV, secondo la classificazione
FIGO), corrisponde a circa il 61% dei casi incidenti [10].
1
Il report HTA francese classifica il beneficio terapeutico apportato dal trattamento su una scala da I a V, dove I è
considerato un beneficio significativo mentre V rappresenta l'assenza di miglioramento.
7/7
Secondo i dati forniteci dalla ditta, di queste pazienti, il 70% circa sono candidabili ad effettuare
chemioterapia di prima linea perché non trattate con sola best supportive care e non incluse in studi
clinici (ricerca di mercato - Genactis Q1 2013 Italy), e circa l’80% di queste ultime è sottoposta a
chemioterapia a base di carboplatino e paclitaxel e quindi è trattabile con bevacizumab, per un
totale di 141 pazienti potenzialmente candidabili al trattamento.
Impatto di budget
La ditta ipotizza una quota di mercato, per primo anno (mobile) di commercializzazione, di circa il
25% delle pazienti potenzialmente eleggibili alla terapia, che corrispondono quindi a 35 pazienti
nella Regione Veneto. Ipotizzando che questi entrino gradualmente in terapia, per calcolare la spesa
per il primo anno di trattamento si è scelto di considerare un costo medio di 6 mesi di terapia. Per
gli anni successivi, una volta che il farmaco sia entrato a regime, si continua ad ipotizzare un’entrata
graduale in terapia per i nuovi casi incidenti (6 mesi di terapia per paziente) a cui si aggiunge il
costo per i pazienti che continuano il trattamento dagli anni precedenti, per i quali si calcola il costo
dei rimanenti 9 mesi necessari per completare la terapia. Si considera inoltre che circa il 30-40% dei
pazienti interrompa il trattamento, per tossicità o mancata risposta, prima degli 8 mesi di terapia,
validi per il rimborso e pertanto si è ipotizzato uno sconto del 30%.
Rispetto agli schemi con carboplatino + paclitaxel, i costi del trattamento con bevacizumab sono da
considerarsi aggiuntivi e quindi la spesa riportata in tabella 3 è da considerarsi come una spesa
incrementale rispetto allo scenario attuale, prima dell’introduzione sul mercato di bevacizumab
nella nuova indicazione.
Tabella 3. Impatto di spesa
Specialità /
Principio attivo
Bevacizumab
Scenario
1° anno
Successivi
N pazienti
incidenti
35
35
N pazienti dagli anni
precedenti
35
Costo totale
€ 675.950
€ 1.649.683
Bibliografia
[1] Scheda Tecnica di Avastin®
[2] Linee guida AIOM tumori dell’ovaio, ed 2013; www.aiom.it (accesso novembre 2013)
[3] Burger R.A.; N Engl J Med 2011;365:2473-83
[4] Perren T.J.; N Engl J Med 2011;365:2484-96
[5] Assesment Report AVASTIN, Procedure No.: EMEA/H/C/000582/II/0047/G www.ema.eu
(accesso novembre 2013)
[6] http://www.nice.org.uk (accesso novembre 2013)
[7] http://www.scottishmedicines.org.uk (accesso novembre 2013)
[8] HAS www.has-france.fr Avis 5 dicembre 2012 Avastin
[9] I numeri del cancro in Italia 2013; www.registri-tumori.it (ultimo accesso dicembre 2013)
[10] Heintz et al Carcinoma of the ovary. FIGO 26th annual report on the results of treatment in
gynecological cancer. Int J Gynaecol Obstet 2006; 95 (Suppl. 1): S161–S192