ESERCIZI 2005/2006 (soluzione in grassetto)
1) Disegnare le formule di Lewis (con CF e BO) e la geometria secondo VSPR degli unici due
composti stabili di formula bruta [CNO]Suggerimento : considerare le tre formule possibili sono CNO,NCO,NOC
2) Specificare la geometria di ciascun atomo di carbonio nella seguente formula ed indicare
quanti e dove esistoni legami di tipo pi-greco.
CH3CHCHCCH
Ricorda che gli atomi di idrogeno nella formula qui usata sono legati all’atomo di carbonio alla
sua sinistra
3) Se voglio la riduzione del mercurio(I) con E°(Hg22+,Hg)= +0.80 V quale delle seguenti
coppie può essere usata? Scrivere la reazione globale e il diagramma della cella.
E°(Zn2+,Zn)= -0.76 V ;
E°(Br2,Br-)= +1.07 V
4) Quanti neutroni ha l’isotopo radioattivo 14C ?
Se la miscela isotopica naturale del bromo 79Br e 81Br è di 50%, 50% quale sarà il peso
molecolare di Br2 : 158, 160 o 162 ?
5) Per quale delle tre seguenti soluzione avviene il maggior abbassamento crioscopico? E
Quale esercita la minor pressione osmotica? Perché?
a) X moli di NaCl
b) X moli di CaCl2
c) X moli di Na2SO4
(b, c contengono lo stesso numero di ioni in soluzione, maggiore di quelli presenti nella
soluzione a)
6) Consideriamo la titolazione di CH3COOH (acido acetico) in un bicchiere con una soluzione
di KOH (nella buretta). Sottolineare quale sono le specie che determinano il pH nei seguenti
punti della titolazione.
a) all’inizio
b) a metà titolazione
c) all’punto di equivalenza
d) dopo il PE
CH3COOH,
CH3COOH,
CH3COOH,
CH3COOH,
CH3COO-,
CH3COO-,
CH3COO-,
CH3COO-,
K+,
K+,
K+,
K+,
OH-,
OH-,
OH-,
OH-,
H+
H+
H+
H+
1
7) Avete a disposizione le sequenti sostanze: HCl, NaOH, CH3COOH, CH3COOK ,
pKa(CH3COOH)=5. Quale coppie possono essere usate per fare un tampone equimolare? E
a che pH?
HCl, NaOH
HCl, CH3COOK
NaOH, CH3COOK
HCl, CH3COOH
NaOH, CH3COOH
CH3COOH, CH3COOK
8) Quale tra questi indicatori è il piu’ adatto per la titolazione di un acido debole HA 0,1 M
(pKa = 7 ) con idrossido di potassio
thymolphthalein (pKa 9.9)
bromothymol blue (pKa 7.10)
bromocresol green (pKa 4.66)
Al punto di equivalenza avviene l’idrolisi della base coniugata A - Kb=Kw/Ka….
9) Quale dei seguenti sali, sciolto in acqua produce una soluzione basica?
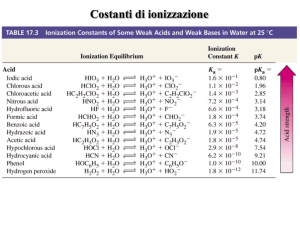
(pKa NH4+= 9.25, pKa HF= 3.20)
KF
KNO3
NH4NO3
10) L’emoglobina nel sangue trasporta l’ossigeno ma in presenza di monossido di carbonio
esiste una reazione competitiva :
Hb(O2)4 + 4CO Hb(CO)4 + 4O2
Dal principio di Le Chatelier come posso invertire l’avvelenamento da CO ?
aumento la concentrazione di O2
diminuisco la concentrazione di O2
11) La reazione in fase gassosa di disproporzionamento di NOCl è la seguente:
2NOCl 2NO + Cl2
Scrivere l’espressione della costante di equilibrio Kc (molare) e partendo da NOCl 1M qual è
l’espressione corretta delle specie all’equilibrio?
a) [NOCl] = 1.0 –x ; [NO] = x; [Cl2] = x
b) [NOCl] = 1.0 –2x ; [NO] = 2x; [Cl2] = x
c) [NOCl] = 1.0 –x/2 ; [NO] = x; [Cl2] = x/2
12) Quale dei tre equilibri si sposta verso i reagenti all’aumentare del volume del recipiente di
reazione? E all’aumentare della pressione?
A)
N2(g) + 3H2(g) = 2NH3(g)
B)
H2(g) + I2(g) = 2HI(g)
C)
2H2S(g) = 2H2(g) + S2(g)
A, C
2
13) 35,5 mg di un composto organico reagiscono con ossigeno (combustione) producendo
53.3 mg di CO2 e 14.4 mg di H2O. Calcolare la formula minima del composto e quella
molecolare sapendo che il suo PM è 176. Scrivere infine la reazione di combustione
bilanciata.
(C6H8O6)
14) Nelle batterie d’auto il piombo metallico reagisce con biossido di piombo e acido solforico
producendo solfato di piombo. Scrivere le semireazioni e la reazione completa. Quanti
grammi di solfato di piombo si formano partendo da 103,6 g di piombo in eccesso di biossido
di piombo e acido solforico?
(303,3g)
15) 0.25 moli di etanolo liquido CH3CH2OH reagiscono con 0.15 moli di ossigeno per dare
biossido di carbonio e acqua. Scrivere e bilanciare la reazione completa di combustione ed
identificare il reagente limitante.
(Ossigeno)
16) L’acido difosforico è composto da 2.27% di idrogeno, 34.8% di fosforo ed il resto
ossigeno. Determinare la formula minima e molecolare sapendo PM= 177.97
(H4P2O7)
17) Identificare la natura di tre soluzioni contenenti NH4+, Na+, H+ che reagiscono con due
soluzioni contenenti Cl-, OH- secondo la seguente tabella:
X
A
B
Y
neutra
acida
basica
C
A(H+), B(NH4+), C(Na+), X(Cl-), Y(OH- )
18) Kc = 0.5 a 400°C per la reazione in fase gassosa:
N2 + 3H2 2NH3
Partendo dalle condizioni iniziali [N2]=1M, [H2]= 1M, [NH3]=1M in che direzione procede la
reazione per raggiungere l’equilibrio?
verso i prodotti
verso i reagenti
suggerimento : considerare il quoziente di reazione Q
19) Il ferro reagisce con l’ossigeno per dare Fe2O3. Scrivere la reazione completa e calcolare
quanto ossido si forma da 1.3 moli di ferro con 64.0 grammi di ossigeno? Qual è l’agente
limitante?
(103.8g)
20) S, SO2, H2S : miscelando due di questi tre composti si ottiene una reazione di
ossidoriduzione che ha come prodotto il rimanente dei tre. Scrivere la reazione globale
utilizzando le semireazioni (in ambiente acido).
3
21) Ci sono più atomi in 1 grammo di 12C o in 1 grammo di 13C ?
Perché i pesi atomici riportati nella tabella periodica non sono interi?
22) Si consideri questo diagramma di cella :
Pt | Sn2+, Sn4+ || Fe3+, Fe2+ | Pt
All’anodo si produce: a) Fe3+
b) Sn4+
c) Sn2+
d) Fe2+
23) Si consideri questo diagramma di cella :
Zn(s) | Zn2+(aq) || Cl2(g), Cl-(aq) | Pt
Al catodo si produce: a) Cl2
b) Zn2+
c) Cld) Zn
24) Si titolano 100 mL di una soluzione 0.1 M di acido debole HA, il punto di equivalenza
viene raggiunto dopo l’ aggiunta di quanti mL di NaOH 0.5 M?
a) 1 mL
b) 5 mL
c) 10 mL
d) 20 mL
e) 100 mL
25) L’ordine di legame nella molecola HeH+ è :
a) 1/2
b) 1
c) 3/2
d) 2
26) L’ordine di legame nella molecola Be2+ è :
a) 1/2
b) 1
c) 3/2
d) 2
27) L’ordine di legame nella molecola Li2+ rispetto Li2- è :
a) maggiore
b) uguale
c) minore
28) Quale delle seguenti molecole presenta il legame più corto?
a) O2
b) O2c) O2+
d) O2229) L’ordine di legame nella molecola CF+ è :
a) 1
b) 2
c) 0
d) 3
30) L’ordine di legame nella molecola F2+ è :
a) 1/2
b) 1
c) 3/2
d) 2
31) Tra le seguenti triplette di numeri quantici, quali NON sono permesse?:
a) n= 3, l = 2, ml = -2
b) n= 3, l = 1, ml = 0
c) n= 3, l = 0, ml = -1
d) n= 3, l = 2, ml = 0
e) n= 3, l = 3, ml = -2
E quelle permesse che orbitali rappresentano ? 3s, 3p, 3d …
[a, d = 3d ; b = 3p ]
4
32) Quali dei seguenti orbitali NON è un orbitale atomico ?
2p
5s
3f
4d
33) Per quale specie atomica è possibile la configurazione elettronica (1s)2(2s)2(2p)2? :
Be
BB
C
N34) La configurazione elettronica fondamentale dello ione Fe 3+ è :
[Ar]3d34s2 [Ar]3d64s2 [Ar]3d5
[Ar]3d44s
Quanti elettroni spaiati ha?
1,
3,
5
35) Quale dei seguenti quartetti di numeri quantici (n, l, m l, ms) descrive l’elettrone piu esterno
dell’atomo di stronzio ?
(5,1,1,+1/2) (5,0,1,+1/2), (5,0,0,-1/2), (5,2,1,-1/2)
36) Quale dei seguenti atomi presenta il maggior numero di elettroni spaiati e quanti ?
Sn
Ag
Rh
Mo
37) La costante di equilibrio della reazione NH4+ + OH- NH3 + H2O
a) Ka(NH4+) b) Ka(NH4+)/ Kw c) Kb(NH3) d) 1/ Kb(NH3)
è:
38) Il pH di una soluzione 0.25 M di HA è 5.00. Qual è il valore della Ka dell’acido ?
a) 0.25 x 10-10
b) 0.25 x 10-5
c) 4 x 10-10
d) 4 x 10-5
39) Note le Ka dire quale di queste soluzioni è la piu’ acida e quella più basica.
Ka(CH3NH3+)= 2.38 x 10-11; pKa(HCN)= 9.3; Ka(CH3COOH)= 1.8 x 10-5; pKa(NH4+)= 9.2
a) 0.1 M CH3NH3Cl
b) 0.1 M NaCN
c) 0.1 M NH4NO3 d) 0.1 M CH3COONa
(c pH 5.12, b pH 11.15)
40) Per preparare un tampone a pH=pKa ho a disposizione 100 mL di soluzione di acido
acetico 0.1M. A quale delle seguenti soluzioni deve essere miscelata? (OAc= acetato)
a) 50 mL 0.2 M Ba(OAc)2
b) 200 mL 0.1 M Ba(OAc)2
c) 25 mL 0.2 M Ba(OAc)2
c) 100 mL 0.1 M Ba(OAc)2
41) Quale delle seguenti miscele di soluzioni ha un pH diverso dalle altre?
a) 1L NaOH 1M + 1L HCN 2M b) 1L NaCN 1M + 1L HCN 1M
c) 1L NaOH 1M + 2L HCN 1M d) 1L NaOH 1M + 1L HCN 1M
pKa(HCN)= 9.3
42) Ho preparato un tampone contenente 1 mole di acetato di sodio ed 1 mole di acido
acetico. Dopo l’aggiunta di 0.5 moli di NaOH il pH è :
a) raddoppiato
b) aumentato di log 2 = 0.301
c) aumentato di log 3 = 0.477 d) dipende dal volume
5
43) Qual è la concentrazione della soluzione al punto di equivalenza ottenuta dalla titolazione
di HCOOH (acido formico) 0.1M con NaOH 0.1 M ?
a) 0.1 M HCOONa
b) 0.05 M HCOOH
c) 0.05 M HCOONa
d) 0.05 M NaOH
44) Qual è la concentrazione della soluzione al punto di equivalenza ottenuta dalla titolazione
di Ba(OH)2 0.03 M con HCl 0.03 M ?
a) 0.1 M BaCl2
b) 0.03 M BaCl2 c) 0.01 M BaCl2
d) 0.05 M HCl
45) Qual è la concentrazione di Ba2+ che si ottiene miscelando le seguenti soluzioni : 20mL di
Ba(NO3)2 0.1 M con 10 mL di KNO3 0.2M
a) 0.1
b) 0.2
c) 0.333
d) 0.0666
e quella di NO3 ?
a) 0.1
b) 0.2
c) 0.1333
d) 0.0666
46) Una soluzione di Fe(NO3)3 reagisce con una soluzione di NaOH per dare triidrossido di
ferro. Quale di queste miscele di soluzioni 0.1M produce la maggior quantità idrossido?
a) 20mL di Fe(NO3)3 con 80 mL di NaOH
b) 25mL di Fe(NO3)3 con 75 mL di NaOH
c) 33mL di Fe(NO3)3 con 67 mL di NaOH
d) 50mL di Fe(NO3)3 con 50 mL di NaOH
47) Qual è il massimo numero di millimoli di La2(C2O4)3 che si possono ottenere miscelando
30.00 mL di La(NO3)3 0.08M con 20.00 mL di Na2C2O4 0.12M
a) 0.8
b) 1.2
c) 2.4
Qual è l’agente limitante?
d) 4.8
48) Quale dei seguenti composti ha il punto di ebollizione più alto? E il più basso?
a) metanolo CH3OH
b) dimetiletere CH3-O-CH3
c) metano CH4
d) etanolo CH3CH2OH
49) La pressione osmotica di una soluzione di glucosio (PM 180) al 5% in peso è quattro volte
quella di una soluzione al 5% di un soluto incognito. Il PM dell’incognito è :
a) 1804
b) 4 x 180
c)180/4
d) non so
50) Quale dei seguenti effetti NON è causato dall’aggiunta di un soluto non volatile ad un
liquido?
a) abbassamento della pressione vapore
b) innalzamento del punto di fusione
c) innalzamento del punto di ebollizione
d) abbassamento del punto di fusione
6