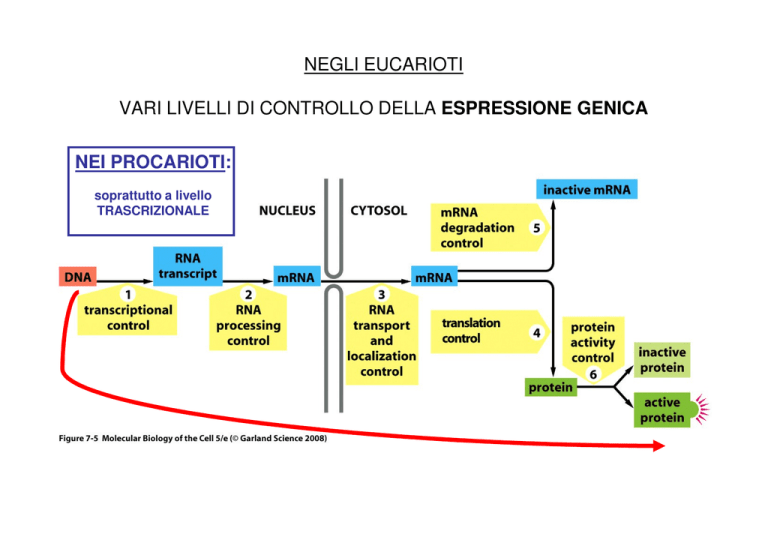
NEGLI EUCARIOTI
VARI LIVELLI DI CONTROLLO DELLA ESPRESSIONE GENICA
NEI PROCARIOTI:
soprattutto a livello
TRASCRIZIONALE
IN BATTERI:
UNA SOLA POLIMERASI
IN EUCARIOTI:
3 TIPI DIVERSI (I, II e III)
POL II MEDIA LA TRASCRIZIONE DEGLI mRNA
Intervento di numerosi fattori che regolano l’inizio della trascrizione
General
Transcription Factors
Complesso del
MEDIATORE
INIZIO
DELLA
TRASCRIZIONE
Fattori
di rimodellamento
della cromatina
PROMOTORE EUCARIOTICO
per RNA-Pol II
FATTORI GENERALI DI TRASCRIZIONE
Mediano l’attacco della RNA-Pol II
alla regione di inizio della trascrizione
- 28
+1
necessari (ma non sufficienti) per attivare la trascrizione
FATTORI DI
TRASCRIZIONE
DI BASE
Simile a fattore sigma
TF II ….
dei procarioti
TATA BOX
BINDING PROTEIN
ELICASI
COMPLESSO DI
PRE-INIZIO
COMPLESSO
APERTO
ULTIMO EVENTO
fosforilazione della coda
della pol II
CTD
Fosforilato da
TFIIH
52 ripetizioni del peptide
Tyr-Ser-Pro-Thr-Ser-Pro-Ser
fattore
TBP
80°
TATA BOX
FOSFORILAZIONE DI CDT DELLA RNA pol II
legame a fattori che portano avanti l’allungamento dell’ mRNA
e che regolano la formazione del Cap, la poli-adenilazione e lo splicing
CDT
RNA
COME SI DETERMINA
IL SITO DI INIZIO
DELLA TRASCRIZIONE
?
Gene della Interleuchina 1 umana
DETERMINAZIONE DEL SITO DI INIZIO
DELLA TRASCRIZIONE
ESPERIMENTI DI
- PRIMER EXTENTION
- “RUN-OFF”
- S1 MAPPING
PRIMER EXTENTION
SAGGIO DI TRASCRIZIONE “IN VITRO”
RUN - OFF
S1 - MAPPING
n
100-200 basi upstream
Core promoter
1000-20000 (?) basi upstream (anche downstream)
FATTORI TRASCRIZIONALI
in “TRANS”
(proteine )
ELEMENTI
“IN CIS”
( Sequenze
del promotore)
25-35 bp upstream
Bind TBP
Lega il fattore Sp1 in molti geni
housekeeping
Elementi che legano
il fattore AP1
( Jun, Fos)
CORE
Cis element per fattore trascrizionale
Elementi “cis”
Sp1
prossimali
5' GGGCGG 3‘
----------------Ap1
(dimeri Fos/Jun o Jun/Jun)
Ripiegatura del DNA
Inoltre:
(proteine HMG)
COMPLESSO
DI RIMODELLAMENTO
DELLA CROMATINA
ENZIMI DI MODIFICAZIONE
DEGLI ISTONI
REGOLAZIONE COMBINATORIA
GENE PER IL
L’ INTERFERONE BETA
Attivazione
in seguito ad infezione
Legame coopeativo
degli attivatori
Fattori sintetizzati
in risposta all’infezione
Richiamano p300
che richiama
- fattori di rimodellamento
e
- apparato trascrizionale di base
T cell receptor chains
All insulators discovered so far in vertebrates work only when
bound by a protein designated CTCF ("CCCTC binding factor";
named for a nucleotide sequence found in all insulators).
CTCF has 11 zinc fingers.
I TF reclutano
l’apparato di trascrizione di base
Formazione del complesso di inizio
i modificatori dei nucleosomi
1) aggiunta di gruppi chimici (HAT)
2) rimodellamento della cromatina (SWI/SFN ATP-dipendente)
DISAGGREGAZIONE
DEI
NUCLEOSOMI
SWI, SFN
Dipendenti da ATP
HAT
/
HDAC
Metilasi
Chinasi
“CODICE ISTONICO”
CROMODOMINI / BROMODOMINI
Domini di legame presenti in proteine
che modificano ulteriormente gli istoni.
Oppure in proteine regolatrici (TFIID)
FATTORI TRASCRIZIONALI
Come interagiscono con
specifiche sequenze del DNA ?
Hanno caratteristiche comuni ?
ELICA
DI
RICONOSCIMENTO
ZINC - FINGERS
EXON SHAFFLING
Dimerizzazione
MOTIVO
HELIX-LOOP-ELIX
HLH
Legame al
DNA
MOTIVO
LEUCINE ZIPPER
AMINOACIDI IDROFOBICI
A DISTANZA DI 7 aa
(1 GIRO DI ELICA = 3.6 aa)
LEUCINE ZIPPER
LEUCINE ZIPPER
MOTIVO HELIX-TURN-HELIX
Tipico di molti omeodomini
COME SI STUDIA
L’ INTERAZIONE
TRA FATTORI TRASCRIZIONALI
E SPECIFICI ELEMENTI
DEL DNA ?
LUCIFERASI
GFP
CROMATOGRAFIA DI AFFINITA’
Per identificare fattori
che legano
specifiche sequenze
CHROMATIN
IMMUNOPRECIPITATION
CHIP
Per identificare sequenze
che legano specifici fattori
SEQUENZIAMENTO
O
IBRIDAZIONE A MICROARRAY GENOMICO
32P
DETERMINAZIONE
DEI SITI DI ATTACCO
DI FATTORI TRASCRIZIONALI
(footprinting)
TAGLIO
CON
ENDONUCLEASI
SEPARAZIONE
ELETTROFORETICA
SU GEL DI
POLIACRILAMMIDE
HIF1
HYPOXIA INDUCIBLE FACTOR
oxygen-dependent degradation domain
Regolato
da O2
transactivation
domains
costitutivo
Structure of the HIF-1 Complex. The hypoxia inducible factor 1 complex (HIF-1) is a dimer composed of two
proteins involved in hypoxic gene transactivation, HIF-1α and HIF-1β (ARNT). Dimerization between these
two factors is mediated by the helix-loop-helix (HLH) and Per-ARNT-SIM domains, and DNA binding involves
the basic (b-) region of the b-HLH domains. HIF-1 modulates transcription through its
transactivation domains (TAD). Between amino acids 401 and 603, HIF-1α contains an
oxygen-dependent degradation domain (ODD) which controls its degradation under normoxia [24]. Fig. 1
Duffy et al. Molecular Cancer 2003 2:12 doi:10.1186/1476-4598-2-12
Richiama p300
Subunità
della
ubiquitina-ligasi
E3
Hypoxia
Response
elements
Richiama
p300
che richiama
-fattori di
rimodellamento
- app. trascriz. di base
Molecular mechanisms of hypoxia-induced angiogenesis. Under normoxic conditions (panel A), HIF-1α is
hydroxylated by the active prolyl-4-hydroxylase enzyme, which facilitates the binding of VHL protein and leads to
rapid HIF-1α degradation by the ubiquitin proteasome system. In the face of hypoxia (panel B), the hydroxylase
enzyme is inactive and HIF-1α is stabilized in its de-hydroxylated state. The stable HIF-1α translocates to
the nucleus, where it accumulates and dimerizes with the constitutively expressed HIF-1β, forming the intact
HIF-1 complex. This complex binds hypoxia response elements (HREs) in selective genes to alter
transcriptional activity. A notable hypoxia-induced gene is that coding for vascular endothelial growth factor
(VEGF), a cytokine which potently stimulates neoangiogenesis [24].
IF-1
In normossia
La subunità alfa viene idrossilata su una prolina
che viene così legata all’ubiquitina
Viene idrossilata anche una Asn:
ciò impedisce l’interazione con p300
In ipossia:
La subunità alfa non viene degradata e
attiva la trascrizione
dimerizzando con la subunità beta
EMT
Ephitelil-mesenchymal transition
Comune nell’embrione.
EMT
Reversibile
Transizione e migrazione cellulare
per la formazione di nuovi organi
Coinvolta nelle metastasi.
Cellule che diventano capaci di migrare,
con contatti ridotti e produzione di proteasi
Coinvolta nella rigenerazione tissutale
e nella fibrosi
REGOLAZIONE GUIDATA DA
FATTORI TRASCRIZIONALI
CHE REPRIMONO LA E-CADERINA
?
?
EMT
PrincipalI fattori trascrizionali:
Snail, Slug, Twist, ZEB
Regolano negativamente la E-caderina.
Possono essere anche attivatori di altri geni
SNAI SUPERFAMILY
zinc-finger TFs
Ubiquitinazione
Regolata da Ser/Pro-chinasi
e da modificazioni di Lys
Nuclear Export Signal
Dominio di repressione
7-9 AA
Regolato da Ser/Pro-chinasi
e da modificazioni di Lys
Snail
Legano E2-boxes
C/A(CAGGTG)
Slug
?
bHLH TF superfamily
Omo- o etero-dimeri
Twist:
HLH o bHLH
bHLH
Sempre eterodimero
Co-repressori
Legame a E-box
CANNTG
Importante
•nello sviluppo embrionale
•nei tumori
ZEB TF superfamily
importanti nello sviluppo embrionale
inducono de-differenziamento epiteliale nella tumorigenesi
Zinc-fingers
Co-repressori
Legame a E-box
CANNTG
Promotore per RNA Polimerasi I
Trascrive ad alti livelli il gene per gli rRNA
MATURAZIONE DEGLI RNA RIBOSIMIALI
TRIGGERING
Promotore per RNA Polimerasi III
RNAsi P
INTRONE
MRFs - Miogenic Related Factors
•
•
•
•
MyoD
Myf-5
Myogenin
MRF-4
(Myf-3)
(Myf-1)
(Myf-6, Herculin)
Fattori trascrizionali
Nel 1987 scoperto MyoD
Con la strategia delle library di cDNA
sottrattive
DNA micro chips
Principle of 22-D Electrophoresis
1. First dimension:
denaturing isoelectric
focusing
separation according
to the pI
2. Second dimension:
SDS electrophoresis
separation according to
the MW
HEPG2
SWISS2DPAGE
map
Valori di pH
MRFs - Miogenic Related Factors
•
•
•
•
MyoD
(Myf-3)
Myf-5
Myogenin (Myf-1)
MRF-4
(Myf-6, Herculin)
Fattori trascrizionali
Fattori capaci di indurre differenziamento
muscolare in fibroblasti.
I promotori dei loro geni
si attivano in maniera sequenziale
Basic helix-loop-helix (bHLH) transcription factor
Formano eterodimeri con le proteine E, ubiquitarie
Legano le E-boxes (CANNTG)
a monte di promotori di geni muscolo-specifici
ETERODIMERO ATTIVO
Elica basica
ESPERIMENTI CON TOPI KNOCK-OUT
COMMISSIONAMENTO MIOGENICO
•
-/- per myoD: pressochè normali (aumenta Myf-5)
•
-/- per myf-5: hanno muscolatura quasi normale, ma con difetti a livello dei
muscoli intercostali, recuperati con over-espressione di Myogenina
•
-/- per myoD e per myf-5: totale assenza di cellule muscolari
DIFFERENZIAMENTO FINALE
•
-/- per Myogenina: assenza di miofibre
•
-/- per MRF4: quasi normali, over-espresione di Myogenina
http://www.bio.davidson.edu/Courses/genomics/method/homolrecomb.html
TRASFEZIONE
BLASTOCISTI
Creazione del costrutto
per la ricombinazione
omologa
Cellule ES
Staminali embrionali:
manipolazione “in vitro”
(trasfezione)
Inserimento nella blastocisti
Topi chimerici
1° incrocio per genotipo -/+
2°incrocio per genotipo -/-
RICOMBINAZIONE
OMOLOGA
Distruzione
(interruzione)
del gene bersaglio
TRASCRIZIONE
Inattiva
attiva
Resistenza al G418
Nei somiti di embrioni murini
Proteine Id
Inibitori del Differenziamento
(simili a proteina E, ma senza elica basica)
Myf-5
MyoD
“dominanti negativi” naturali di MRFs.
DIFFERENZIAMENTO
IN SEGUITO A
DOWN-REGOLAZIONE DI
PROTEINE Id
Myogenin
MRF-4
Elemento “in cis”
a - 20 Kb
Elemento “in cis”
a - 5 Kb
TATA BOX
di MyoD o Myf-5
INDUZIONE DEI GENI MyoD e Myf-5 NEI SOMITI
Pax3, Pax7
Homeodomain TF
MyoD attiva anche il proprio gene
COATTIVATORI
Trascrizione
MEF-2
miR-1
TFIID
MyoD
P300/CBP
Acetilazione
degli istoni
MEF2
myocyte enhancer factor
MAPK
Trasforma MEF2
in repressore
+ ATP
cofactors
Non necessario nel differenziamento embrionale
ma importante nella
maturazione post-natale del muscolo
Pax 7
Fase proliferativa
Fase differenziativa
Bone marrow stem cells
ATTIVI NELLO SVILUPPO MUSCOLARE
dsRNA
Trascritti dal
genoma
Esogeni
(p.e. virus)
Pre-miRNA
pri-miRNA
siRNA
e
miRNA
dsRNA
pre-miRNA
DICER
mi-RNA
siRNA
piccolissimi RNA
associati a proteine
con capacità idrolitica
su mRNA cellulari
su RNA virali
Controllo
posttrascrizionale
Difesa
dall’infezione
DROSHA
Cap
ACCORCIAMENTO
(“MIETITURA”)
pri-miRNA
dsRNA
(esogeno)
pre-miRNA
TAGLIO
(“TRITARE”)
DICER
RNA-Induced
Silencing Complex
DROSHA
Cap
ACCORCIAMENTO
(“MIETITURA”)
pri-miRNA
dsRNA
(esogeno)
pre-miRNA
TAGLIO
(“TRITARE”)
DICER
PERCORSO
COMUNE
RNA-Induced
Silencing Complex
pri-miRNA
pre-miRNA
Trascritto da RNA pol II
Nel nucleo,
poi esportazione nel citoplasma
65-70 nucleotidi totali
AL CITOPLASMA
Tagli successivi per la produzione di miRNA maturo
?
miRNA
pre-miRNA
circa 22 basi
circa 66 basi
16 mer = 4 x 109 combinazioni
INF
pri-miRNA
(anche migliaia di basi)
Esempi di
pre-miRNA
Dopo taglio con
DICER
in alcuni casi
entrambi i filamenti
diventeranno
miRNA attivi
MIOSTATINA
•
•
•
•
•
•
•
Inibisce il differenziamento muscolare.
Piccola proteina (25kDa, TGF-beta superfamily)
secreta dal muscolo
si lega ad un recettore muscolare
Mutazione rara nell’uomo
Razza Belgian blue ha una mutazione sul gene
FOLLISTATINA antagonista della miostatina