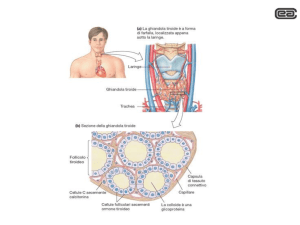
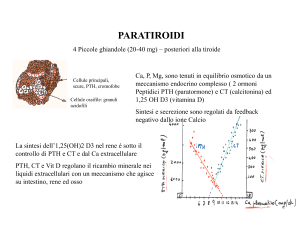
I calciomimetici
nel trattamento
dell’ iperparatiroidismo
a nefropatia cronica progressiva
secondario
In caso di mancata consegna restituire al mittente che si impegna a pagare la relativa tassa. Periodicità bimestrale - Spedizione in abbonamento postale - 45% - art. 2 comma 20/b legge 662/96 - Filiale di Milano
(cinacalcet)
Vol. 7, n. 2
Suppl. 2
aprile 2004
I calciomimetici (cinacalcet)
nel trattamento dell’iperparatiroidismo
secondario a nefropatia cronica progressiva
INFORMED
Pietro Cazzola
Calcio
Il calcio (Ca) è un elemento essenziale per il corretto funzionamento di numerosi processi
intra- ed extracellulari che comprendono la contrazione muscolare, la conduzione nervosa,
la liberazione degli ormoni e la
coagulazione (1).
In media in un soggetto adulto
sono contenuti circa 1-2 kg di
Ca che per più del 98% sono immagazzinati nello scheletro.
Nel sangue il Ca è presente in tre
forme (1):
libera (ionizzata) = 47%;
legato alle proteine = 43-46%;
in complessi diffusibili = 7-10%.
Le variazioni del pH influenzano il legame del Ca con le proteine (principalmente l’albumina): in corso di acidosi si riduce ed aumenta la parte ionizzata (Ca2+); in caso di alcalosi, al
contrario, si incrementa e diminuisce la parte ionizzata.
È importante sottolineare che solo il Ca in forma ionizzata esplica
le funzioni fisiologiche [es. secrezione di paratormone (PTH)] (1).
In condizioni normali la calcemia
totale nel soggetto adulto è compresa tra 8,8 e 10,4 mg/dl (2).
Le linee guida della National Kidney Foundation (K/DOQI) raccomandano che nel soggetto con insufficienza renale la calcemia sia
Specialista in Anatomia e Istologia Patologica
e Tecniche di Laboratorio
8,4
9,5
K/DOQI Target
Ca
(mg/dL)
10,2
7,5
Stimolo per la secrezione del PTH
Stimolo per l’ingrossamento
delle paratiroidi
Inadeguata mineralizzazione ossea
Calcificazione vasi
e tessuti molli
Ipertensione
Figura 1.
Limiti della calcemia proposti dalla National Kidney Foundation
per il paziente con insufficienza renale.
mantenuta nel range compreso tra
8,4 e 9,5 mg/dl (3) (Figura 1).
Il mantenimento della calcemia
entro i limiti di normalità di-
pende dall’assunzione di Ca con
la dieta, dal suo assorbimento
intestinale e dalla sua escrezione renale (Figura 2).
Figura 2.
Omeostasi del calcio (1).
1.000 mg
Intestino
200 mg
800 mg
500 mg
Ossa
(e denti)
10.000 mg
Ca 2+
Rene
sierico
500 mg
Ca2+
1 kg
9.800 mg
200 mg
vol. 7, n. 2, suppl. 2, 2004
1
Con una dieta bilanciata ogni
giorno vengono introdotti nell’organismo 1000 mg di Ca: di
questi solo il 20% (200 mg) passa nel torrente circolatorio (1).
Il rene filtra quotidianamente
10.000 mg di Ca che per il 90%
viene riassorbito dal tubulo prossimale e dall’ansa di Henle, con
una perdita urinaria di 200
mg/die (1, 2). A livello dell’osso
giornalmente vengono rimossi e
depositati 500 mg di Ca (1).
Fosforo
Il fosforo (P) rappresenta una
delle principali componenti dell’osso e dei tessuti molli e partecipa attivamente in quasi tutti i
processi metabolici (immagazzinamento di energia, trasporto di
membrana, trasduzione di segnali) (4).
La maggior parte del P presente
nel plasma è in forma di ortofosfato inorganico (PO4-) (solo il
12% è legato alle proteine) e la
sua concentrazione varia da 2,5
a 4,5 mg/dl (2). Anche il P è sensibile alle variazioni del pH: l’alcalosi riduce la fosforemia, mentre l’acidosi l’aumenta (2).
Giornalmente con la dieta vengono assunti circa 1000-1800 mg di
fosforo che per il 60-70% vengono assorbiti dall’intestino (2, 5).
Il rene elimina solo il 10-15% del
P filtrato e l’escrezione urinaria
è in rapporto con la quantità introdotta con la dieta (2).
Analogamente a quanto avviene
per il Ca anche per il P in condizioni fisiologiche gli scambi a livello osseo sono all’equilibrio (2).
Regolazione
del metabolismo
del calcio
e del fosforo
I metabolismi del Ca e del P sono intimamente connessi. La regolazione del loro bilancio è
grandemente influenzata dai livelli del PTH, della vitamina D
e, in misura minore, dalla calcitonina.
Figura 3.
Calcio ionizzato e PTH: in corrispondenza del set-point [punto di mezzo tra A1
(il massimo livello del PTH ) e D1 (la secrezione basale del PTH)]
piccole variazioni della concentrazione del Ca2+
determinano ampie variazioni dei livelli sierici di PTH.
Livelli sierici di PTH (% del livello massimo)
INFORMED
vol. 7, n. 2, suppl. 2, 2004
2
120
A1
100
80
60
40
(A1+ D1)
2
Set point
20
D1
0
1.00
1.10
1.20
1.30
Calcio ionizzato (mmol/L)
1.40
1.50
Paratormone
Il PTH è un ormone prodotto
dalle cellule principali delle paratiroidi. Quest’ultime come prima tappa sintetizzano un precursore di 115 aminoacidi (preproPTH) che viene poi immagazzinato nella cellula sotto forma di un polipeptide di 84 aminoacidi che rappresenta la forma attiva del PTH (6).
La secrezione di PTH è principalmente regolata da recettori di
membrana che sono in grado di
rispondere a piccole variazioni
della concentrazione del Ca ionizzato (recettori sensibili al calcio, CaR) (7, 8) (Figura 3).
Questi recettori sono distribuiti
in tutti i tessuti, ma con particolare concentrazione nelle paratiroidi, nel rene e nella tiroide.
Quando la calcemia aumenta il
Ca si lega allo specifico CaR che
attiva una cascata di eventi in
grado di inibire la secrezione di
PTH (9).
Al contrario, quando la calcemia
si riduce, il Ca ionizzato non è
più sufficiente per saturare i CaR
e le cellule principali liberano
abbondanti quantità di PTH che,
agendo sugli organi bersaglio
(primariamente osso e rene), innalza la calcemia.
Infatti il PTH favorisce il riassorbimento osseo sia per effetto
diretto sugli osteoclasti, sia per
azione mediata dalla vitamina D,
mentre a livello renale aumenta
il riassorbimento del Ca e la formazione della vitamina D in forma attiva (1,25- diidrossicolecalciferolo).
Quando per questi effetti la calcemia aumenta, quest’ultima con
un meccanismo di feedback negativo blocca i CaR delle paratiroidi che smettono di secernere
PTH (Figura 4).
CaR
Vescicole
contenenti PTH
2. I CaR non legati al Ca2+
permettono
la secrezione di PTH
Cellula
principale
Secrezione
di PTH
6. I recettori
legati al Ca2+
inibiscono
la secrezione
di PTH
3. PTH agisce
sugli organi bersaglio
Ossa
Intestino
Reni
Vit. D in
forma attiva
Escrezione
di Ca2+ ridotta
Incremento
dell’assorbimento
Feedback
negativo
4. La calcemia aumenta
Figura 4.
Circuito di feedback negativo tra Ca2+ e PTH.
Più controverso è il ruolo del fosforo nella regolazione della secrezione del PTH; esistono tuttavia evidenze che gli elevati livelli ematici di questa sostanza
siano in grado di stimolare la secrezione di PTH e di promuovere la proliferazione cellulare
nelle paratiroidi (10, 11).
Vitamina D
Nell’organismo la vitamina D è
prodotta dalla cute o viene assunta con la dieta. A livello renale essa viene convertita nella
sua forma più attiva (1,25- diidrossicolecalciferolo) ad opera
dell’enzima 1-α-idrossilasi.
Come precedentemente sottolineato la produzione renale di
1,25- diidrossicolecalciferolo è
stimolata dal PTH la cui sintesi
è a sua volta inibita dagli elevati livelli di vitamina D (12).
Quest’ultima agisce a livello intestinale aumentando l’assorbimento di Ca: in questo modo la
calcemia aumenta e blocca attraverso il CaR la secrezione di
PTH.
Calcitonina
La calcitonina è un polipetide di
32 aminoacidi prodotto dalle cellule parafollicolari (cellule C)
della tiroide.
Nefropatia cronica
progressiva
Con il termine di nefropatia cronica (IRC) si definisce un processo patologico, ad eziologia
multipla, il cui risultato finale è
la progressiva perdita della funzione renale.
La IRC può derivare da patologie primitive del rene, come le
glomerulonefriti o il rene policistico, o essere la conseguenza di
altre condizioni patologiche sistemiche, come il diabete o l’ipertensione arteriosa.
Le linee guida della National Kidney Foundation (K/DOQI) evidenziano 5 stadi evolutivi della IRC
che essenzialmente si basano sulla presenza del danno renale [anomalie della composizione delle urine (principalmente la proteinuria)
e anomalie rilevate con indagini
di imaging (ultrasonografia, pielografia discendete, tomografia
computerizzata, risonanza magnetica)] e sul declino della velocità di filtrazione glomerulare
(GFR) (13) (Tabella 1).
Il progressivo deterioramento della funzione renale comporta una
serie di ripercussioni che interessano i differenti sistemi deputati
al mantenimento dell’omeostasi
dell’organismo tra cui un ruolo importante spetta al metabolismo calcio-fosforo.
INFORMED
5. Il Ca2+
si lega
ai CaR
1. In condizioni di ipocalcemia
i CaR rimangono liberi
Questo ormone aumenta la captazione cellulare di Ca, la sua clearance renale e la formazione di tessuto osseo: esso pertanto possiede un’azione ipocalcemizzante.
Nell’uomo gli effetti della calcitonina sul metabolismo osseo sono molto più deboli di quelli
esercitati dal PTH o dalla vitamina D.
vol. 7, n. 2, suppl. 2, 2004
3
INFORMED
vol. 7, n. 2, suppl. 2, 2004
4
IRC e metabolismo
calcio-fosforo
Il declino della funzione renale
che si verifica in corso di IRC determina sul metabolismo calciofosforo le seguenti modificazioni (14):
riduzione della calcemia: è la
conseguenza sia della diminuita capacità del rene di produrre vitamina D attiva (ridotto assorbimento intestinale di Ca), sia della deposizione di Ca nei tessuti molli per
effetto dell’iperfosfatemia;
aumento della fosfatemia: è dovuto alla riduzione dell’escrezione renale di fosfati che inizia a partire dallo stadio 3 (15).
Come precedentemente esposto l’ipocalcemia, l’iperfosfatemia e i ridotti livelli sierici di
vitamina D attivano la sintesi e
la secrezione di PTH da parte
delle paratiroidi (Figura 5) con
lo scopo di ripristinare la normale concentrazione di Ca nel
sangue.
Tuttavia la cronicità della patologia renale non consente il
mantenimento dell’omeostasi
fosfo-calcica il cui continuo
squilibrio costituisce uno stimolo permanente per le paratiroidi che vanno incontro ad
un processo di iperplasia con
conseguente iperparatiroidismo
secondario.
1
Danno renale con normale o ↑GFR
≥ 90
2
Danno renale con moderato ↓GFR
60-89
3
Moderato ↓GFR
30-59
4
Severo ↓GFR
15-29
5
Nefropatia
< 15
(necessità di dialisi
o trapianto del rene)
Tabella 1.
Stadi della IRC (13).
lisi sono affetti da questa complicanza (16, 17).
Oltre all’ipocalcemia, ai ridotti
livelli di vitamina D e all’iperfosfatemia altre cause concorrono allo sviluppo dell’iperparatiroidismo nella IRC; in particolare si osserva un declino
del numero e della sensibilità
dei CaR e dei recettori per la vitamina D a livello delle cellule
principali delle paratiroidi (18,
19).
L’iperparatiroidismo secondario
è una patologia progressiva in cui
gli elevati livelli di PTH esercitano effetti negativi sopratutto a livello osseo e cardiaco
Osteodistrofia renale
Nei pazienti con IRC si possono verificare diversi tipi di patologie dell’osso che a volte sono coesistenti: un’osteodistrofia a elevato turnover (nota come osteite fibrosa cistica), o forme a basso turnover, come
osteomalacia e malattia adinamica dell’osso.
In generale l’elevato turnover osseo è associato ad elevati livelli
plasmatici di PTH, mentre l’opposto si verifica per il basso turnover (30, 31) (Figura 6).
L’osteite fibrosa cistica rappresenta
uno dei segni distintivi dell’iperparatiroidismo secondario in cui
Figura 5.
IRC e iperparatiroidismo secondario.
Iperparatiroidismo secondario
↑PTH
↑PTH
↓Ca2+
IRC e iperparatiroidismo secondario
È stato osservato che in corso di
IRC l’iperparatiroidismo secondario inizia a comparire precocemente (quando calcemia e fosfatemia sono ancora nella norma)
e che quasi tutti i pazienti in dia-
GFR (mL/min/1,73 m2)
Stadio Descrizione
Osteodistrofria
renale
↓Vit. D
↑PO4
Tossicità sistemica
- cardiaca
- cutanea
Insufficienza renale
Mortalità cardiovascolare
Nel 1974 Lindner et al. per primi
segnalarono l’eccessiva incidenza
di decessi di origine cardiaca, in
particolar modo coronarica, nei
pazienti sottoposti a dialisi (34).
Parecchie evidenze indicano
che le alterazioni del metabolismo minerale che si associano all’iperparatiroidismo secondario svolgono un ruolo determinante nello sviluppo della cardiopatia nei pazienti con
IRC (35-37).
È soprattutto la tendenza alla deposizione di Ca nei tessuti molli (calcificazione extrascheletrica o metastatica1) - tra cui miocardio, coronarie e apparati val1
Il prodotto Ca x P è un metodo per valutare la
possibilità di calcificazioni extrascheletriche.
I limiti di normalità sono così calcolati:
Limite inferiore:
valore normale minimo del Ca (8,5 mg/dL)
x
valore normale minimo del P (2,5 mg/dL)
= 21 mg2/dL2
Limite superiore:
valore normale massimo del Ca (10,5 mg/dL)
x
valore normale massimo del P (4,6 mg/dL)
= 48 mg2/dL2
Con l’aumentare di uno dei due fattori (Ca e P) il
prodotto aumenta e si incrementa il rischio di calcificazioni extrascheletriche.
Vari aspetti dell’osteodistrofia renale
Ca2+, vitamina D
Basso turnover
< 150 pg/mL
Osteomalacia
Malattia
adinamica dell’osso
PTH
150-300 pg/mL
Normale
ossificazione
Elevato turnover
> 300-400 pg/mL
Osteite
fibrosa
Al3+
Lesioni miste
Figura 6.
Osteodistrofia renale e livelli plasmatici del PTH.
volari cardiaci - a rappresentare
un importante fattore di rischio
di mortalità cardiovascolare.
È stato infatti osservato che nei
pazienti in dialisi la presenza di
calcificazioni vascolari è direttamente correlata alla mortalità
globale e cardiovascolare (38) ed
un’analoga constatazione è stata effettuata per la presenza di
calcificazioni nelle valvole cardiache (39) (Figura 7).
Trattamento
dell’iperparatiroidismo
secondario
Gli obiettivi della terapia dell’iperparatiroidismo secondario
Figura 7.
Insufficienza renale terminale e sopravvivenza
in rapporto al grado di calcificazione dei principali vasi arteriosi (38).
INFORMED
gli elevati livelli di PTH stimola
no sia gli osteoclasti a riassorbire
la matrice ossea, sia gli osteoblasti a sintetizzare nuovo tessuto
osteoide che, non essendo sufficientemente mineralizzato, presenta numerose cisti che indeboliscono la durezza dell’osso rendendolo facilmente friabile.
Nei pazienti in dialisi sovente
la misurazione dei livelli plasmatici del PTH (intero) viene
utilizzata come metodica non
invasiva per distinguere l’osteite fibrosa dalla malattia adinamica dell’osso, tuttavia in alcuni casi specifici può essere necessario ricorrere alla biopsia
ossea (31-33).
vol. 7, n. 2, suppl. 2, 2004
5
INFORMED
vol. 7, n. 2, suppl. 2, 2004
6
possono essere distinti in immediati e a lungo termine (40, 41).
Gli obiettivi immediati sono:
mantenere il PTH a livelli adeguati (42);
prevenire l’iperplasia delle
paratiroidi;
mantenere nella norma i livelli
del P (43);
mantenere nella norma i livelli
del Ca (3);
preservare la funzione scheletrica.
Quelli a lungo termine sono:
ridurre il rischio di osteodistrofia renale;
ridurre la morbilità e la mortalità cardiovascolare.
Attualmente il trattamento dell’iperparatiroidismo secondario
si basa ampiamente sull’impiego della vitamina D e sulla supplementazione orale di Ca per
controllare l’eccessiva secrezione di PTH, mentre per ridurre
la ritenzione di fosfati e per prevenire l’iperfosfatemia vengono utilizzati chelanti intestinali del P (44).
L’uso della vitamina D, tuttavia,
ha delle limitazioni importanti
in molti pazienti con IRC in
quanto aumentando Ca e P (e
quindi anche il loro prodotto)
favorisce la calcificazione vascolare e cardiaca (44); inoltre
è da sottolineare che le paratiroidi iperplastiche diventano
refrattarie all’azione PTH-inibente del calcitriolo e del calcio in quanto carenti dei loro
recettori specifici (18, 19).
Una nuova alternativa nel trattamento dell’iperparatiroidismo
secondario è rappresentata dai
calciomimetici.
Quest’ultimi sono composti che
agendo a livello dei meccanismi
molecolari alla base della secrezione Ca-dipendente del PTH ne
controllano gli eccessi, limitando l’aumento delle concentrazioni plasmatiche di Ca e P.
I calciomimetici
I calciomimetici sono molecole che a livello recettoriale non
competono con il Ca, bensì
provocano delle modificazioni
della conformazione dei CaR
(modulazione allosterica) (45);
in questo modo i CaR vengono
attivati da più basse concentrazioni di Ca2+ e inibiscono la
sintesi e la secrezione di PTH
senza che aumentino i livelli di
Ca e P (46).
Il primo calciomimetico in grado di attivare potentemente e
selettivamente i CaR è stato
l’R-568; tuttavia, nonostante i
positivi risultati conseguiti nei
trial preclinici e clinici, il suo
sviluppo è stato interrotto per
la scarsa biodisponibilità (44).
L’ AMG 073, noto con il nome
di cinacalcet, è un calciomimetico orale di II generazione con
biodisponibilità e profilo farmacocinetico ottimali (44).
Cinacalcet HCl
nel trattamento
dell’iperparatiroidismo secondario
Studi preliminari effettuati in pazienti con iperparatiroidismo secondario da IRC hanno evidenziato che cinacalcet riduce non
solo i livelli plasmatici di PTH,
ma anche la calcemia e la fosforemia (47-49).
Molto recentemente Block et al.
(50) hanno riportato i risultati
combinati di due identici trial
clinici, controllati con placebo,
in cui cinacalcet è stato somministrato ad un ampio gruppo di
pazienti in emodialisi e con iperparatiroidismo secondario.
Il principale criterio di eligibilità è stato il livello plasmatico
del PTH che doveva essere ≥
300 pg/ml in almeno 3 misurazioni effettuate nel periodi di
screening (30 giorni).
Hanno soddisfatto i criteri di
eligibilità 741 pazienti che sono stati randomizzati per ricevere cinacalcet (371) o placebo (370).
Il trattamento è durato 26 settimane suddivise in due fasi:
una prima fase di 12 settimane
in cui si è proceduto alla titolazione della dose (da 30 a 180
mg in modo sequenziale) nell’intento di raggiungere livelli
di PTH ≤ 250 pg/ml, e una seconda fase di 14 settimane di
valutazione dell’efficacia.
L’end-point primario dello studio è stato la percentuale di pazienti che nella fase di valutazione dell’efficacia ha mantenuto un livello medio di pTH
≤ 250 pg/ml, mentre end-point
secondari sono stati la percentuale di pazienti che hanno mostrato una riduzione media del
PTH del 30% rispetto al valore basale e le variazioni percentuali del PTH, del Ca, del P
e del prodotto Ca x P.
Lo studio ha dato esito ai seguenti risultati:
il 43% dei pazienti del gruppo cinacalcet ha raggiunto
l’end-point primario, mentre
nel gruppo placebo ciò si è verificato solo nel 5% dei pazienti (p < 0,001) (Figura 8);
Questi risultati indicano che nei
pazienti con iperparatiroidismo
secondario a IRC cinacalcet riduce significativamente i livelli
plasmatici di PTH e migliora l’omeostasi Ca- P rendendo più facile il raggiungimento dei target
terapeutici indicati dalle linee
guida.
70
64
Pazienti (%)
60
Placebo
(n = 370)
p < 0,001
50
Cinacalcet
(n = 371)
43
40
30
20
11
10
5
0
Riduzione del PTH
a valori ≤ 250 pg/mL
Diminuzione ≥ 30%
dei livelli plasmatici dell’ormone
Figura 8.
Iperparatiroidismo secondario da IRC: percentuale dei pazienti in cui la terapia
con cinacalcet o con placebo ha determinato la riduzione del PTH a valori
≤ 250 pg/ml o una diminuzione ≥ 30% dei livelli plasmatici dell’ormone (50).
Figura 9.
Iperparatiroidismo secondario da IRC: variazione nel tempo della percentuale
dei pazienti con riduzione del PTH a valori ≤ 250 pg/ml
per effetto del trattamento con cinacalcet o con placebo (50).
Titolazione
dose
70
Valutazione
efficacia
Riduzione del PTH
a valori ≤ 250 pg/mL
60
p < 0,001
Cinacalcet
50
40
30
20
Placebo
10
0
0
2
4
6
8
10 12 14 16 18 20 22 24 26
Settimane
Placebo
20
0
–20
Cinacalcet
–40
p < 0,001
–60
–80
Titolazione
dose
Valutazione
efficacia
–100
0
2
4
6
8
10 12 14 16 18 20 22 24 26
Settimane
Figura 10.
Iperparatiroidismo secondario da IRC: variazione percentuale del PTH
nel tempo per effetto del trattamento con cinacalcet o con placebo (50).
INFORMED
p < 0,001
Variazione percentuale del PTH
nel tempo
la riduzione del 30% del PTH
è stata ottenuta nel 64% dei
pazienti che ha ricevuto cinacalcet, mentre nel gruppo placebo ciò si è verificato nell’11%
dei casi (p < 0,001) (tale riduzione non è apparsa correlata
ai livelli basali dell’ormone)
(Figura 8);
nel gruppo cinacalcet la percentuale di pazienti che ha raggiunto l’end-point primario è
aumentata durante tutta la durata dello studio, mentre essa
è rimasta stabile nel gruppo
placebo (Figura 9);
nel gruppo cinacalcet i livelli del
PTH si sono ridotti globalmente del 43%, mentre nel gruppo
placebo essi sono cresciuti del
9% (p < 0,001) (Figura 10);
calcemia e fosforemia si sono
ridotte rispettivamente del 6,8
e dell’8,4% nel gruppo cinacalcet, mentre sono rimaste invariate nel gruppo placebo (p
< 0,001);
il prodotto Ca x P si è ridotto
del 14,6% nel gruppo cinacalcet, mentre è rimasto invariato
nel gruppo placebo (p <
0,001);
il trattamento con cinacalcet è
stato giudicato ben tollerato e
gli episodi di nausea e vomito
che si sono verificati con maggior frequenza nei pazienti che
hanno ricevuto tale farmaco sono stati transitori e di entità lieve-moderata.
vol. 7, n. 2, suppl. 2, 2004
7
INFORMED
vol. 7, n. 2, suppl. 2, 2004
8
Bibliografia
1. Brown EM. Physiology of calcium homeostasis. In: Bilezikian JP, Marcus R, Levine
MA (eds). The parathyroids: basic and clinical concepts. 2nd ed. San Diego (CA),
Academic Press 2001:167-181
14. Skorecki K, Green J, Brenner BM.
Chronic renal failure. In: Braunwald E, Fauci
AS, Kasper DL, et al. (eds). Harrison’s principles of internal medicine. 15th ed. McGraw-Hill
2001: 1551-1562
2. Holick MF, Krane S.M. Introduction to bone
and mineral metabolism. In: Braunwald E,
Fauci AS, Kasper DL, et al. (eds). Harrison’s
principles of internal medicine. 15th ed.
McGraw-Hill 2001: 2192-2205
15. Rix M, Andreassen H, Eskildsen P, et al.
Bone mineral density and biochemical markers
of bone turnover in patients with predialysis
chronic renal failure. Kidney Int 1999;
56:1084-1093.
3. National Kidney Foundation K/DOQI.
Clinical practice guidelines: bone metabolism
and disease in chronic kidney disease.
http://www.kidney.org/professionals/kdoqi/gu
idelines_bone/Guide6.htm
16. Martinez I, Saracho R, Montenegro J, Llach
F. The importance of dietary calcium and phosphorous in the secondary hyperparathyroidism
of patients with early renal failure. Am J
Kidney Dis 1997; 29:496-502
4. Marieb EN. Human anatomy and physiology. 5th ed. San Francisco (CA), Benjamin
Cummings 2001:948-1002
17. Torres A, Lorenzo V, Hernandez D, et al.
Bo-ne disease in predialysis, hemodialysis, and
CAPD patients: evidence of a better bone
response to PTH. Kidney Int 1995; 47:14341442
5. Coburn JW, Salusky IB. Renal bone diseases:
clinical features, diagnosis, and management.
In: Bilezikian JP, Marcus R, Levine MA (eds).
The parathyroids: basic and clinical concepts.
2nd ed. San Diego (CA), Academic Press
2001:635-661
6. Kronenberg HM, Bringhurst FR, Segre GV,
Potts JT jr. Parathyroid hormone biosynthesis
and metabolism. In: Bilezikian JP, Marcus R,
Levine MA (eds). The parathyroids: basic
and clinical concepts. 2nd ed. San Diego (CA),
Academic Press 2001:17-30
7. Urena P, Frazao JM. Calcimimetic agents:
review and perspectives. Kidney Int 2003; 63
(Suppl. 85):S91-S96
8. Goodman WG, Belin TR, Salusky IB. In vivo
assessments of calcium-regulated parathyroid
hormone release in secondary hyperparathyroidism. Kidney Int 1996; 50:1834-1844
9. Brown EM, Conigrave A, Chattopadhyay
N. Receptors and segnaling for calcium ions.
In: Bi-lezikian JP, Marcus R, Levine MA
(eds). The pa-rathyroids: basic and clinical
concepts. 2nd ed. San Diego (CA), Academic
Press 2001:127-142
18. Martin-Salvago M, Villar-Rodriguez JL,
Palma-Alvarez A, et al. Decreased expression
of calcium receptor in parathyroid tissue in
patients with hyperparathyroidism secondary
to chronic renal failure. Endocr Pathol 2003;
14:61-70
19. Fukuda N, Tanaka H, Tominaga Y, et al.
Decreased 1,25-dihydroxyvitamin D3 receptor density is associated with a more severe
form of parathyroid hyperplasia in chronic
uremic patients. J Clin Invest 1993; 92:14361443
30. Sherrard DJ, Hercz G, Pei Y, et al. The
spectrum of bone disease in end-stage renal
failure - an evolving disorder. Kidney Int 1993;
43:436-442
31. Wang M, Hercz G, Sherrard DJ, et al.
Relationship between intact 1-84 parathyroid
hormone and bone histomorphometric parameters in dialysis patients without aluminum toxicity. Am J Kidney Dis 1995; 26:836-844
32. Hruska KA, Teitelbaum SL. Renal osteodystrophy. N Engl J Med 1995; 333:166-174
10. Slatopolsky E, Dusso A, Brown AJ. The
role of phosphorus in the development of secondary hyperparathyroidism and parathyroid cell proliferation in chronic renal failure.
Am J Med Sci 1999; 317:370-376
33. Qi Q, Monier-Faugere MC, Geng Z,
Malluche HH. Predictive value of serum
parathyroid hormone levels for bone turnover
in patients on chronic maintenance dialysis. Am
J Kidney Dis 1995; 26:622-631
11. Moallem E, Kilav R, Silver J, NavehMany T. RNA-Protein binding and post-transcriptional regulation of parathyroid hormone gene expression by calcium and phosphate.J Biol Chem 1998; 273:5253-5259
34. Lindner A, Charra B, Sherrard DJ, Scribner
BH. Accelerated atherosclerosis in prolonged
maintenance hemodialysis. N Engl J Med.
1974; 290:697-701
12. Silver J, Naveh-Many T, Mayer H, et al.
Regulation by vitamin D metabolites of parathyroid hormone gene transcription in vivo in
the rat. J Clin Invest 1986; 78:1296-1301
13. National Kidney Foundation. K/DOQI
clinical practice guidelines for chronic kidney
disease: evaluation, classification, and stratification. Am J Kidney Dis 2002; 39 (Suppl.
1:S1-S246
35. Guerin AP, London GM, Marchais SJ,
Metivier F. Arterial stiffening and vascular calcifications in end-stage renal disease. Nephrol
Dial Transplant. 2000; 15:1014-1021
36. Block G, Port FK. Calcium phosphate
metabolism and cardiovascular disease in
patients with chronic kidney disease. Semin
Dial 2003; 16:140-147
37. Salusky IB, Goodman WG. Cardiovascular
calcification in end-stage renal disease. Nephrol
Dial Transplant 2002; 17:336-339
38. Blacher J, Guerin AP, Pannier B, et al.
Arterial calcifications, arterial stiffness, and
cardiovascular risk in end-stage renal disease.
Hypertension. 2001; 38:938-942
39. Wang AY, Wang M, Woo J, et al. Cardiac
valve calcification as an important predictor for
all-cause mortality and cardiovascular mortality in long-term peritoneal dialysis patients: a
prospective study. J Am Soc Nephrol 2003;
14:159-168
40. Cunningham J. What is the optimal regimen
for vitamin D? Kidney Int Suppl 1999; 73:S5964
41. Goodman WG. Recent developments in the
management of secondary hyperparathyroidism. Kidney Int 2001; 59:1187-1201
42. National Kidney Foundation K/DOQI.
Clinical practice guidelines: bone metabolism
and disease in chronic kidney disease.
http://www.kidney.org/professionals/kdoqi/gu
idelines_bone/guide1.htm#table15
43. National Kidney Foundation K/DOQI.
Clinical practice guidelines: bone metabolism
and disease in chronic kidney disease.
Mhttp://www.kidney.org/professionals/kdoqi/
guidelines_bone/Guide3.htm
44. Goodman WG, Turner SA. Future role of
calcimimetics in end-stage renal disease. Adv
Ren Replace Ther 2002; 9:200-208
45. Nemeth EF. Calcium receptors as a novel
drug targets. In: Bilezikian JP, Raisz LG,
Rodan GA (eds). Principles in bone biology.
San Diego (CA), Academic Press 1996:
1019-1035
46. Nemeth EF, Steffey ME, Hammerland
LG, et al. Calcimimetics with potent and
selective activity on the parathyroid calcium
receptor. Proc Natl Acad Sci USA 1998;
95:4040-4045
47. Goodman WG, Hladik GA, Turner SA, et
al. The calcimimetic agent AMG 073 lowers
plasma parathyroid hormone levels in
hemodialysis patients with secondary hyperparathyroidism. J Am Soc Nephrol 2002;
13:1017-1024
48. Quarles LD, Sherrard DJ, Adler S, et al.
The calcimimetic AMG 073 as a potential
treatment for secondary hyperparathyroidism of end-stage renal disease. J Am Soc
Nephrol 2003; 14:575-583
49. Lindberg JS, Moe SM, Goodman WG, et
al. The calcimimetic AMG 073 reduces
parathyroid hormone and calcium x phosphorus in secondary hyperparathyroidism.
Kidney Int 2003; 63:248-254
50. Block GA, Martin KJ, de Francisco AL, et
al. Cinacalcet for secondary hyperparathyroidism in patients receiving hemodialysis. N
Engl J Med 2004; 350:1516-1525
INFORMED
Direttore Responsabile
Redazione & Amministrazione
Pietro Cazzola
Edizioni Scripta Manent s.n.c.Via Bassini, 41 - 20133 Milano
Tel. 0270608060 - 0270608091
Fax 0270606917
E-mail: [email protected]
Marketing & Pubblicità
Armando Mazzù
Sviluppo Nuove Tecnologie
Antonio Di Maio
Consulenza Grafica
Stampa
Piero Merlini
Arti Grafiche Bazzi, Milano
Registrazione Tribunale di Milano n. 378 del 28.05.98
È vietata la riproduzione totale o parziale di articoli, illustrazioni
e fotografie, pubblicati su INFORMED, con qualsiasi mezzo,
senza espressa autorizzazione dell’Editore.
L’Editore non risponde dell’opinione espressa
dagli Autori degli articoli.
Diffusione gratuita.
Ai sensi della legge 675/96 è possibile in qualsiasi momento opporsi all’invio della rivista comunicando per iscritto la propria decisione a: Edizioni Scripta Manent s.n.c. - Via Bassini, 41 - 20133 Milano