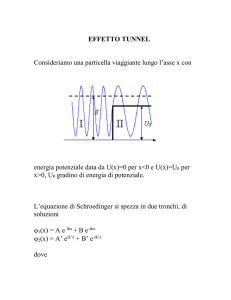
Costruzione dell’equazione di Schrödinger
[Tratto da: M.Karapetyants and S.Drakin, The structure of matter, MIR publisher, 1974]
In meccanica classica lo studio del moto di un corpo puntiforme di massa m e vettore posizione
G
r (t ) richiede la scrittura e la risoluzione, date le opportune condizioni al contorno, dell’equazione
differenziale
G
d2 G
F =m 2r.
dt
Questa è conosciuta come l’equazione di Newton per il problema dato. La conseguente descrizione
è di tipo deterministico, nel senso che la risoluzione dell’equazione fornisce la traiettoria in
funzione del tempo. Questa a sua volta permette di ricavare punto per punto con accuratezza
illimitata tutte le variabili cinematiche della particella (posizione, velocità ed accelerazione). Se si
volessero misurare le variabili cinematiche con opportuni esperimenti, l’accuratezza dei valori
ricavati dalla misura sarebbe limitata solo dalla accuratezza degli strumenti di misura.
Nei problemi microscopici (atomi, molecole, comportamento degli elettroni nei solidi, ecc.) la
descrizione deterministica cade in difetto. Per descrivere correttamente i fenomeni fisici
microscopici occorre introdurre una rappresentazione ondulatoria (o meglio probabilistico).
È un fatto accertato che particelle microscopiche come elettroni subiscono effetti di diffrazione,
fenomeni di tipo prettamente ondulatorio. La diffrazione degli elettroni è oggigiorno un metodo ben
consolidato per lo studio della struttura cristallina dei solidi.
Fu il fisico francese De Broglie che nel 1924 nella sua tesi di laurea avanzò l’idea che le particelle
possedessero proprietà ondulatorie. In accordo con la teoria dei fotoni (per descrivere il dualismo di
comportamento ondulatorio-corpuscolare della radiazione elettromagnetica) che si stava affermando
nello stesso periodo, De Broglie ipotizzò che alle particelle potesse essere associata una lunghezza
d’onda caratteristica, data dalla relazione
λ=
h
p
dove p è la quantità di moto, λ è la lunghezza d’onda associata ed h ≈ 6.63 x 10-34 J s è una costante
universale nota come costante di Planck .
De Broglie riuscì a mostrare che le orbite degli elettroni in un atomo di Idrogeno secondo il modello
di Bohr potevano essere spiegate interpretando gli elettroni come onde, dotate di λ = h / p , e
imponendo tra tutte le orbite possibili solo quelle contenenti un numero intero di lunghezze d’onda
(orbite stazionarie).
-e
R
λ
+e
La condizione di quantizzazione delle orbite elettroniche introdotta da Bohr è dunque ridotta ad una
condizione al contorno per le onde associate agli elettroni.
Si può facilmente mostrare come si giunga a tali condizioni di quantizzazione utilizzando la
relazione di De Broglie. In un modello atomico secondo il quale le orbite elettroniche sono
rappresentate da circonferenze si ha che la forza di interazione è centrale (centripeta)
F = ma = m
v2
R
D’altra parte, essendo la forza di interazione tra nucleo ed elettrone (di carica in modulo pari ad e)
di tipo elettrostatico,
e2
4πε 0 R 2
1
F=
si ha, tenendo anche conto dell’espressione dell’energia cinetica Ek =
Ek =
1 2
mv ,
2
1 1 e2
.
2 4πε 0 R
p2
h2
=
e utilizzando la condizione di stazionarietà per le orbite permesse,
2m 2mλ 2
2π R = nλ , si ottiene
Sostituendo a Ek =
R=
hε 0 2
n .
me 2π
Tale relazione rappresenta la condizione di quantizzazione delle orbite elettroniche introdotta da
Bohr nel suo modello atomico.
Come conseguenza del comportamento ondulatorio delle particelle microscopiche, si osservi che
l’onda caratteristica di ogni singola particella interessa una regione di spazio molto maggiore delle
dimensioni della particella stessa. Si noti inoltre che ad ogni particella può essere associata una
lunghezza d’onda caratteristica. A parità di quantità di moto però, la lunghezza d’onda sarà tanto
maggiore quanto minore la massa della particella. Per tali motivi i comportamenti ondulatori sono
ben osservabili su particelle di piccola massa (come elettroni) e divengono man mano meno
rilevanti per particelle più pesanti, per le quali il comportamento di tipo corpuscolare è dominante.
Per descrivere correttamente i fenomeni microscopici occorre dunque introdurre una descrizione
ondulatoria.
La variabile associata alla particella da cui sono calcolabili tutte le sue proprietà non è più la sua
traiettoria, come per le particelle classiche, ma la cosiddetta funzione d’onda, Ψ ( x, y , z , t ) . La
funzione d’onda è in generale una funzione complessa delle variabili spaziali e temporali. Il suo
significato non è quello deterministico fornito dalla traiettoria della particella classica. Essa fornisce
la probabilità, data dall’espressione
2
dP = Ψ ( x, y , z.t ) dxdydzdt ,
di trovare la particella in un istante compreso tra t e t+dt nel volume dxdydz attorno al punto di
coordinate xyz.
La meccanica che descrive il moto della particella prende il nome di meccanica quantistica o
meccanica ondulatoria, a differenza di quella classica basata sull’equazione di Newton.
La questione è ora stabilire l’equazione dinamica che la funzione d’onda deve soddisfare,
risolvendo la quale è possibile conoscere l’evoluzione del sistema microscopico nel tempo e nello
spazio. Tale equazione prende il nome di equazione di Schrödinger e sostituisce l’equazione di
Newton.
È possibile mostrare come l’equazione di Schrödinger può essere ottenuta partendo dell’equazione
delle onde in cui si è introdotta, tramite la relazione di De Broglie, la lunghezza d’onda associata ad
una particella di quantità di moto p.
Si supponga di avere un’onda stazionaria del tipo
G G
α ( x, y, z , t ) = a cos ωt sin k ⋅ r = Ψ ( x, y, z ) cos ωt .
Essa è soluzione dell’equazione delle onde. Una volta sostituita nell’equazione alle onde si ha
δ2
δ2
δ2
1 ∂2
Ψ
(
x
,
y
,
z
)
cos
ω
t
+
Ψ
(
x
,
y
,
z
)
cos
ω
t
+
Ψ
(
x
,
y
,
z
)
cos
ω
t
−
Ψ ( x, y, z ) cos ωt = 0 .
δx 2
δy 2
δz 2
v 2 ∂t 2
Eseguendo le derivazioni rispetto al tempo si ottiene
δ2
δ2
δ2
2π
Ψ ( x, y , z ) + 2 Ψ ( x , y , z ) + 2 Ψ ( x , y , z ) + ( ) 2 Ψ ( x , y , z ) = 0 .
2
λ
δx
δy
δz
Utilizzando ora la condizione di De Broglie alla lunghezza d’onda si può assegnare la quantità di
moto della particella ottenendo
δ2
δ2
δ2
4π 2 2
Ψ
(
x
,
y
,
z
)
+
Ψ
(
x
,
y
,
z
)
+
Ψ
(
x
,
y
,
z
)
+
p Ψ ( x, y , z ) = 0 .
δx 2
δy 2
δz 2
h2
Poiché l’energia cinetica della particella è data da:
Ek =
p2
2m
sostituendo si ottiene
8π 2 mE k
δ2
δ2
δ2
Ψ
(
x
,
y
,
z
)
+
Ψ
(
x
,
y
,
z
)
+
Ψ
(
x
,
y
,
z
)
+
Ψ ( x, y , z ) = 0
δx 2
δy 2
δz 2
h2
che rapresenta l’equazione di Schrödinger per una particella libera.
Nel caso di una particella che si muove in un campo di forze di energia potenziale U(x,y,z) la sua
energia totale è data da:
E=
p2
+ U ( x, y , z )
2m
e quindi
p 2 = 2m[ E − U ( x, y, z )]
che sostituita nell’equazione di Schrödinger fornisce:
δ2
δ2
δ2
8π 2 m
Ψ
(
x
,
y
,
z
)
+
Ψ
(
x
,
y
,
z
)
+
Ψ
(
x
,
y
,
z
)
+
[ E − U ( x, y, z )]Ψ ( x, y, z ) = 0
δx 2
δy 2
δz 2
h2
o l’equivalente
−
δ2
δ2
δ2
Ψ
(
x
,
y
,
z
)
+
Ψ
(
x
,
y
,
z
)
+
Ψ ( x, y, z )] + U ( x, y, z )Ψ ( x, y, z ) = EΨ ( x, y, z )
8π 2 m δx 2
δy 2
δz 2
h2
[
che è l’equazione di Schrödinger non dipendente dal tempo per una particella che si muove in un
campo di forze di energia potenziale U(x,y,z). Tale relazione può essere anche espressa in forma
compatta come
−
=2 2
∇ Ψ ( x, y, z ) + U ( x, y, z )Ψ ( x, y, z ) = EΨ ( x, y, z ) .
2m
Introducendo poi l’operatore Hamiltoniano H, che rappresenta l’operatore energia totale della
particella, la precedente relazione si scrive anche
H Ψ ( x, y , z ) = E Ψ ( x, y , z )
dove l’operatore H è dato da
−
=2 2
∇ + U ( x, y , z ) .
2m
Il primo termine è l’operatore energia cinetica ed il secondo l’operatore energia potenziale.
L’equazione precedente prende anche il nome di equazione agli autovalori, dove E rappresenta
l’autovalore energia della particella di funzione d’onda Ψ(x,y,z). La conoscenza di queste due
grandezze equivale alla risoluzione del problema di meccanica ondulatoria.