Il Sistema
Immunitario
Patogeno è qualsiasi organismo dotato del potenziale di provocare una malattia.
Divisi in 4 categorie:
batteri, funghi, virus, parassiti
Patogeno opportunista: colonizza l’organismo senza provocare una malattia.
Può divenire patogeno se le difese sono indebolite.
Batteri
SARS virus
Parassiti nei globuli rossi
Fungi
L’organismo reagisce all’invasione di un patogeno con due
tipi di risposta:
-Risposta immunitaria innata
-Risposta immunitaria acquisita
>umorale (cellule B , anticorpi)
>cellulo-mediata (cellule Tc e Th)
Il Sistema immunitario deve essere in grado di
disitinguere il self dal non-self (tolleranza verso il self)
IMMUNITA’
innata
acquisita
• aspecifica
• riconosce strutture
comuni
• sempre operativa
• sempre uguale
• specifica
• previene l’infezione
• richiede l’infezione
• riconosce strutture
specifiche
• consegue al contatto
• potenziata da contatti
ripetuti
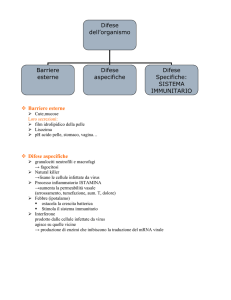
IMMUNITA’ INNATA
• Comprende 4 tipi di barriere:
– Anatomica
• Cute
• Superficie delle mucose
– Fisiologica
• Temperatura
• pH
• Fattori solubili
– Endocitica/fagocitica
• fagocitosi
– Infiammatoria
• Complesso Risposta infiammatoria
Cute:
-barriera meccanica ritarda l’ingresso dei microbi
- l’ambiente acido(pH 3-5) ne ritarda la crescita
Mucose:
- la flora normale compete con i microbi per i siti di
attacco e i nutrienti
-il muco intrappola i microrganismi interi
- Le ciglia spingono i microrgansimi fuori dal corpo
Temperatura: -la normale t inibisce la crescita di alcuni patogeni
-la febbre inibisce la crescita di alcuni patogeni
pH:
- l’acidità gastrica uccide la maggior parte dei patogeni
ingeriti
Mediatori chimici: -lisozima scinde la parete batterica
-interferone induce uno stato antivirale nelle
cellule infettate
- Il sistema del complemento lisa i mocrorganismi e
facilita la fagocitosi
•
•
•
•
•
1-2 adesione del batterio a lunghe evaginazioni della membrana
(pseudopodi)
3- ingestione del batterio con formazione del fagosoma che si muove
verso il lisosoma
4- fusione del fagosoma e lisosoma con rilascio di enzimi lisosomiali nel
fagosoma
5- digestione del materila ingerito
6- rilascio di prodotti di digestione della cellula
Fagocitosi
INFIAMMAZIONE
Il danno tissutale provoca il rilascio di vari fattori vasoattivi e chemiotattici.
Questi fattori inducono aumento del flusso sanguigno nell’area, aumento della permeabilità capillare
e afflusso dei globuli bianchi, tra cui fagociti e linfociti.
Le proteine seriche contenute nell’essudato hanno proprietà antibatteriche e i fagociti incominciano
a fagocitare i batteri
Tra i principali mediatori chimici ci sono: proteine della fase acuta
istamina
chinine
Il Sistema immunitario:
meccanismi di base
Componenti del sistema immunitario: organi linfatici e leucociti.
Organi linfatici: i leucociti si sviluppano fino alla maturità negli organi linfatici PRIMARI (il
midollo osseo e nel caso dei linfociti T, il timo). Gli organi linfatici periferici mostrano
un’architettura reticolare che intrappola materiale estraneo presente nel sangue (milza), nella
linfa (linfonodi), nell’aria (tonsille e adenoidi) e in cibo e acqua (appendice vermiforme e
placche di Peyer nell’intestino).
Leucociti: si dividono in neutrofili, monociti e macrofagi (dai monociti), cellule fagocitarie
che “inglobano e distruggono” agenti estranei e detriti; gli eosinofili ed i basofili proteggono
invece dai grandi parassiti e sono coinvolti nelle reazioni allergiche.
Linfociti: si dividono in B (cellule B) e T (cellule T), specifici rispetto agli agenti esterni. I
linfociti non B e non T sono “natural killer (NK)” antivirali.
Organi del Sistema immunitario
Tonsille e adenoidi
Linfonodi
Vasi linfatici
Timo
Linfonodi
Milza
Placche di Peyer
Appendicite
Linfo nodi
Midollo osseo
Vasi linfatici
CELLULE
Cellule della linea linfatica
• Linfociti sono il 20-40% dei globuli bianchi e
99% delle cellule presenti nella linfa
• Nel corpo umano ci sono circa 1011 linfociti
• Circolano nel sangue e nella linfa e possono
migrare nei diversi tessuti e organI linfatici
• Si dividono in
– Linfociti B
– Linfociti T
– Linfociti null (cellule natural Killer)
Linfociti B
• Maturano nel midollo osseo
• Esprimono sulla superficie un recettore (Ab) specifico per un
antigene (Ab=antibody anticorpo)
• Dopo l’incontro con l’Ag maturano e si differenziano in Linfociti B
della memoria e linfociti effettori (plasmacellule)
• Linfociti B della memoria esprimono lo stesso Ab delle cellule
progenitrici
• Una plasmacellula sercerne più di 2.000 Ab al secondo
• Le plasmacellule muoiono in 1-2 settimane
Cellule T
• Nascono nel midollo osseo e maturano nel timo
• Durante la maturazione esprimono sulla membrana uno
specifico recettore per l’Ag: recettore del linfocita T
(T cell receptor TCR)
• TCR riconosce Ag solo se è legato a proteine MHC,
glicoproteine polimorfiche, presentate da altre cellule
• Ci sono 2 sottopopolazioni di linfociti T:
– T helper (TH)
– Th1 e Th2
– T citotossiche (Tc) o killer
VH
VH
Vβ
β
CH1 CH1
VL
VL
CL
CL
CH2
CH2
Igα/Ιgβ CH3
CH3
Vα
α
γ ε
ε δ
Cβ
β Cα
α
ζ ζ
Igα/Ιgβ
fyn
lck
Zap 70
Blk, Fyn or Lyn
RECETTORE CELLULE B
RECETTORE CELLULE T
• Antigeni sono sostanze in grado di indurre una risposta immunitaria
• Ci sono differenze fondamentali nel modo in cui i linfociti B e T
riconoscno l’Ag
• Immunogenicità e antigenicità sono due propietà
immunologiche correlate, ma distinte
• Un antigene è un immunogeno e l’antigenicità è la sua capacità di
reagire in maniera specifica con i prodotti finali delle risposte
immuni
• "TUTTI GLI IMMUNOGENI SONO
ANTIGENI, MA NON TUTTI GLI
ANTIGENI SONO IMMUNOGENI".
APTENE: molecola solitamente di piccole
dimensioni che hanno la proprietà di essere
antigeniche, ma che di per sé non è in grado
di evocare una risposta immunitaria (sono
prive di immunogenicità).
Può diventare anche immunogenica se si
lega a una molecola carrier.Può reagire con i
prodotti di una risposta immune specifica.
EPITOPO O DETERMINANTE ANTIGENICO:
PARTE DI UN ANTIGENE CHE ENTRA IN CONTATTO
CON IL SITO DI LEGAME DI UN ANTICORPO O COL
RECETTORE PER L’Ag DELLE CELLULE T o B. (GLI
EPITOPI SONO PRATICAMENTE LE PORZIONI PIÙ
IMPORTANTI DELL’ANTIGENE, CAPACI DI EVOCARE
LA RISPOSTA IMMUNITARIA).
Quando i farmaci diventano immunogeni
•
I farmaci sono piccole molecole incapaci di scatenare la risposta
immunitaria se non sono associate a una molecola più grande
•
La penicillina in alcuni individui può reagire con alcune proteine
dell’organismo per formare un derivato penicilloil-proteina (aptene-vettore),
in cui il derivato penicillinico, il gruppo penicilloil, ha la funzione di epitopo
aptenico
•
Questo epitopo è riconosciuto dal sistema immunitario che produce Ab
(IgE) contro di esso. Le IgE vengono trasportate in tutto l’organismo dove
vengono riconosciute dai recettori per le IgE posti sui basofili (mast-cellule)
e rimanere per molto tempo. Se a una persona che ha anticorpi IgE contro
la penicillina viene somministrata penicillina, andrà incotro a reazione
allergica
•
1-5% della popolazione ha questo problema
SISTEMA
IMMUNITARIO
ACQUISITO
Sistema immunitario specifico
Origine
Linfociti:
1.Linfociti T
2.Linfociti B
•
•
La selezione clonale dei linfociti B e linfociti T è alla base della risposta innata
Sia i linfociti B che T esprimono recettori dotati di una singola specificità
– Linfociti B esprimono immunogobuline (Anticorpi, Ab)
– Linfociti T esprimono recettori
VH
VL
VH
CH1 CH1
CL
CH2
Igα/Ιgβ
CH3
Vβ
β Vα
α
VL
ζζ
CL
γε
CH2
CH3Igα/Ιgβ
Cβ
βC
α
fyn
εδ
lck
Zap 70
Blk, Fyn or Lyn
•
Ciascun linfocita da origine a un unico tipo di molecola
•
Ciascun linfocita, stimolato dal patogeno da origine a una popolazione di cellule che
esprimono tutte immunoglobuline o recettori delle cellule T identici (SELEZIONE
CLONALE)
Esempio: SELEZIONE CLONALE nei linfociti B
Ogni linfocita B esprime
sulla membrana 150.000
Anticorpi (recettori) identici per lo
stesso Ag
Antibody Molecule Structure
Ag binding
region
VH
N terminal
end
VL
CH1
tC
ha
in
disulfide
bonds
Heavy Chain
CHO
CH2
h
CH3
Li
gh
C terminal
end
Ag
CL
=
globular
domains
Y
•
•
•
•
•
•
•
•
•
•
•
2 catene leggere identiche (L, light, 220 aminoacidi)
2 catene pesanti identiche (H, heavy, 440 aminoacidi)
A forma di Y rovesciata
Ponti S-S fra le catene
2 siti di legame per Ag (bivalenti)
Zona di riconoscimento per Ag o Fab (Fragment Antigen
Binding) con sequenza di aminoacidi relativamente variabile
Zona costante o Fc (Fragment cristallizzabile) con sequenza
di aminoacidi relativamente costante
REGIONI IPER VARIABILI
La variabilità della sequenza di aminoacidi è confinata in 3
regioni ipervariabili (5-7 aminoacidi per L, 6-17 aminoacidi
per H)
Il sito antigenico è composto dalle regioni ipervariabili della
catena L e dalle regione ipervariabili della catena H
Alta costante di affinità Ig-Ag (104-1011 l/mole)
Papain Cleavage
Papain Cleavage
2 Fab
Fc
Pepsin Cleavage
Pepsin Cleavage
F(ab’)2
Enzymatic degradation
of Fc fragment.
Funzione effettrice
Legame a C4b
C fissazione
(legame a C1q )
Si lega a FcR
(Mac, Mono)
Si lega a FcR
(neutrofili; NK cells)
Classi di anticorpi
Esistono 2 tipi di catene leggere
– K (uomo 60%)
− λ (uomo 40%)
Esistono 5 classi di catene pesanti:
µ, γ, α, δ, ε
Ognuna di queste diverse catene pesanti è chiamata
ISOTIPO
Ogni Ab è formato da 2 catene pesanti e 2 catene leggere
identiche H2L2, oppure è un multimero di questa struttura
base a 4 catene (H2L2)n
5 Classi di anticorpi nell’uomo
• Classe
catena
pesante
sottoclassi
catena
leggera
formula
molecolare
ΙgG
γ
γ1γ2γ3γ4
Κ, λ
γ2Κ2, γ2 λ2
IgM
µ
nessuna
Κ, λ
(µ2Κ2)n
(µ2λ2)n n=1 o 5
IgA
α
α1, α2
Κ, λ
(α2Κ2)n
(α2λ2)n n=1,2,3,4
IgE
ε
nessuna
Κ, λ
(ε2Κ2) (ε2λ2)
IgD
δ
nessuna
Κ, λ
(δ2Κ2) (δ2λ2)
Immunoglobuline: struttura
IgG, IgD, IgE, and IgA
IgA
IgM
Funzione degli anticorpi
•
•
•
•
IgG:
Coinvolte nella risposta umorale
70% delle Ig sieriche
Azioni:
–
–
–
–
•
•
•
•
•
Opsonizzazione
Neutralizzazione di microbi e tossine
Attivazione del complemento per via classica
Attraversare la placenta
IgM:
Primi a comparire nel sangue in risposta ad antigeni
Potere agglutinante a causa dei molteplici siti disponibili
Attivatori del Complemento
Non attraversano la placenta
•
•
•
•
IgA:
Ig dimeriche
Sintetizzate da linfociti B dei tessuti linfoidi associati alle mucose
Presenti nelle secrezioni, latte, saliva, lacrime, etc.
– Impediscono l’aderenza di microrganismi.
– Scarsa attività opsonizzante
– Attivazione del complemento per via alternativa
• IgE:
• Reazioni di ipersensibilità di Tipo I (asma, febbre da fieno)
provocando il rilascio di citochine e mediatori infiammatori.
• Attivi nelle infezioni da parassiti favorendo l’attività citotossica degli
eosinofili.
• IgD:
• Ig di membrana espresse sulla superficie dei linfociti.
• Ruolo non chiarito, ma sono importanti drante la differenziazione dei
linfociti B.
Ruolo delle IgE nella secrezione di istamina
Recettore Fc
per IgE
mastocita
IgE
Ag
Vescicole di
istamina
Istamina
Vasodilatazione, reazioni
allergiche
Rilascio di
istamina
Caratteristiche delle risposte immunitarie
•
Versatilità: numero di potenziali
Ag>108:
Molecole fisiologiche
Virus
Cellule
Molecole non fisiologiche (intolleranze
•
•
a materiali sintetici)
Memoria: La prima esposizione a Ag
provoca la produzione di Ab che
rendono la seconda esposizione a Ag
meno dannosa della prima
Umorali: Produzione di Ab solubili
che circolano nel sangue
Formazione del complesso Ab-Ag
Precipita con la sostanza estranea
•
(complemento) o marcatura per la
distruzione (macrofagi)
Cellulari: Produzione di cellule
(linfociti T) dagli organi linfoidi
1012 linfociti nell’organismo
Teoria della selezione clonale
•
•
Il sistema immunitario è composto da milioni di cloni provenienti da un
progenitore comune
Ogni linfocita:
E’ destinato a reagire con un Ag specifico prima dell’esposizione a Ag
> “Pronto per l’uso”, e non “fatto su misura”
Possiede recettori (Ig) sulla superficie che riconoscono un solo Ag
•
Prolifera e matura solo dopo il riconoscimento
3 stadi di sviluppo delle cellule:
Cellule vergini (o naïve)
Cellule memoria che vivono a lungo (mesi/anni)
Cellule attivate che producono Ab e vivono pochi giorni
Come distinguere il self dal non-self?
•
•
•
L’organismo eredita tutti i geni dei recettori non-self, ma non i geni dei
recettori del self: NO!
Il sistema immunitario risponde alla presenza dei vari Ag, imparando a non
rispondere al self: NO!
La tolleranza verso il self non è congenita ma acquisita durante la vita
fetale
Clonal deletion: eliminazione dei linfociti diretti contro il self
Clonal anergy: i linfociti diretti contro il self sono inattivati ma vivi (la
riattivazione conduce alle malattie autoimmuni, ad es lupus eritematoso)
Immunoglobuline
•
4 catene polipeptidiche
2 catene leggere identiche (L, light, 220
•
•
aa)
2 catene pesanti identiche (H, heavy,
440 aa)
A forma di Y
Ponti S-S fra le catene
2 siti di legame per Ag
3 zone:
Zona cerniera (hinge region)
Zona costante o Fc (Fragment
Cristallizzabile) con sequenza di
aminoacidi relativamente costante
Zona di riconoscimento per Ag o Fab
(Fragment Antigen Binding) con
sequenza di aminoacidi relativamente
variabile
Struttura primaria
CH3
Catena pesante H
Parte costante
•
•
•
Catene H e L: segmenti ripetuti di 110
aminoacidi con notevole analogia
Dominii variabili (V) e costanti (C)
Catena L=VL + CL
Catena H=VH + CH1 + CH2 + CH3
CH2
-S-S-S-S-
Catena leggera L
-S-S-
-S-S-
CL
CH1
Sito di legame con Ag
VH
Gerald M. Edelman
Rockefeller University
New York, NY, USA
Rodney R. Porter
University of Oxford
Oxford, United Kingdom
Premio Nobel 1972
VL
Parte variabile
•
Isoforme della parte costante di Ig
•
5 isoforme H, determinano la classe
IgM, isoforma µ
IgG, isoforma γ
IgA, isoforma α
IgD, isoforma δ
•
IgE, isoforma ε
2 isoforme L, presenti in tutte le classi di Ig
κeλ
Paradosso
•
•
•
Esistono 108 Ab differenti (un Ab per ogni Ag), ma il genoma
umano contiene 20 000 geni al massimo:
Come produrre più Ab di quanti sono i geni nel genoma?
Ipotesi degli anni ‘70 (non si conoscevano i domini delle proteine):
Un sito antigenico è determinato da 1 catena H e 1 catena L
Se ci fossero 1000 geni per L e 1000 geni per H, ci potrebbero
essere 1000x1000=106 differenti siti antigenici
Problema: Il meccanismo dovrebbe essere così sofisticato che
una parte dei geni che codificano le catene L e H (sempre
quella!) rimane sempre costante, mentre il resto può mutare
selvaggiamente: Bello ma FANTASCIENTIFICO !!!
Oggi: Ricombinazione degli esoni
Generazione di una grande variabilità di proteine differenti
congiungendo segmenti separati di geni prima della
trascrizione a RNA
Avviene nelle cellule B prima dell’esposizione a qualunque Ag
Codificazione di κL
•
•
•
•
•
1 sequenza leader (1 copia per gene) → 20 aa per trasportare Ig fuori dalla
cellula (non mostrata)
1 segmento V (150 copie) → 95 aa (regione variabile)
1 segmento J (5 copie) → 13 aa (regione variabile)
1 segmento C (1 copia) → 110 aa (regione costante)
Calcolo combinatoriale:
150 V x 5 J = 750 diverse catene κL
Giunzione V-J non ben definita, n. possibilità x 10
Totale: 7500 combinazioni diverse per le catene κL
Codificazione delle catene H
•
•
•
•
•
Segmenti V: 80 copie
Segmenti D: 50 copie
Segmenti J: 6 copie
Segmento C: 1 copia
Calcolo combinatoriale:
80 V x 50 D x 6 J = 24 000 diverse catene H
Giunzione V-J non ben definita, inserzioni random nelle giunzioni V/D e
D/J
Totale: 2.4 milioni di combinazioni
Calcolo combinatoriale per l’intero sito antigenico (catena L +
catena H)
•
•
•
Il sito antigenico è composto da 1 catena H e 1 L
Totale delle combinazioni possibili per il sito:
7500 x 2.4 milioni = 18x109
Questa enorme variabilità è generata da non più di 300
segmenti di DNA differenti
Susumu Tonegawa, Japan
Massachusetts Institute of Technology (MIT)
Cambridge, MA, USA
Premio Nobel 1987
Fusione di cellule somatiche e
produzione di anticorpi monoclonali
di topo
Cellule eucariote possono sopravvivere al trattamento con aminopterina (inibitore
della DHFR) utilizzando la via di salvataggio per la sintesi del DNA, purché non siano
mutate nei geni che codificano gli enzimi Tk (Timidino-chinasi) o HGPRT
(Ipoxantina-Guanina Fosforibosil-Trasferasi)
amminoacidi + zuccheri
via classica
DHFR
dihydrofolate reductase
aminopterina
nucleotidi
DNA
Tk Timidino-chinasi
basi azotate
via di salvataggio
HGPRT Ipoxantina-Guanina Fosforibosil-Trasferasi
G. Kohler e C. Milstein:
Continuous cultures of fused cells secreting antibodies of predefined specificity
Nature 256: 495-497 (1975)
Partner della fusione:
• Cellule di mieloma di topo HGPRT- che proliferano ma non producono anticorpi
• Splenociti di topo iperimmune nei confronti di eritrociti di pecora.
Gli splenociti sono HGPRT+ e possono produrre anticorpi
ma non proliferano.
Fotografia originale
dei primi ibridomi
4
1
coltura di cellule
di mieloma HGPRT-
1
sospensione di splenociti
(108 cellule) in terreno
senza siero
centrifugazione
Immunizzazione
3
2
splenectomia
3
verifica della risposta
immunitaria specifica
2
unione delle
due sospensioni
di cellule
risospensione
in terreno
senza siero
(2 x 107 cellule)
4
centrifugazione
risospensione
in terreno
HAT
sospensione
mielomasplenociti
centrifugazione
trattamento
con PEG del
pellet per
indurre la
fusione
diluizione graduale
del PEG in terreno
senza siero
PIASTRAMENTO
La selezione viene effettuata in terreni di coltura selettivi
contenenti ipoxantina, aminopterina e timidina (HAT).
L’aminopterina è un analogo dell’acido folico, che blocca la sintesi
delle purine e pirimidine endogene; quindi le cellule per
mltiplicarsi devono servirsi della via alternativa di biosintesi fornita
dall’enzima HGPRT, che permette di utilizzare l’ipoxantina e la
timidina esogene presenti nel terreno HAT. Lecellule prive di
questo enzima muoiono in terreno HAT. I linfociti B e gli
ibridomi cellula B-cellula B, possiedono l’enzima HPRT e
sarebbero quindi capaci di moltiplicarsi in terreno HAT, ma non
essendo immortali non sono capaci di sopravvivere a lungo in
coltura e muoiono dopo poco tempo. Gli ibridomi mielomamieloma mancano dell’enzima HPRT e di conseguenza
non riescono a sopravvivere. Solo l’ibridoma cellula B-cellula
mielomatosa, che ha l’enzima HPRT fornitogli dalle cellule
spleniche, può utilizzare l’ipoxantina e timidina esogene e quindi
sopravvivere emoltiplicarsi nel terreno di selezione.
Selezione di ibridi somatici. Cellule Tk- e cellule HGPRT- non possono crescere in un
terreno nel quale sia presente l’Aminopterina: la via classica è bloccata dalla
Aminopterina, la via di salvataggio è inattiva se manca anche solo uno dei due enzimi.
amminoacidi + zuccheri
via classica
DHFR
aminopterina
nucleotidi
Tkbasi azotate
via di salvataggio
HGPRT-
DNA
Piastramento delle cellule in diluizione limite (almeno 1000
subcolture) in piastre “Microtiter” in terreno selettivo HAT
1
2
3
4
5
6
7
8
9
10
11
12
1
2
3
4
5
6
7
8
9
10
11
12
A
B
C
D
E
F
G
H
A
Trasferimento di un’aliquota
di surnatante da ciascuna subcoltura nella piastra-saggio,
rispettando le posizioni
B
C
D
E
F
G
H
Dosaggio immuno-enzimatico
1
2
3
4
5
6
7
8
9
10
11
12
A
B
Pozzetto rivestito
con l’antigene
C
D
E
F
surnatante dalle
subcolture
G
H
L’anticorpo che non
riconosce l’antigene
non si lega
L’anticorpo specifico
per l’antigene si lega
Aggiunta di un anticorpo anti-Ig di topo
coniugato con l’enzima perossidasi (HRP)
OPD
+
H2O2
(incolore)
Reazione
positiva
(colore)
HRP HRP
pozzetto con
anticorpo specifico
Reazione
negativa
pozzetto senza
anticorpo specifico
1
2
3
4
5
6
7
8
9
10
11
12
Nella piastra-saggio, alcuni pozzetti
danno reazione positiva nei confronti
dell’antigene. Le relative subcolture
vengono recuperate dalla piastra madre,
riclonate, ricontrollate e coltivate in
fermentatori.
A
B
C
D
E
F
G
H
1 2 3 4 5 6 7 8 9 10 11 12
1
2
3
4
5
6
7
8
9
10
11
A
B
C
D
E
F
G
H
12
A
B
C
D
E
F
G
H
1 2 3 4 5 6 7 8 9 10 11 12
A
B
C
D
E
F
G
H
1 2 3 4 5 6 7 8 9 10 11 12
A
B
C
D
E
F
G
H
1 2 3 4 5 6 7 8 9 10 11 12
1 2 3 4 5 6 7 8 9 10 11 12
A
B
C
D
E
F
G
H
A
B
C
D
E
F
G
H
Applicazioni degli anticorpi monoclonali
• Dosaggi immunologici per uso diagnostico e di ricerca
• Purificazione di antigeni mediante immunoaffinità
• Analisi e purificazione di sottopopolazioni cellulari
• Identificazione di antigeni differenziativi
• Anticorpi neutralizzanti infezioni virali e indagini
sulla struttura/funzione di proteine
• Analisi del proteoma
VANTAGGI E LIMITI DEGLI ANTICORPI MONOCLONALI MURINI
• Gli anticorpi sono specifici per un epitopo della molecola riconosciuta.
• Possibilità di produrre anticorpi nei confronti di antigeni ancora ignoti
o di miscele di antigeni.
• Possibilità di mantenere i cloni congelati per lunghi periodi di tempo.
• Possibilità di effettuare studi sugli mRNA dei singoli cloni e clonare le
sequenze che determinano la specificità in sistemi procariotici
o eucariotici.
• Limitate applicazioni in immunoterapia: risposte immunitarie contro
le Ig di topo da parte dei pazienti.
Solo in tempi relativamente recenti (Karpas, P.N.A.S. 2001) è stata
isolata una linea di mieloma umano capace di fondersi con buona
efficienza con linfociti B umani, generando anticorpi monoclonali umani
mieloma umano
linfociti B umani
HGPRT+ S
HGPRT-
Fusione e selezione in HAT
per favorire solo la crescita degli ibridi
e la produzione di anticorpi umani
Tecniche immunoenzimatiche
La specificità delle reazioni antigene-anticorpo e la sensibilità di
“marcatori” (isotopi, sostanze fluorescenti, radicali liberi, enzimi)
possono essere combinate insieme per compiere un “dosaggio
immunologico”, ossia quantificare con precisione una sostanza
antigenica.
La tecnica più usata è il dosaggio radioimmunologico (RIA), in cui il
tracciante è costituito da un isotopo.
Vantaggi:
- elevata sensibilità, della facilità con cui si ottengono le marcature
isotopiche
- invariabilità delle cinetiche di reazione a seguito della marcatura
stessa.
Svantaggi:
- alti costi dei reattivi e delle apparecchiature,
- deperibilità, pericolosità e difficoltà di smaltimento dei composti
radioattivi,
Quando il tracciante è costituito da un enzima, si parla di
dosaggi immunoenzimatici (EIA).
In questo caso non viene misurato direttamente il marcatore,
ma la sua attività nei confronti di un suo substrato specifico
(ovvero la quantità di prodotto formato).
È da tener presente che l’attività enzimatica, come pure
l’affinità fra Ab e Ag, può variare a seguito della
coniugazione fra enzima e anticorpo (o antigene).
Vantaggi:
- minor costo,
- assenza di rischi derivati dall’esposizione a
- maggior praticità e versatilità.
radiazioni,
Saggio competitivo diretto
uso del coniugato Antigene-Enzima
Una quantità fissa di antigene marcato e diluizioni decrescenti di
antigene libero (come standard o nel campione) vengono messe a reagire
insieme nei confronti di un anticorpo in difetto. In questo modo,
l’antigene marcato e libero si troveranno a competere per un numero
limitato di siti anticorpali. Dopo aver lavato il complesso, si aggiunge il
substrato per l’enzima e si misura l’attività enzimatica
spettrofotometricamente,
fluorimetricamente
o
mediante
chemioluminescenza. La concentrazione del prodotto enzimatico
misurata risulterà inversamente proporzionale alla concentrazione
dell’analita.
Saggio competitivo diretto
uso del coniugato Anticorpo-Enzima
Questo tipo di saggio competitivo coinvolge l’uso del coniugato
anticorpo-enzima, con l’antigene immobilizzato sulla fase solida. La
reazione di competizione avviene fra l’antigene immobilizzato e quello
libero in soluzione come standard o proveniente dal campione, nei
confronti dell’anticorpo marcato presente in concentrazione fissa e in
difetto. La misura del prodotto della reazione enzimatica sarà
indirettamente proporzionale alla concentrazione di antigene presente
nel campione.
Saggio competitivo indiretto
uso di un anticorpo secondario
La procedura implica l’uso di un anticorpo secondario marcato, in grado di
riconoscere la regione costante dell’anticorpo primario, precedentemente
incubato su fase solida.
La reazione di competizione avviene fra l’antigene immobilizzato e quello
libero in soluzione come standard o proveniente dal campione, nei confronti
dell’anticorpo presente in concentrazione fissa.
La misura del prodotto enzimatico sarà direttamente proporzionale nel caso
della misura del titolo dell’anticorpo da determinare, mentre inversamente
proporzionale per l’analita.
Saggio non competitivo
Saggio ELISA a sandwich
Questa metodica può essere utilizzata esclusivamente quando l’analita
possiede almeno due determinanti antigenici.
Un eccesso di anticorpo verso il primo sito antigenico viene
immobilizzato sulla fase solida e incubato con diluizioni successive di
antigene presente nel campione o in soluzioni standard. Dopo il
lavaggio, il complesso Ag-Ab immobilizzato viene incubato con una
concentrazione fissa di anticorpo marcato che andrà a legarsi al
secondo sito antigenico dell’immunocomplesso. La misura del
prodotto della reazione enzimatica risulterà direttamente proporzionale
alla concentrazione dell’antigene da stimare.
Fattori che influenzano la scelta del metodo
•Le tecniche ELISA non competitive offrono una maggiore
sensibilità rispetto alle competitive.
•La rilevabilità finale di un’analisi competitiva è limitata dalla
costante di affinità dell’anticorpo usato.
•La sensibilità finale dei saggi non competitivi è determinata dal
binding non specifico degli immunoreagenti marcati.
•Nei saggi competitivi diretti, dipende dal grado di purezza e dalla
stabilità degli immunoreagenti, Ag o Ab, marcati con l’enzima.
•Quando di lavora con campioni reali (sieri, urine, tessuti, ecc),
possono essere presenti proteine in grado di modificare i traccianti
enzimatici (proteasi), oppure di inibirne l’attività.
•L’uso dell’anticorpo secondario consente un’amplificazione della
risposta del saggio, poiché quando si lavora con il solo anticorpo
primario la sensibilità dell’analisi è fortemente influenzata
dall’affinità del sistema Ag-Ab-E.
Sensibilità
•concentrazione dell’analita,
•sensibilità del sistema di rivelazione,
•affinità dell’anticorpo da usare,
•tempo di incubazione
•tempo di sviluppo del prodotto enzimatico,
•precisione del saggio
• volumi impiegati.
Sensibilità (analitica) : capacità di un metodo di distinguere piccole
variazioni di concentrazione di analita. Nella terminologia abituale
immunochimica: capacità di un metodo di distinguere da zero piccole
concentrazioni di analista, inversamente correlata al limite di rivelazione
o di misura, o alla minima concentrazione misurabile (rivelabilità).
Specificità (analitica) : capacità di un metodo di determinare
Scelta dell’enzima
L’enzima da utilizzare in un saggio ELISA deve possedere i seguenti
requisiti:
1 - deve essere stabile in un intervallo di temperatura compreso fra 25 e
37° C, con un tempo di vita di almeno sei mesi a 4° C
2 - deve essere disponibile commercialmente e ad un prezzo
ragionevole
3 - la sua attività deve essere facilmente misurata con opportuni tests
(colorimetrici, fluorimetrici, ecc.)
4 - deve essere facilmente dosabile e possedere un alto numero di turnover e inoltre il suo prodotto di reazione deve avere un alto
coefficiente di estinzione molare
5 - non deve risentire degli effetti negativi della matrice in cui
eventualmente è svolto il saggio
Gli enzimi normalmente più usati sono la perossidasi da rafano, la
ANALISI DEI DATI
100
% A/A
0
80
60
40
20
0
10
-4
10
-3
10
-2
1 0
-1
10
0
1 0
1
[a n a lita ]
Curva di concentrazione/risposta (curva standard, di calibrazione, di taratura) :
espressione grafica dell’andamento della risposta del saggio al variare della
concentrazione dell’analita (standard) utilizzata come scala di calibrazione per
interpolare le risposte relative ai campioni incogniti.
Modello logit-it logistico a “4
parametri”
Y = (a - d)/[1 + (x/c)b] + d
a = valore asintotico del massimo (dose massima)
b = pendenza del tratto rettilineo della sigmoide
c = IC50, ovvero concentrazione dell’analita
nel campione in grado di legare il 50% dell’anticorpo
d = valore asintotico del minimo (dose 0)
Visualizzazione delle proteine nel gel
I due metodi piu’ usati sono:
Colorazione con il Coomassie Brilliant
Colorazione con l’argento “Silver staining” (puo’ essere
visualizzato ~1ng di proteina per banda)
Coomassie staining
Silver staining
Western Blotting
Southern Blot: Per l’analisi del DNA.
(sonda = DNA o RNA).
Northern Blot: Per l’analisi dell’ RNA.
(sonda = DNA o RNA).
Western Blot: Per l’analisi delle proteine.
(sonda = anticorpo).
Cosa e’ un Western Blot?
Una tecnica in cui le proteine sono separate
mediante elettroforesi su gel e
successivamente trasferite su un supporto
(membrana o filtro). Successivamente una
specifica proteina viene identificata mediante
la sua reazione specifica con un anticorpo.
A cosa serve il Western Blot?
Qual e’ la proteina che mi interessa?
SDS-PAGE (non certo)
Si basa sul confronto di peso molecolare
Western blot (certo)
Si basa su una reazione specifica antigene-anticorpo
–
?
+
A cosa serve il Western Blot?
Densita' media
(intensita')
Quanta proteina di interesse c’e’?
Proteina
di interesse
Bande non
specifiche
100
80
60
40
20
0
1
100
10000
[Proteina], pg
Pg di Proteina
Fasi di un Western Blot
Prima fase: elettroforesi su gel.
(Le proteine del campione vengono separate su un
gel in base alle loro dimensioni)
Seconda fase: trasferimento su membrana.
(Le proteine nel gel sono poi trasferite su una
membrana di nitrocellulosa mediante un campo
elettrico)
Terza fase: saturazione o “blocking”.
(La saturazione e’ usata per prevenire le interazioni
non specifiche tra l’anticorpo e la membrana)
Fasi di un Western Blot
Quarta fase: legame dell’anticorpo primario.
(L’anticorpo riconosce la proteina specifica immobilizzata
sulla membrana)
Quinta fase: legame dell’anticorpo secondario.
(L’anticorpo secondario, coniugato a un enzima (AP o
HRP), riconosce specificamente l’anticorpo primario, gia’
legato alla proteina sulla membrana)
Sesta fase: rivelazione o “detection”.
(L’enzima coniugato all’anticorpo secondario scinde un
substrato che, in corrispondenza della proteina specifica,
sviluppa precipitato colorato o chemioluminescenza)
Western blot: seconda fase
Immobilizzazione e trasferimento
Le proteine nel gel sono ancora in soluzione
Le bande diffondono e si confondono col tempo
E’ necessaria l’immobilizzazione per:
Preservare in maniera permanente l’esperimento di
elettroforesi
Permettere il riconoscimento di proteine specifiche
La strategia piu’ comune e’ il trasferimento su
membrana
Fatta di Nitrocellulosa, PVDF (Polivinilidene fluoride) o nylon
Si usa l’elettroforesi, in un processo detto ‘blotting’
Western blot: seconda fase
Immobilizzazione e trasferimento
membrana
Western blot: seconda fase
Immobilizzazione e
trasferimento
Elettroblotting
Apparato di trasferimento
Il gel e’ messo tra strati di carta da filtro con la
membrana a diretto contatto col gel sul lato verso
l’elettrodo positivo
Viene applicato un campo elettrico e le proteine
migrano fuori dal gel verso l’elettrodo positivo e si
legano alla membrana
Fatto a 4°C per evitare surriscaldamento,
decomposizione del tampone e degradazione
delle proteine
Western blot: seconda fase
Immobilizzazione e trasferimento
Trasferimento dal catodo
(-) all’ anodo (+)
1)
2)
3)
4)
5)
6)
Spugnette
3 fogli di carta da filtro
imbevuti di tampone di
trasferimento
Gel
Membrana
3 fogli di carta da filtro
imbevuti di tampone di
trasferimento
Spugnette
Apparato per il trasferimento “Semi-dry”
Western Blotting
-
Buffer-soaked
filter papers
+
Nitrocellulose
membrane
Gel
Buffer
Electrode
SDS-PAGE
Direction of
transfer
Assemble ‘sandwich’
Wet blotting
Graphite Electrode Plates
-
Stained
(Red
Ponceau)
+
Semi-dry blotting
Nitrocellulose with bound proteins
Western blot: seconda fase
Immobilizzazione e
trasferimento
Componenti del tampone di
trasferimento:
25mM Tris
190mM glicina
20% metanolo
3
Western blot: terza fase
saturazione o “blocking”
Per saturare i siti idrofobici
liberi sulla membrana
Per prevenire il legame
dell’anticorpo primario alla
membrana stessa
Latte scremato o Albumina
di Siero Bovino (BSA)
4
Western blot: quarta fase
incubazione con anticorpo
primario
L’anticorpo primario riconosce la proteina di
interesse e non lega le altre proteine
immobilizzate sulla membrana
Anticorpi come sonde:
Molto sensibili
Possono essere “prodotti”
Immunizzando una specie diversa (anticorpi policlonali)
Generando anticorpi monoclonali (mAb)
Economici
Anticorpi
Ab + Ag
AbAg
Kd
Kd =
[Ab] = 10-9 M
[AbAg]
Anticorpi
Anticorpi (immunoglobuline, Ig)
Una proteina a forma di
Y secreta nel sangue in
risposta ad uno
specifico antigene,
come un batterio o un
virus, che neutralizza
l’antigene legandosi
specificamente ed esso
e producendo una
risposta immunitaria.
Anticorpi policlonali
Produzione
Immunizzazione ripetuta dell’animale con
l’antigene (peptide, proteina purificata o
ricombinante)
Il sangue e’ prelevato nel momento di picco di
produzione dell’anticorpo ed e’ purificato il
siero
Il “pool” degli anticorpi riconosce molti epitopi
dell’antigene usato per l’immunizzazione
Anticorpi monoclonali
Riconoscono solo
un epitopo
Western blot: quarta fase
incubazione con anticorpo primario
5
Western blot: quinta fase
Incubazione con anticorpo secondario
Anticorpi
Anticorpo primario
Riconosce la
proteina
Anticorpo secondario
Lega l’anticorpo primario
Generalmente prodotto in
una specie diversa
Coniugato con un enzima
Il substrato dell’enzima
sara’ convertito in un
prodotto colorato
Puo’ anche essere
radioattivo o fluorescente
Western blot: quinta fase
Incubazione con anticorpo secondario
6
Western blot: sesta fase
rivelazione o “detection”
Fosfatasi alcalina (AP) o perossidasi del
rafano (HRP: horseradish peroxidase)
Conversione di un substrato colorimetrico in un
precipitato colorato
Substrati Chemioluminescenti
Emettono luce se convertiti dall’enzima
Possono essere visualizzati su lastre radiografiche
Marcatura radioattiva
Anticorpi secondarii biotinilati
Western blot
HRP
Anticorpo primario
substrato
HRP
Anticorpo secondario
luce
Rivelazione
Il substrato metabolizzato dalla perossidasi (HRP) emette luce
pg proteina