Se il corpo indotto ha l'estremità più lontana dal corpo inducente collegata a terra mediante un filo
conduttore, il corpo, il filo e la Terra stessa vengono a costituire un unico conduttore di cui il corpo indotto
rappresenta un'estremità: è giusto pertanto che esso sia carico tutto dello stesso segno e precisamente del
segno opposto a quello del corpo inducente. Se il corpo inducente è positivo, vengono richiamati elettroni
dalla Terra che, in linea del tutto teorica (data la sua enorme superficie rispetto a quella del corpo indotto), si
carica positivamente; se il corpo inducente è negativo, gli elettroni di conduzione del corpo indotto vengono
ceduti alla Terra che, sempre in linea teorica, si carica negativamente.
Se ora, in presenza del corpo inducente, si interrompe il collegamento a terra del corpo indotto, esso resta
carico, anche se il corpo inducente viene successivamente allontanato, perché non vi è più la possibilità di
ridistribuzione degli elettroni scambiati con la Terra: si ha pertanto il fenomeno della separazione delle
cariche elettriche.
Scaricare o mettere a terra un corpo significa:
-se esso è carico negativamente, eliminare gli elettroni in eccesso;
-se esso è carico positivamente, comunicargli gli elettroni mancanti.
Il diverso comportamento elettrico delle singole sostanze dipende, tra l'altro, dalle diverse forze con cui i
nuclei (positivi) attirano lo sciame elettronico (negativo) che orbita loro intorno; precisamente:
-negli isolanti gli elettroni sono tutti vincolati alle loro orbite da forze notevoli e quindi hanno una
limitata libertà di movimento: si dice che tutti gli elettroni sono vincolati;
-nei conduttori, invece, gli elettroni dell'orbita più esterna possono muoversi liberamente: si hanno
perciò, oltre agli elettroni vincolati delle orbite più interne, anche degli elettroni liberi, od elettroni
di conduzione.
- Legge di Coulomb
Nel 1785 il fisico francese Charles A. Coulomb stabilì la legge che regola la forza di attrazione e di
repulsione fra due corpi elettricamente carichi.
Egli fece tale determinazione valendosi di una bilancia di torsione,
costituita essenzialmente da due sferette metalliche, di cui una messa
in posizione fissa su di un sostegno isolante e l'altra posta a
un'estremità di una asticciola isolante sospesa per il suo centro ad un
filo sottile (e con un contrappeso all'altro estremo): dalla rotazione
subita dalla asticciola quando le sfere metalliche venivano caricate elettricamente - rotazione letta su di una
scala graduata - era possibile risalire all'entità della forza esercitata tra le due sfere.
7
Effettuando molte esperienze, in corrispondenza di diverse distanze tra le sferette e di diversi valori della
carica elettrica da esse posseduta, il Coulomb stabilì una legge, detta oggi appunto legge di Coulomb, che
ha validità quando i due corpi carichi sono puntiformi o, in pratica, di dimensioni trascurabili rispetto alla
loro distanza.
Tale legge si può enunciare nel modo seguente:
l'intensità della forza che si esercita tra due corpi puntiformi elettricamente carichi è direttamente
proporzionale al prodotto delle cariche Q e q da essi possedute ed è inversamente proporzionale al quadrato
della loro distanza r.
F K
Qq
r2
In formula ove k è un coefficiente di proporzionalità che dipende dalle unità di misura scelte e dal mezzo nel
quale si trovano le due cariche.
La direzione della forza è quella della retta congiungente i due corpi, mentre il suo verso è determinato dal
segno delle cariche: se esse sono « omonime » (cioè dello stesso segno) la forza è repulsiva e quindi il suo
verso è tale da fare allontanare i due corpi; se esse sono "eteronime" (cioè di segno contrario) la forza è
invece attrattiva e quindi deve avere verso tale da fare avvicinare i due corpi.
In pratica la formula fornirà per l'intensità F della forza un valore positivo quando la forza è repulsiva e
invece un valore negativo quando la forza è attrattiva.
Unità di misura della carica elettrica
Nella legge di Coulomb compare un nuovo ente fisico, la carica elettrica, per il quale dobbiamo fissare una
unità di misura.
Nel Sistema Internazionale (SI), attualmente ormai di impiego generale, l'unità elettrica fondamentale non è
però l'unità di carica elettrica, ma l'unità di intensità di corrente elettrica: vedremo in seguito in
Elettrodinamica come si definisce tale unità fondamentale (che prende il nome di ampere) e come da essa
derivi l'unità di carica elettrica, che prende il nome dì coulomb (C).
Per il momento, essendo necessario quantizzare l'unità di carica elettrica testé assunta, diciamo
semplicemente che l'esperienza porta, con riferimento alla legge di Coulomb, a dare la seguente definizione:
la carica elettrica di 1 coulomb è una carica tale che, posta nel vuoto alla distanza di 1 metro da una carica
uguale, la respinge con la forza di 9 x 109 N.
Questo ci consente anche di ricavare dalla il valore del coefficiente k nel vuoto. Infatti nel vuoto si può
porre nella forma:
F0 K 0
Qq
r2
dove il pedice zero indica semplicemente che F. è la forza che si esercita tra due cariche elettriche nel vuoto
e k0 è il valore del coefficiente k nel vuoto.
Dalla si ricava:
8
K 0 910 9 (
Nm
)
C2
e tenendo presente che per Q = q = 1 C ed r = 1 m è F0 = 9 109 N si ha:
Si noti che il coulomb, ossia la quantità di carica elettrica definita in precedenza in modo « operativo »
(ossia mediante un'esperienza) e convenzionalmente adottata quale unità di carica, è ben lungi dall'essere
l'unità « elementare » di carica elettrica, ossia la più piccola carica elettrica esistente.
Questa infatti, come si è visto, è la carica dell'elettrone, il cui valore in coulomb è qe= 1,602 10-19 C
Essa non è stata adottata come unità di carica perché ha valore troppo piccolo rispetto alle cariche con cui
normalmente si ha a che fare e quindi il suo utilizzo risulterebbe poco pratico.
- La costante dielettrica
Ponendo nella
k
1
4
stessa assume la seguente forma:
F
che,
pur
essendo
Qq
4 r 2
1
x
perfettamente
equivalente
alla
precedente, risulta di impiego più pratico, semplificando
molte formule di elettromagnetismo di impiego corrente
La a cui si dà il nome di costante dielettrica assoluta
del mezzo considerato, è un coefficiente che, avendo già
fissato tutte le unità dì misura, dipende solo dal mezzo nel
quale si trovano le due cariche, cioè è appunto una
costante
caratteristica
di
ogni
mezzo
isolante
(o
dielettrico).
Scrivendola relativamente al vuoto, si ha:
F0
1
Qq
4 0 r 2
dove appunto si è indicato con F0 la forza che si esercita
tra due cariche elettriche nel vuoto ed 0 è la costante dielettrica del vuoto.
Il valore di 0 si ricava
0
1
1
C2
12
)
8
,
8510
(
4k 0 4 910 9
Nm 2
9
Poiché tutti i dielettrici hanno una costante dielettrica assoluta maggiore di quella del vuoto, risulta comodo
rapportare tale costante dielettrica assoluta alla costante dielettrica del vuoto; si definisce pertanto una r a
cui si dà il nome di costante dielettrica relativa del mezzo considerato
La formula finale della forza di Coulomb è :
F
1
Qq
4 0 r r 2
Alcuni cenni sulla teoria atomica della materia
Tutti i corpi composti sono costituiti da un'aggregazione discontinua di molecole, che sono le più piccole
particelle in cui si conservano ancora tutte le proprietà di urla sostanza chimicamente definita.
La molecola di un. corpo composto risulta a sua volta costituita dall'intima unione di due o più atomi di
corpi semplici: cioè l'atomo è la più piccola particella dei corpi semplici, o elementi, che interviene nei
processi chimici di formazione della molecola.
Numerosi fatti hanno indotto a ritenere l'atomo ancora scomponibile in particelle elementari, cioè in entità
sub-atomiche le cui proprietà sono molto diverse da quelle macroscopiche della materia.
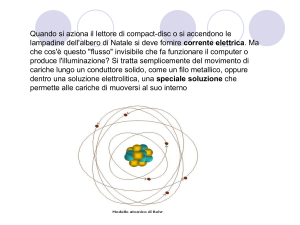
Secondo il modello planetario dell'atomo, ogni atomo è formato da un nucleo centrale piccolissimo, il quale
racchiude praticamente in sé tutta la massa dell'atomo e che è elettricamente carico di segno positivo, attorno
al quale - su opportune orbite, in analogia al moto dei pianeti attorno al Sole - ruotano gli elettroni, particelle
di carica negativa e di massa trascurabile e quindi assimilabili a veri e propri granuli di elettricità pura,
negativa (1).
Il nucleo è a sua volta costituito da due specie di particelle elementari, i protoni e i neutroni:
- i protoni possiedono una carica positiva uguale in grandezza alla carica dell'elettrone e hanno massa pari a
1,00758 amu (unità di massa atomica- atomic mass unit) ;
- i neutroni sono particelle elettricamente neutre, senza carica; la loro massa è pari a 1,00897 amu, cioè è
pressoché uguale a quella dei protoni. Riassumiamo nella seguente tabella le caratteristiche delle particelle
elementari che costituiscono l'atomo.
Per un dato elemento, il numero dei protoni presenti nel nucleo atomico è chiamato il numero atomico
dell'elemento e viene rappresentato con il simbolo Z. Si noti che tale numero rappresenta anche il numero
degli elettroni che circondano il nucleo di un atomo elettricamente neutro (3) : quindi, poiché le proprietà
chimiche dipendono dal numero di questi elettroni, è proprio il numero atomico che determina la natura
chimica di un elemento.
10
Tale numero atomico per l'appunto si identifica con il numero d'ordine dell'elemento nella tavola periodica
degli elementi (o tavola di Mendeleieff): il numero
atomico dell'idrogeno è 1, dell'elio 2, del litio 3 e così
via fino a 92 per l'uranio, l'elemento naturale di numero
atomico più elevato.
In natura esistono 92 elementi chimici (oltre ad un
certo numero di elementi di numero atomico maggiore
creati artificialmente); la differenza qualitativa tra questi
elementi chimici si riconduce ad una differenza fra la
quantità delle particelle elementari che costituiscono il loro atomo: si hanno quindi 92 atomi diversi fra di
loro.
Riportiamo in fig. i modelli atomici degli atomi dell'idrogeno, dell'elio e del sodio.
Se un atomo è elettricamente neutro, le cariche del nucleo (positive) compensano quelle degli elettroni
(negative) e quindi non si manifestano in alcun modo le proprietà specifiche delle particelle elementari che lo
costituiscono.
Se però l'atomo, per un qualche motivo, perde od acquista uno o più degli elettroni del l'orbita più esterna del
suo edificio atomico, non si presenta più elettricamente neutro, perché si è rotto l'equilibrio elettrico tra
protoni ed elettroni.
Precisamente:
-se ha perduto degli elettroni, esso rivela una carica elettrica positiva pari a tante cariche e elementari quanto
è il numero degli elettroni che ha perduto: in tali condizioni si dice che l'atomo si è ionizzato, cioè è diventato
uno ione positivo (monovalente, bivalente, trivalente o tetravalente, a seconda che abbia perso
rispettivamente 1, 2, 3 o 4 elettroni dell'orbita più esterna);
- se ha acquistato degli elettroni, esso rivela una carica elettrica negativa pari a tante cariche e elementari
quanto è il numero degli elettroni che ha acquistato: in tali condizioni sì dice che l'atomo è diventato uno
ione negativo (monovalente, bivalente, trivalente o tetravalente, a seconda che abbia acquistato
rispettivamente 1, 2, 3 o 4 elettroni nella sua orbita più esterna).
Si noti che la perdita o l'acquisto di questi elettroni, cioè la formazione dello ione, non altera la natura
chimica dell'atomo: l'atomo elettricamente neutro torna a formarsi non appena lo ione, se positivo, riacquista
gli elettroni perduti, oppure se negativo, espelle gli elettroni acquistati.
Hanno tendenza a perdere elettroni, cioè a trasformarsi in ioni positivi, l'atomo di idrogeno e gli atomi dei
metallí, mentre hanno la tendenza opposta, cioè ad acquistare elettroni e a trasformarsi in ioni negativi, gli
atomi dei metalloidi e quei particolari gruppi atomici che costituiscono i radicali acidi.
E chiaro che quando due ioni di segno contrario e di uguale valenza si trovano l'uno in presenza dell'altro, si
attirano e si legano stabilmente formando una molecola composta elettricamente neutra.
11