Le proprietà periodiche
degli elementi
1
2
1
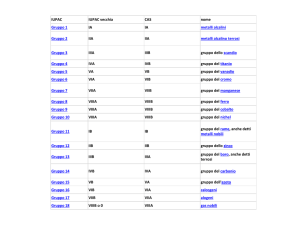
Numerazione gruppi IUPAC
Numero atomico
Simbolo
1s
Metallo
Semimetallo
Non metallo
2s2p
Peso atomico
3s3p
4s3d4p
5s4d5p
6s4f5d6p
7s5f6d7p
3
Numerazione gruppi tradizionale, n° coincide con gli
elettroni esterni degli elementi o elettroni di valenza
I
II
III IV
0
V
VI VII
4
2
Moseley ha ordinato gli elementi secondo valori crescenti del
numero atomico (Z) TAVOLA PERIODICA.
File orizzontali PERIODI
File verticali GRUPPI
Gli elementi appartenenti allo stesso gruppo hanno strutture
elettroniche simili e comportamento chimico simile. Tutto ciò fa
ritenere che le proprietà degli elementi chimici dipendano dagli
elettroni più esterni (detti elettroni di valenza).
1° periodo piccolissimo periodo
2° e 3° periodo periodi corti o piccoli
4° e 5° periodo lunghi periodi
6° periodo lunghissimo periodo
7° periodo incompleto
5
Classificazione periodica degli elementi
Blocco p (np6)
Blocco s (ns2)
Blocco d ((n-1)d10)
Blocco f ((n-2)f14)
6
3
Le proprietà periodiche
1. Carica nucleare efficace (Zeff o Z*)
2. Dimensioni atomiche
3. Energia di ionizzazione
4. Affinità elettronica
5. Elettronegatività
6. Carattere metallico
7
Carica nucleare efficace
In un atomo polielettronico gli elettroni più interni esplicano una
azione di “schermo” per cui un elettrone risente di una carica Zeff,
detta carica nucleare efficace, minore di Z.
Li
-
3+
Li: 3 eZ=3
Zeff = 1,30
-
8
4
Be
Li
-
3+ -
-
-
4+ -
-
-
se gli e– sono nello stesso tipo di
orbitale non si schermano fra loro in
modo efficace
se gli e– sono interni e
vicini al nucleo sono molto
schermanti
Lungo un periodo la carica nucleare aumenta
9
Orbitali di tipo diverso (s, p, d, f, ecc.), appartenenti allo stesso livello
n, penetrano verso il nucleo in maniera diversa. La capacità di
penetrazione varia nell’ordine:
s>p>d>f
Gusci interni
Na 1s2 2s2 2p6 3s1
Na: 11 eZ = 11
Zeff = 2,20
Zeff risulta tanto minore quanto minore è la penetrazione del relativo
orbitale.
L’elettrone è energeticamente meno legato al nucleo quanto minore è
Zeff e al relativo orbitale corrisponderà una energia maggiore.
10
5
Proprietà periodiche: CARICA NUCLEARE EFFICACE, Zeff
Ne
Kr
Ar
Xe
Periodo
He
Gruppo
H Li
Na
K
Rb
Cs
11
RAGGIO ATOMICO
Raggio atomico covalente (es. molecola
biatomica Cl2). E’ la metà della distanza
internucleare tra due atomi uguali.
r=d/2=99 pm
Raggio atomico metallico (es. cristallo metallico Al). Viene definito
come la metà della distanza internucleare tra gli atomi più vicini nel
reticolo cristallino.
12
6
Proprietà periodiche: RAGGIO ATOMICO lungo un gruppo
Aumenta n
Aumenta rA
13
Proprietà periodiche: RAGGIO ATOMICO
Periodo
Zeff ↑
Gruppo
n↑
14
7
Proprietà periodiche: RAGGIO ATOMICO
Gruppo
Periodo
1
2
3
4
5
6
7
8
Raggio
atomico
(pm)
15
Ionizzazione: effetto sulle dimensioni
atomiche
16
8
L’energia di ionizzazione
L’energia di prima ionizzazione è l’energia necessaria per
togliere l’elettrone più esterno ad un atomo neutro e isolato.
E 'ion
X ( g ) ""
"# X (+g ) + e !
1a
ionizzazione
''
E ion
X + ( g ) ""
"# X (2g+) + e !
2a ionizzazione
+
X2
(g)
'''
+
−
ion →
E
X (3g ) + e
Per togliere un elettrone ad
un atomo bisogna sempre
fornire
energia;
la
ionizzazione è un processo
endotermico.
L’atomo neutro costituisce
sempre una situazione di
minore energia rispetto
allo ione positivo + 1
elettrone.
3a ionizzazione
17
L’energia di ionizzazione
0
E3s
Na(g) + 5.14 eV → Na+(g) + e-
E2p
E2s
18
9
Proprietà periodiche: ENERGIA di 1° IONIZZAZIONE
Periodo
Zeff ↑
Gruppo
n,rA↑
19
Proprietà periodiche: ENERGIA di IONIZZAZIONE
Ne [He]2s22p6
F [He]2s22p5
O [He]2s22p4
N [He]2s22p3
C [He]2s22p2
B [He]2s22p1
Be [He]2s2
Li [He]2s1
20
10
Proprietà periodiche: ENERGIA di 1° IONIZZAZIONE
Gruppo
Periodo
Energia
ionizzazione
(kJ mol-1)
21
Proprietà periodiche: ENERGIA di IONIZZAZIONE
Na(g) + 5.14 eV → Na+(g) + eNa+(g) + 47.3 eV → Na2+(g) + e-
E3s
Energia di 1°
ionizzazione
Energia di 2°
ionizzazione
E2p
E2s
22
11
L’energia di 1a ionizzazione e superiori
25000
1a ionizz.
20000
2a ionizz.
15000
3a ionizz.
10000
4a ionizz
5000
0
Li
Na
K
Be Mg
Ca
B
Al
E’ion < E’’ion < E’’’ion <…ecc.
23
L’affinità elettronica
L’affinità elettronica è l’energia in gioco nella formazione di uno
ione negativo da parte di un atomo neutro ed isolato.
Viene anche definita come l’energia di legame tra l’elettrone
aggiunto e l’atomo.
X ( g ) + e# !
!" X (#g ) + E 1AE
EAE 1° ordine < O Processo esotermico
2
X #( g ) + e# !
!" X (2g#) + E AE
EAE 2° ordine > O Processo endotermico
24
12
Proprietà periodiche: AFFINITÀ ELETTRONICA
Ea.e.
(KJ/mol)
I
1
II
III IV V
VI VII
H
-73
Periodo 2
Zeff ↑
3
4
Li Be B
C
N
O
F
-60
-122
7
-141
-328
18
-27
Na Mg Al Si P
S
Cl
-53
21
-200
-349
K
Ca Ga Ge As Se Br
-48
-2
-43
-29
-134
-120
-72
-78
-195
-325
Gruppo r ↑
A
25
Proprietà periodiche: ELETTRONEGATIVITA’
Elettronegatività: tendenza di un atomo ad attrarre a sé
elettroni quando forma legami con altri atomi.
L’elettronegatività è una proprietà relativa.
Gruppo
Zeff cost
rA ↑
Periodo
Zeff ↑
rA ↓
26
13
Proprietà periodiche:
ELETTRONEGATIVITA’
8
4
5
6
7
Elementi elettropositivi
3
4
Elementi
elettronegativi
27
METALLI
NON METALLI
Buoni conduttori elettrici
Scarsi conduttori elettrici
Duttili
Non duttili
Malleabili
Non malleabili
Solidi, alto punto di fusione
Solidi, liquidi, gassosi
Buoni conduttori termici
Cattivi conduttori termici
Deboli forze attrattive tra nucleo ed Forti forze attrattive tra nucleo ed
elettroni esterni
elettroni esterni
Reagiscono con gli acidi
Non reagiscono con gli acidi
Danno ossidi basici
Danno ossidi acidi
Formano cationi
Formano anioni
Formano alogenuri ionici
Formano alogenuri covalenti
28
14
Proprietà periodiche: CARATTERE METALLICO
Conducibilità elettrica bassa ma non nulla
Proprietà intermedie fra metalli e non metalli
29
aumenta
aumenta
aumenta
Energia di ionizzazione
Affinità elettronica
Elettronegatività
aumenta
Raggio atomico
30
Carattere metallico
15