Liceo Scientifico “Giordano Bruno”
Venezia-Mestre
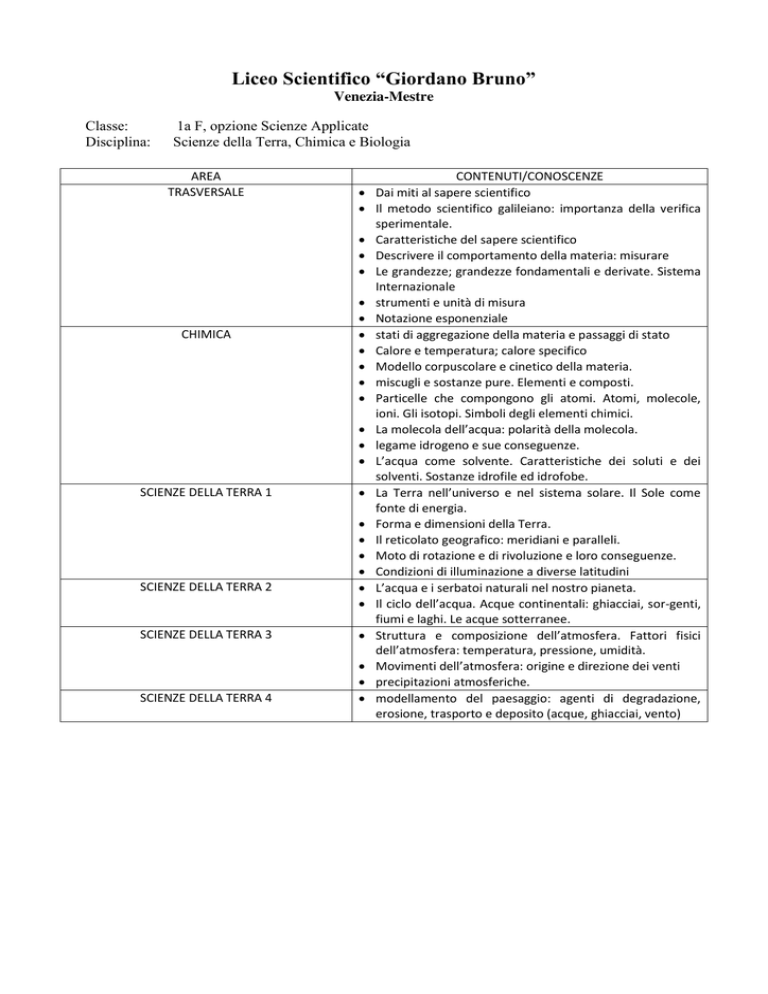
Classe:
Disciplina:
1a F, opzione Scienze Applicate
Scienze della Terra, Chimica e Biologia
AREA
TRASVERSALE
CHIMICA
SCIENZE DELLA TERRA 1
SCIENZE DELLA TERRA 2
SCIENZE DELLA TERRA 3
SCIENZE DELLA TERRA 4
CONTENUTI/CONOSCENZE
Dai miti al sapere scientifico
Il metodo scientifico galileiano: importanza della verifica
sperimentale.
Caratteristiche del sapere scientifico
Descrivere il comportamento della materia: misurare
Le grandezze; grandezze fondamentali e derivate. Sistema
Internazionale
strumenti e unità di misura
Notazione esponenziale
stati di aggregazione della materia e passaggi di stato
Calore e temperatura; calore specifico
Modello corpuscolare e cinetico della materia.
miscugli e sostanze pure. Elementi e composti.
Particelle che compongono gli atomi. Atomi, molecole,
ioni. Gli isotopi. Simboli degli elementi chimici.
La molecola dell’acqua: polarità della molecola.
legame idrogeno e sue conseguenze.
L’acqua come solvente. Caratteristiche dei soluti e dei
solventi. Sostanze idrofile ed idrofobe.
La Terra nell’universo e nel sistema solare. Il Sole come
fonte di energia.
Forma e dimensioni della Terra.
Il reticolato geografico: meridiani e paralleli.
Moto di rotazione e di rivoluzione e loro conseguenze.
Condizioni di illuminazione a diverse latitudini
L’acqua e i serbatoi naturali nel nostro pianeta. Il ciclo dell’acqua. Acque continentali: ghiacciai, sor-genti,
fiumi e laghi. Le acque sotterranee.
Struttura e composizione dell’atmosfera. Fattori fisici dell’atmosfera: temperatura, pressione, umidità.
Movimenti dell’atmosfera: origine e direzione dei venti
precipitazioni atmosferiche.
modellamento del paesaggio: agenti di degradazione,
erosione, trasporto e deposito (acque, ghiacciai, vento)
Liceo Scientifico “Giordano Bruno”
Venezia-Mestre
Classe:
Disciplina:
2a C, opzione Scienze Applicate
Scienze della Terra, Chimica e Biologia
Programma svolto
CENNI DI ECOLOGIA-l’ambiente e l’ecosistema
fattori biotici e abiotici
Caratteristiche generali dei viventi
conservazione della materia e dell’energia;; energia di-spersa come calore. Ruolo dell’E. solare.
relazioni trofiche. Predazione, commensalismo, parassitismo. Competizione
Piramidi (produttori, consumatori, decompositori) alimentari, legge del 10%
principali cicli biogeochimici
BIOLOGIA 1-Dalla formazione della Terra all’evoluzione chimica.
Esperienza di Miller. Prime cellule.
Procarioti ed eucarioti. Struttura della cellula eucariote: membrana, nucleo e citoplasma
BIOLOGIA 2-La Biodiversità:
l’evoluzione dei viventi, fissismo ed evoluzionismo Cenni sulle teorie evolutive: Lamarck e
Darwin)
La biodiversità: classificazione dei viventi in domini e regni.
Classificazione in 5 regni: monere, protisti, funghi, piante, animali.
Cicli vitali e alternanza di generazione nelle alghe, nei muschi e nelle felci
Criteri per la classificazione delle monere. Ciclo vitale delle monere. Importanza delle monere
Protisti tipo-animale: protozoi. Flagellati, ciliati, sarcodini e sporozoi
Protisti tipo-pianta: le alghe unicellulari (euglenodini, crisofite (diatomee), dinoflagellati), alghe
rosse, brune e verdi.
Protisti tipo-fungo
Regno delle piante: passaggio alle terre emerse. Briofite: i muschi. Le prime tracheofite: le felci.
Gimnosperme e angiosperme.
Regno dei funghi. Ife, micelio e corpo fruttifero.
Regno degli animali: protisti, cnidari, platelminti, nematodi, anellidi, moluschi,
CHIMICA 1
Gli elementi chimici e la loro classificazione
il sistema pe-riodico secondo Mendeleev
la moderna tavola periodica.
CHIMICA 2-le leggi massali
Leggi di Lavoisier, Proust, Dalton, Avogadro
confronto tra l’ipotesi atomica di Dalton e di molecola di Avogadro. Le equazioni chimiche: come si scrivono, come si leggono, come si bilanciano.
CHIMICA 3
Masse atomiche
unità di massa atomica
Masse molecolari, la mole e la massa molare.
CHIMICA 4
Cenni sulla struttura atomica e sui legami chimici.
CHIMICA 5
Le soluzioni e le loro concentrazioni
Conc.% m/m, m/vol, vol/vol.
Molarità.
BIOLOGIA 3-Le molecole dei viventi:
l’acqua e le biomolecole. Dai monomeri ai polimeri e viceversa (reazioni di condensazione e di
idrolisi).
Glucidi (mono-di-polisaccaridi), lipidi (acidi grassi, gliceridi, fosfolipidi), amminoacidi e
proteine, nucleotidi e acidi nucleici (principali differenze fra DNA e RNA).
Liceo Scientifico Statale “G. Bruno”
Venezia - Mestre
Classe
Insegnamento
Anno Scolastico
:III^ F – Sperimentazione Parziale di Scienze Naturali
:Chimica
:2011/2012
Programma Svolto
ARGOMENTO
Sistema internazionale. Massa. Peso.
Densità. Energia. Ek. Ep. Calore e temperatura
Stati fisici. Materia: sostanze pure, miscugli, composti.
Passaggi di stato. Trasformaz. fisiche e chimiche. Elementi
Leggi massali: Lavoisier, Proust, proporzioni multiple
Teoria atomica di Dalton
Massa atomica, massa molecolare, mole
Natura elettrica della materia. Particelle fondamentali.
Modelli di Thomson e Rutherford. Z. MA. Isotopi
Bohr. Modello a gusci e struttura
Modello a orbitali. Numeri quantici.
Configurazione elettronica. Ordine di riempimento. Ei.
Proprietà ricorrenti. Tavola periodica
Proprietà periodiche: Ei, Ae, EN, Volume
Metalli, non metalli, semimetalli.
Teoria del legame di valenza. Ibridizzazione.
Forma delle molecole. Molecole polari e non.
Composti ionici e molecolari. Valenza e nox
Classificazione dei composti binari: sali e ossidi basici
Composti binari: ossidi acidi, idruri, idracidi
Classificazione dei composti ternari: idrossidi
Composti ternari: acidi e sali
Nomenclatura tradizionale
Bilanciamento delle reazioni chimiche. Stechiometria
Formule chimiche: le formule minime, comp. %
Lo stato gassoso: la pressione
Chimica pneumatica: Boyle, Gay-Lussac e Charles
Volume molare dei gas. Equazione di stato dei gas perfetti
Proprietà delle soluzioni.Espressione delle concentrazione.
Soluzioni sature. Solubilità e T. Solubilizzazione.
Velocità di reazione e teoria degli urti
Catalizzatori. Fattori che influenzano la V di reazione
Equilibrio chimico. Reazioni reversibili.
Costante di equilibrio. Keq e T
Le Chatelier
Equilibrio di solubilità
Arrhenius, Bronsted-Lowry: acidi e basi
Acidi e basi secondo Lewis. Ionizzazione dell’acqua
PH. Indicatori. Costanti di ionizzazione.
Neutralizzazione
Venezia-Mestre, 7 giugno 2012
Liceo Scientifico Statale “G. Bruno”
Venezia - Mestre
Classe
Corso
Anno Scolastico
:IV^ F – Sperimentazione Parziale di Scienze Naturali
:Chimica-biologia
:2011/2012
Programma svolto
REAZIONI REDOX E PROCESSI ELETTROCHIMICI. Reazioni redox: ossidazione,
riduzione;; bilanciamento. Dall’E. chimica all’E. elettrica. Redox spontanee: tendenza alla riduzione. Celle elettrochimiche: pila Daniell. Elettrodo ad H. Potenziali standard di riduzione.
Elettrolisi (generalità), elettrolisi di NaCl fuso e in sol. acquosa. Elettrolisi dell’acqua
REAZIONI CHIMICHE E TERMODINAMICA. Reazioni endotermiche e esotermiche. Calore,
lavoro, energia interna: primo principio. Entalpia di formazione. Legge di Hess. Entropia e secondo
principio. Energia libera di Gibbs. Forza guida delle reazioni chimiche.
CENNI SULLA CHIMICA DEL CARBONIO: Le ibridizzazioni del carbonio. I legami del
carbonio. Gli idrocarburi alifatici: alcani, isomeria ottica, isomeria di posizione, isomeria cis-trans.
Cicloalcani. Idrocarburi aromatici: il concetto di risonanza. Nomenclatura IUPAC. Gli alcheni e gli
alchini (cenni).
RICHIAMO SULLE MOLECOLE DI INTERESSE BIOLOGICO. I gruppi funzionali.
Glucidi: mono-di-polisaccaridi; funzioni ed esempi (glucosio, saccarosio, amidi, cellulosa,
glicogeno). Lipidi: struttura di grassi e oli; glicerolo e acidi grassi, composti saturi e insaturi,
fosfolipidi. Protidi: struttura di base degli amminoacidi; a. a. acidi, basici, polari, non polari.
Legame peptidico, strutture delle proteine (1^, 2^, 3^, 4^).
ENERGETICA. L’ATP. La produzione di ATP. Glicolisi, ciclo di Krebs, catena di trasporto elettronico, modello chemiosmotico. Vie anaerobiche: fermentazione alcolica e fermentazione
lattica. Fotosintesi: fattori interessati alla fotosintesi, organi della fotosintesi, chimica della
fotosintesi. Cattura della luce, trasporto elettronico, riduzione della CO2.
IL CORPO DELL’UOMO
Cellule, tessuti, organi e apparati: organizzazione del corpo umano.
L’ambiente esterno e l’ambiente interno: omeostasi. Funzioni: nutrizione, respirazione, trasporto,
comunicazione umorale e nervosa, difesa immunitaria, sostegno e movimento, riproduzione
TESSUTO EPITELIALE:
Aspetto degli epiteli;; classificazione degli epiteli in funzione dell’aspetto delle cellule e della stratificazione. Funzioni degli epiteli; ghiandole esocrine.
TESSUTO CONNETTIVO:
Funzioni. Cellule e matrice extracellulare. Connettivo, lasso e fibroso. Connettivo osseo e
cartilagineo, il sangue.
TESSUTO MUSCOLARE:
Funzioni. Tessuto muscolare liscio e sue caratteristiche, tessuto muscolare striato e sue
caratteristiche, tessuto muscolare cardiaco e sue caratteristiche.
TESSTUTO NERVOSO:
Neuroni e glia. Varie forme di neuroni: dendriti, corpo cellulare e assone. Verso dell’impulso nervoso. Organizzazione del sistema nervoso: sistema nervoso centrale e periferico, sistema nervoso
autonomo.
SOSTEGNO:
Tessuto osseo in dettaglio: osteoni, osteociti, canali di Havers, tessuto osseo spugnoso e compatto.
Scheletro umano assile e appendicolare. Articolazioni, legamenti e tendini..Ossa: ossa lunghe, piatte
e brevi. Epifisi e diafisi. Articolazioni.
NUTRIZIONE:
L’apparato digerente umano. Bocca, faringe, esofago, stomaco e controllo della secrezione gastrica;
le parti dell’intestino tenue e il controllo della secrezione intestinale; ghiandole annesse: fegato e
secrezione biliare, pancreas e secrezione esocrina pancreatica. Ileo: struttura; pieghe, villi,
microvilli. Struttura interna dei villi intestinali. assorbimento e assimilazione, crasso.
TRASPORTO NEI MAMMIFERI. Sangue: plasma ed elementi figurati. Eritrociti: trasporto di
O2 e CO2. Circolazione nei mammiferi. Evoluzione del cuore nei vertebrati. Anatomia del cuore,
battito cardiaco. Arterie, vene e capillari.










