LE LEGGI DEI GAS
Prof. Michele Barcellona
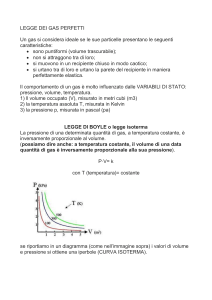
STATO DI UN GAS
Lo stato di un gas dipende dalle
seguenti grandezze:
Massa (in moli)
Volume V
Pressione P
Temperatura T
LE TRASFORMAZIONI DI UN GAS
La modifica di uno dei parametri precedenti provoca una:
TRASFORMAZIONE
=
passaggio
STATO INIZIALE
STATO FINALE
DIAGRAMMI DI STATO
Le tre grandezze:
non sono indipendenti
Pressione, Volume e Temperatura
Esse sono legate tra loro da una equazione detta EQUAZIONE DI STATO
Lo Stato di un gas può dunque essere rappresentato indicando
solo due grandezze
Esempio : DIAGRAMMA P-V
LE LEGGI DEI GAS
La prima legge di Gay-Lussac
A pressione costante il volume di un gas è direttamente
proporzionale alla temperatura
Per mantenere costante la pressione mettiamo dei pesetti sul
pistone
Per aumentare la temperatura forniamo energia sotto forma di
calore
La prima legge di Gay-Lussac
A pressione costante il volume di un gas è direttamente
proporzionale alla temperatura
ISOBARA
La costante α
La prima legge di Gay-Lussac vale soltanto se il gas non è troppo
compresso e quando la sua temperatura è lontana da quella di
liquefazione
In queste condizioni la costante α non varia da sostanza a
sostanza ma ha lo stesso valore per tutti i gas
La prima legge di Gay-Lussac e la temperatura assoluta
Utilizzando la temperatura assoluta T invece della
temperatura in Celsius, la prima legge di Gay-Lussac assume la
forma:
Il volume di un gas è quindi direttamente
proporzionale alla sua temperatura assoluta
Animazione
pag 308
filmato
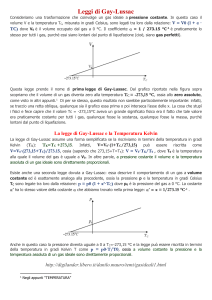
La legge di Boyle
A temperatura costante il prodotto del volume occupato da
un gas per la sua pressione è costante
Per mantenere costante la temperatura immergiamo il cilindro
contenente il gas in un recipiente d’acqua
Per aumentare la pressione aggiungiamo pesetti al pistone
La legge di Boyle
A temperatura costante il prodotto del volume occupato da
un gas per la sua pressione è costante
ISOTERMA
La seconda legge di Gay-Lussac
A volume costante la pressione di un gas è direttamente
proporzionale alla temperatura
Per mantenere costante il volume aggiungiamo dei pesetti aumentando la pressione
Per aumentare la temperatura forniamo energia sotto forma di calore
La seconda legge di Gay-Lussac
A volume costante la pressione di un gas è direttamente
proporzionale alla temperatura
ISOCORA
La seconda legge di Gay-Lussac e la temperatura assoluta
Utilizzando la temperatura assoluta T invece della temperatura in
Celsius, la seconda legge di Gay-Lussac assume la forma:
La pressione di un gas è quindi direttamente proporzionale
alla sua temperatura assoluta
IL GAS PERFETTO
La legge di Boyle e le due leggi di Gay- Lussac descrivono in modo corretto il
comportamento di qualunque tipo di gas se sono soddisfatte due condizioni:
il gas è piuttosto rarefatto
La sua temperatura è molto maggiore a quella di liquefazione
Un gas di questo tipo si chiama gas
perfetto
In queste condizioni le tre leggi possono essere sintetizzate in un’unica
relazione:
Equazione di stato del gas
perfetto
DALL’ EQUAZIONE DI STATO DEL GAS PERFETTO
ALLE TRE LEGGI DEI GAS
LA MOLE ED IL NUMERO DI AVOGADRO
Il NUMERO DI AVOGADRO è il numero di molecole contenute in una
quantità di sostanza che ha una massa in grammi pari al suo peso
atomico o molecolare
Esempio:
L’elio (He) ha peso atomico 4,00 u. il numero di molecole in 4,00 grammi
di He è:
L’Ossigeno (O) ha peso atomico 16,00 u., il numero di molecole in 16,00
grammi di O è:
LA MOLE ED IL NUMERO DI AVOGADRO
Sulla base del NUMERO DI AVOGADRO è definita la mole che è l’unità di
misura della quantità di sostanza nel S-I-
Gli esperimenti di Avogadro mostrarono che il volume occupato da un
gas è proporzionale al N di particelle che lo compongono cioè al numero
n di moli.
con
ricavato
sperimentalmente
EQUAZIONE DI STATO DEI GAS
PERFETTI
EQUAZIONE DI STATO DEI GAS
PERFETTI