Leggi dei gas
Dal momento che la pressione esercitata da un volume di gas, ad una certa temperatura, è
proporzionale al numero delle particelle che lo compongono (ovvero dal numero delle sue
molecole!), nel contesto della teoria cinetica dei gas (calcolo cinetico della pressione), è naturale
pensare che, indipendentemente dalla natura del gas (ovvero dal tipo di elemento), volumi eguali di
gas diversi contengano lo stesso numero di atomi. Si arriva così alla
Legge di Avogadro:
volumi uguali di gas diversi, nelle stesse condizioni di temperatura e pressione, contengono lo
stesso numero di molecole
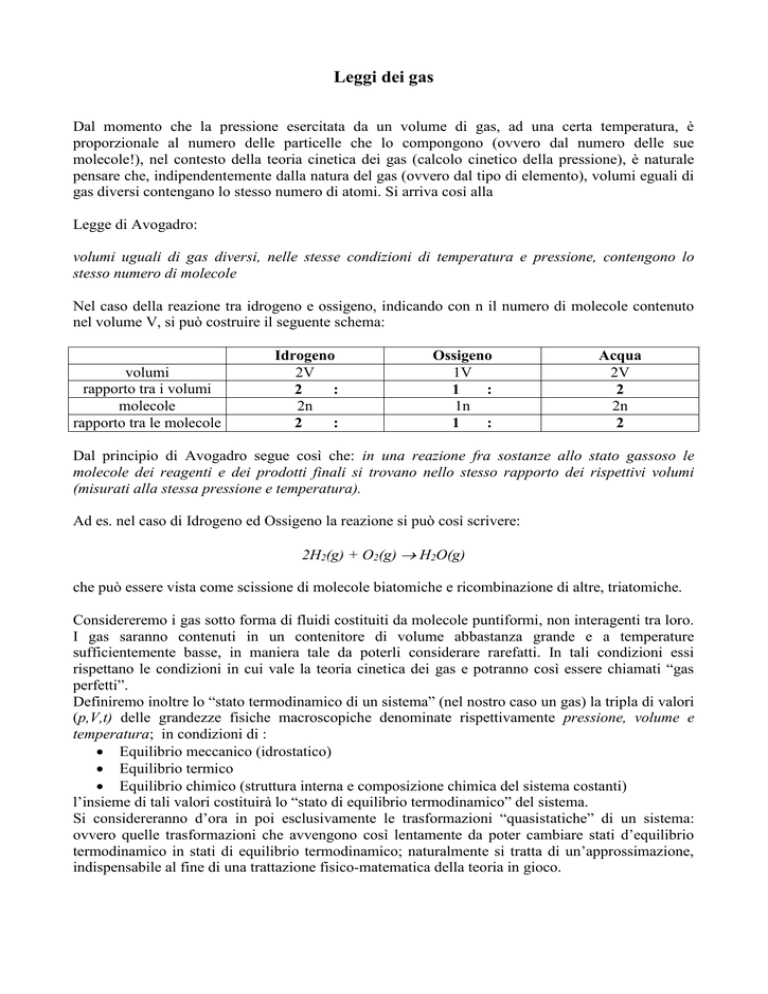
Nel caso della reazione tra idrogeno e ossigeno, indicando con n il numero di molecole contenuto
nel volume V, si può costruire il seguente schema:
volumi
rapporto tra i volumi
molecole
rapporto tra le molecole
Idrogeno
2V
2
:
2n
2
:
Ossigeno
1V
1
:
1n
1
:
Acqua
2V
2
2n
2
Dal principio di Avogadro segue così che: in una reazione fra sostanze allo stato gassoso le
molecole dei reagenti e dei prodotti finali si trovano nello stesso rapporto dei rispettivi volumi
(misurati alla stessa pressione e temperatura).
Ad es. nel caso di Idrogeno ed Ossigeno la reazione si può così scrivere:
2H2(g) + O2(g) H2O(g)
che può essere vista come scissione di molecole biatomiche e ricombinazione di altre, triatomiche.
Considereremo i gas sotto forma di fluidi costituiti da molecole puntiformi, non interagenti tra loro.
I gas saranno contenuti in un contenitore di volume abbastanza grande e a temperature
sufficientemente basse, in maniera tale da poterli considerare rarefatti. In tali condizioni essi
rispettano le condizioni in cui vale la teoria cinetica dei gas e potranno così essere chiamati “gas
perfetti”.
Definiremo inoltre lo “stato termodinamico di un sistema” (nel nostro caso un gas) la tripla di valori
(p,V,t) delle grandezze fisiche macroscopiche denominate rispettivamente pressione, volume e
temperatura; in condizioni di :
Equilibrio meccanico (idrostatico)
Equilibrio termico
Equilibrio chimico (struttura interna e composizione chimica del sistema costanti)
l’insieme di tali valori costituirà lo “stato di equilibrio termodinamico” del sistema.
Si considereranno d’ora in poi esclusivamente le trasformazioni “quasistatiche” di un sistema:
ovvero quelle trasformazioni che avvengono così lentamente da poter cambiare stati d’equilibrio
termodinamico in stati di equilibrio termodinamico; naturalmente si tratta di un’approssimazione,
indispensabile al fine di una trattazione fisico-matematica della teoria in gioco.
Consideriamo ora un gas contenuto in un recipiente cilindrico dotato di un pistone scorrevole,
inizialmente di volume V0 ad una temperatura iniziale t0 ed a una pressione costante p. Se
sottoponiamo il gas ad un riscaldamento fino ad alzare la sua temperatura al valore t > t0 , il suo
volume aumenterà secondo la seguente legge:
V V0 1 t
Iª Legge di Gay-Lussac
con t = t – t0 ed = 1/(273 C) costante dimensionale
Nel caso particolare in cui la temperatura iniziale sia t0 = 0 ºC , t = t e si può rappresentare
graficamente tale legge nella seguente forma:
V
1 t
V0
V
V0
Dal punto di vista matematico, si tratta dell’
1
0
t
1
equazione di una retta di coefficiente
angolare .
La fisica impone però delle condizioni
aggiuntive:
1. il coeff. angolare, come già indicato,
deve avere le dimensioni dell’inverso
di una temperatura; infatti la quantità
a primo membro, essendo il rapporto tra
grandezze fisiche omogenee è un numero
puro e dunque adimensionale;ne consegue
che la quantità a secondo membro 1+·t dev’essere anch’essa dimensionale e dunque lo deve essere
anche il prodotto ·t e perché ciò si verifichi deve essere l’inverso di una temperatura.
2. La retta interseca l’asse verticale nel punto (0,1) in corrispondenza del volume iniziale V0 ,
interseca l’asse orizzontale nel punto (-1/,0) in corrispondenza del quale il volume si annulla:
V=0; essa però, a differenza di quanto succede matematicamente, non può scendere al di sotto di
tale punto: infatti in tal caso si avrebbe V < 0, ovvero volumi negativi e dunque privi di significato
fisico. Da ciò ne consegue che, essendo –1/ = - 273C, il gas non può scendere al di sotto di 273
gradi sotto zero.
La trasformazione nel piano (V,t) si dice perciò trasformazione “isobara” in quanto avviene a
pressione costante p.
Ripetiamo ora il medesimo procedimento, tenendo però fissato il volume e facendo variare la
pressione; se riscaldiamo il gas essa si innalzerà da un valore iniziale p0 ad un valore finale p
secondo la seguente legge:
p p0 1 t
IIª Legge di Gay-Lussac
con t = t – t0 ed = 1/(273 C) costante dimensionale
Nel caso particolare in cui la temperatura iniziale sia t0 = 0 ºC , t = t e si può rappresentare
graficamente tale legge nella seguente forma:
p
1 t
p0
p
p0
Valgono le medesime considerazioni fatte
in precedenza con p al posto di V:
in particolare in (0,1) la pressione assume il
valore iniziale p0 e non può scendere al di
sotto di –273 gradi perché in tal caso
sarebbe negativa e non fisica.
1
0
t
1
La trasformazione nel piano (p,t) si dice perciò “isocora” in quanto avviene a volume costante.
In seguito si vedrà che il gas, oltre a non poter scendere al di sotto di –273 gradi non potrà neanche
raggiungere tale valore: per ora viene considerato idealmente raggiungibile solo perché si sta
considerando un gas puntiforme.
Le precedenti leggi studiate, suggeriscono l’adozione di una diversa scala di temperature che
consenta una rappresentazione matematica più semplice delle medesime. Sostituendo il valore di
nella prima legge di Gay-Lussac si può scrivere:
t
t 273
V V0 1
V0
V0 t 273
273
273
per semplificare si può considerare la scala di temperature “assoluta” definita a partire dalla scala
centigrada :
T = t+273
In modo tale che le leggi di Gay-Lussac possano essere rappresentate in questo modo:
V V0 T
e
P P0 T
tale temperatura si misura in gradi Kelvin: K ed il suo zero si dice “zero assoluto” e non può, per
le ragioni già scritte, essere mai raggiunto.
Possiamo infine enunciare la legge di trasformazione di un gas a temperatura costante:
p
p V k cos t
Legge di Boyle
T = cost
V
0
Si tratta di una trasformazione del piano (p, V) “isoterma”
in quanto avviene a temperatura fissata; dal punto di vista
matematico tale curva esprime una iperbole equilatera.
Supponiamo ora di voler eseguire la seguente successione di trasformazioni nel piano (p,V) di una
mole di gas a partire dai valori iniziali (p0 , V0 , T0) :
p
1. Trasformazione lungo l’isoterma a T0 = 273 ºK
p0 → p > p0 , ma al crescere della pressione
lungo un’isoterma il volume deve diminuire:
V0 → V0' e dev’essere
p·V0' = k = p0·V0
p
(p,V,T)
2. Trasformazione isobara a temperatura
crescente T0 T > T0 da cui :
p0
T0
V
0
V0'
V = V0'··T = (p0·V0 /p)··T
V0 V
alla fine delle trasformazioni si ottiene : p·V = ·p0·V0·T
Sappiamo infine dalla Legge di Avogadro che a pressione p0 e temperatura T fissate una mole di
gas occupa sempre lo stesso volume di gas, indipendentemente dal gas usato; in particolare a p 0
=1atm è ·p0·V0 = R = costante per tutti i gas da cui:
p V R T
Equazione di stato dei gas perfetti
dove R = 8.31/(mole · ºK) è chiamata costante universale dei gas.
R oltre ad essere determinabile sperimentalmente, è universale in quanto è indipendente dalla specie
di gas quando si è nelle condizioni di gas perfetto.
Nel caso di n moli l’equazione diventa:
p V n R T
Equazione di stato dei gas perfetti per n moli