Prende il nome di gas quello stato di aggregazione della materia nel quale essa
non ha né forma né volume propri, ma assume la forma del recipiente che la
contiene, e ne occupa tutto il volume.
In generale è lo stato in cui tutte le sostanze si trovano quando vengono portate
a temperatura sufficientemente elevata.
I gas in particolari condizioni rispondono a tre semplici leggi. Queste leggi
mettono in relazione il volume di un gas alla pressione e alla temperatura. Un
gas che obbedisce a queste leggi è chiamato un gas ideale o gas perfetto.
Vengono quindi dette leggi dei gas ideali. Esse possono essere applicate
solo ai gas che non subiscono un cambiamento chimico con il variare della
temperatura e della pressione
Un gas ideale consiste di particelle (atomi o molecole) che hanno le
seguenti proprietà
1. Il volume proprio delle particelle è trascurabile rispetto al volume
occupato dal
sistema gassoso
2. Le particelle sono in costante movimento: le collisioni delle
particelle con le pareti del
recipiente sono la causa della pressione esercitata dal gas
3. Le interazioni tra le particelle (o fra queste e la superficie del
recipiente) sono nulle: gli urti sono perfettamente elastici
In tutte le formule delle leggi dei gas bisogna fare
Importante ricordare le seguenti formule di conversione:
pressione(N/m2 =Pa)
pressione: bar=100000 Pa mbar 100Pa
1atm=760mmHg(Torr)=101325Pa
Temperatura
K=°C+273,15
°C=K-273,15
Volume
1dm3=1L=1000mL=1000cm3
1cm3=1mL
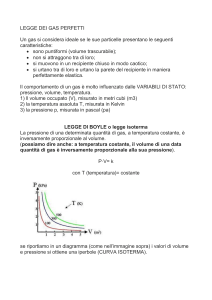
La legge di Boyle, o legge isoterma, stabilsce la relazione tra
pressione e volume: se si mantiene costante la temperatura, il
volume di una determinata massa di gas è inversamente
proporzionale alla pressione. L'espressione matematica della legge
di Boyle, a temperatura (t) costante, è
in cui P rappresenta la pressione e V il volume.
La legge di Boyle può essere rappresentata graficamente nel piano
PV, per ciascuna temperatura, da un'iperbole equilatera . Indicando
con P1 e V1 il valore della pressione e del volume di un gas nella
condizione iniziale, e con P2 e V2 il valore della pressione e del
volume nella condizione finale, applicando la legge di Boyle
avremo:
L'espressione P1V1 = P2V2 consente di ricavare una delle
grandezze quando sono note le altre tre.
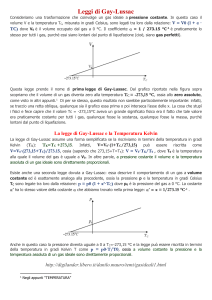
La legge di Charles, o prima legge di Gay-Lussac, o legge
isobara, stabilisce la relazione tra la temperatura e il volume: a
pressione costante, il volume di una data massa di gas è
direttamente proporzionale alla sua temperatura assoluta.
L'espressione matematica della legge di Charles, a pressione (P)
costante, è:
in cui V rappresenta il volume e T la temperatura assoluta in kelvin
(K). La legge di Charles può essere rappresentata graficamente da
una retta (v. fig. 8.2). A tale espressione si è giunti osservando che,
a pressione costante, il volume V di un gas, per ogni aumento (o
diminuzione) 1 grado centigrado (1 °C) di temperatura (t) subisce
un aumento (o una diminuzione) pari a 1/273 del volume V0
misurato a 0 °C:
Indicando con 1 la situazione iniziale e con 2 quella finale, si ha:
Noti tre di questi valori, si può ricavare il quarto.
Importante
La seconda legge di Gay-Lussac, o legge isocora, stabilisce la
relazione tra la pressione e la temperatura: a volume costante, la
pressione di una data massa di gas è direttamente proporzionale
alla sua temperatura assoluta. L'espressione matematica della
seconda legge di Gay-Lussac, a volume (V) constante, è:
in cui P rappresenta la pressione e T la temperatura assoluta in
kelvin (K). La seconda legge di Gay-Lussac può essere
rappresentata graficamente da una retta . A tale espressione si è
giunti osservando che, a un dato volume, la pressione P di un gas
aumenta (o diminuisce) di 1/273 del suo valore P0 (misurato a 0 °C)
per ogni aumento (o diminuzione) di 1 °C:
da cui:
Passando da una condizione iniziale 1 a una finale 2 si ha:
Le tre leggi dei gas prima viste possono essere opportunamente
combinate secondo la relazione:
È utile a questo punto richiamare il concetto di volume molare che
discende dalla legge di Avogadro: una mole di gas in condizioni
standard o c.s. (273 K o 0 °C e 1 atm) occupa 22,414l.
Se ora ci poniamo in c.s. (P0 = 1 atm, T0 = 273 K e V0 = 22,414l),
per una mole di gas potremo scrivere:
R è definita costante universale dei gas (in unità del Sistema
Internazionale, R = 8,314 J · K−1 · mol−1). Per una mole vale
pertanto PV = RT e per n moli si avrà: