Ossidazione degli amminoacidi
e produzione dell’urea
Gli amminoacidi sono, con gli zuccheri ed i lipidi, la terza classe di molecole che,
attraverso la degradazione ossidativa, contribuiscono significativamente alla
produzione di energia metabolica
La frazione di energia ottenuta dagli amminoacidi varia notevolmente nei diversi
organismi, passando dal 90% nei carnivori (subito dopo un pasto) a bassi valori
percentuali negli erbivori e (forse) a zero nelle piante
Negli animali, gli amminoacidi subiscono degradazione ossidativa in tre circostanze:
1. Durante il normale turnover delle proteine
2. Se la dieta è ricca di proteine, visto che gli amminoacidi in eccesso non possone
essere immagazzinati
3. Durante il digiuno od in condizioni patologiche come il diabete mellito
Per poter ossidare lo “scheletro carbonioso” di un amminoacido, bisogna prima
rimuovere il gruppo amminico in modo “sicuro”, mediante reazioni identiche in tutti
gli organismi che evitano di rilasciare ammoniaca libera (come NH4+)
L’ammoniaca è assai tossica, sia per il suo effetto sull’osmolarità dei neuroni (edema
cerebrale), che per le alterazioni che può produrre sui neurotrasmettitori e sul pH
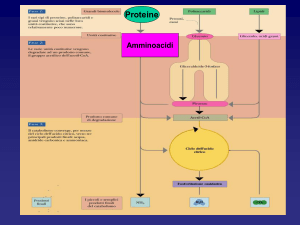
Rappresentazione schematica del catabolismo
degli amminoacidi
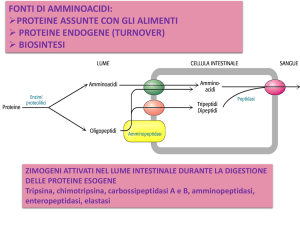
Le proteine della dieta vengono degradate enzimaticamente ad amminoacidi liberi
nel tratto gastrointestinale
La mucosa gastrica secerne l’ormone gastrina, che stimola la secrezione di HCl
(cellule parietali) e di pepsinogeno (cellule adelomorfe) dalle ghiandole gastriche
Il pepsinogeno viene convertito in pepsina per autocatalisi a pH molto basso (1,0
– 2,5) e la pepsina idrolizza il legame peptidico delle proteine a livello del gruppo
amminico dei residui aromatici Phe, Trp e Tyr
Il contenuto dello stomaco passa poi nell’intestino tenue, dove (dopo correzione
del pH acido con bicarbonato, mediata dall’ormone secretina) continua la
degradazione dei peptidi ad opera di enzimi pancreatici (rilasciati dietro
stimolo dell’ormone colecistochinina): tripsina, chimotripsina, carbossipeptidasi A
e B ed amminopeptidasi (con specificità di taglio diverse)
Il pancreas si protegge contro l’autodigestione, sintetizzando le proteasi sotto
forma inattiva (zimogeni) e dotandosi di un inibitore pancreatico della tripsina
Parte del tratto digestivo umano
I 20 aa sono convertiti in 7 intermedi metabolici
Degradazione metabolica dei comuni aa
Gli aa glucogenici sono indicati in rosa
Gli aa chetogenici sono indicati in blu
La famiglia degli aa C3: formazione del piruvato
Deamminazione
Transamminazione
La famiglia degli aa C4: formazione dell’ossalacetato
Aspartato + α-chetoglutarato ossalacetato + glutammato
Asparagina aspartato + NH4+
Nel Ciclo dell’urea e nel processo di biosintesi delle purine:
Aspartato Fumarato
La famiglia degli aa C5: formazione
dell’ α-chetoglutarato
*
*
*
Transamminazione
*
La degradazione della Val, Ile, Met
reazioni del processo di β-ossidazione degli acidi grassi
a numero dispari di atomi di C
La leucina è degradata
ad acetilCoA ed acetoacetato
Transamminazione
Decarbossilazione
La degradazione degli aa a catena ramificata
Malattia delle urine
a sciroppo d’acero
succinil-CoA
acetil-CoA
acetoacetato
La via di degradazione della lisina
La degradazione della fenilanina e della tirosina
Difetti genetici di queste vie provocano malattie ereditarie (alcaptonuria, fenilchetonuria)
La degradazione del triptofano
Acetoacetato
Niacina
Il triptofano è il precursore d’importanti molecole organiche,
che sfruttano i suoi anelli aromatici
Forme di escrezione dell’azoto e
classificazione degli organismi
Catabolismo dei gruppi amminici
nel fegato dei vertebrati
Il distacco del gruppo α-amminico è catalizzato da enzimi detti amminotrasferasi
o transamminasi
Infatti, essi catalizzano una reazione di transamminazione, che trasferisce il gruppo
α-amminico all’atomo di carbonio α dell’ α-chetoglutarato, generando Lglutammato e l’ α-chetoacido corrispondente all’L-amminoacido
Il glutammato funge da “collettore” di gruppi amminici per le reazioni successive
Il piridossal fosfato (PLP)
PLP èun derivato della piridossina [o vitamina B6] è il gruppo prostetico
di tutte le amminotrasferasi
Il PLP è un
trasportatore di
gruppi amminici
nel sito attivo delle
transamminasi (A),
ma
partecipa
anche ad altre
reazioni a livello
degli atomi di
carbonio α degli
amminoacidi : B)
racemizzazione tra
Le
Damminoacidi e C)
decarbossilazione
Il glutammato rilascia il suo gruppo
amminico sotto forma di
ammoniaca nel fegato, dove viene
trasferito alla matrice mitocondriale
degli epatociti, per subire una
deamminazione ossidativa
L’enzima è formato da sei subunità
identiche ed è regolato
allostericamente in modo
complesso, soprattutto da ADP
(modulatore positivo) e GTP
(modulatore negativo)
L’azione combinata di una
transamminasi e dell’L-glutammato
deidrogenasi viene chiamata
transdeamminazione
Mentre il glutammato è un
trasportatore di gruppi
amminici nel fegato, la
glutammina trasporta
l’ammoniaca nel torrente
circolatorio
La glutammina si forma nei
tessuti extraepatici dal
glutammato e viene
riconvertita in glutammato
nei mitocondri degli
epatociti
Il ciclo glucosio-alanina (ciclo di Cori)
Il ciclo dell’urea
Negli organismi ureotelici, l’ammoniaca accumulata nei
mitocondri degli epatociti viene convertita in urea mediante una
via metabolica ciclica scoperta da Hans Krebs (con Kurt
Henseleit) prima del ciclo TCA
Dal fegato l’urea passa nel sangue e raggiunge i reni,
dove viene escreta tramite le urine
L’urea viene prodotta in quattro tappe enzimatiche,
che prevedono la formazione di ornitina, citrullina ed arginina
(ciclo dell’OCA)
Il ciclo dell’urea
Il ciclo dell’urea inizia all’interno dei mitocondri degli epatociti, ma le tappe
successive avvengono nel citosol
L’ammonio (NH4+) presente nella matrice mitocondriale viene immediatamente
condensato con CO2 (come HCO3-), per formare carbamil fosfato (H2NCOOPO32-), con il consumo di 2ATP, ad opera della carbamil fosfato sintetasi I (la
forma II, citosolica, agisce nella biosintesi delle basi pirimidiniche)
[Si noti che sia la CO2 che l’ATP provengono dalla respirazione mitocondriale!]
Il carbamil fosfato è un donatore di gruppi carbamilici attivati ed entra nella prima
delle quattro tappe del ciclo dell’urea propriamente detto
Va osservato che esiste una seconda tappa di acquisizione dell’azoto nella sintesi
dell’urea, catalizzata dall’argininosuccinato sintetasi, che usa il
gruppo amminico dell’aspartato come fonte di azoto
Le due reazioni di acquisizione dell’azoto
nella sintesi dell’urea
Le quattro tappe del ciclo dell’urea sono le seguenti
Tappa 1
Il carbamil fosfato dona il suo gruppo carbamilico all’ornitina, per formare citrullina, ad opera
dell’ornitina transcarbamilasi
La citrullina esce dal mitocondrio ed il ciclo continua nel citosol
Tappa 2
La citrullina riceve un secondo gruppo amminico per condensazione del suo gruppo ureidico
(carbonilico) con l’aspartato e forma argininosuccinato
La reazione, catalizzata dall’argininosuccinato sintetasi, richiede ATP e rilascia AMP (intermedio
citrullil-AMP)
Tappa 3
L’argininosuccinato viene scisso (reversibilmente) dall’argininosuccinasi, che produce arginina e
fumarato (che rientra nel ciclo TCA)
Tappa 4
L’arginina viene scissa dall’arginasi in urea ed ornitina, che entra nel mitocondrio per iniziare un
nuovo ciclo di reazioni
Gli enzimi mitocondriali e quelli citosolici sembrano essere raggruppati in
due complessi, per permettere l’incanalamento dei substrati
Il “biciclo di Krebs”
Regolazione del ciclo dell’urea