ELEMENTI DI
EZIOPATOGENESI
DELLE
MALATTIE UMANE
Corso di Laurea Magistrale
in Farmacia
DIABETE MELLITO
Diagnosi
Criteri diagnostici
In assenza dei sintomi tipici della malattia (poliuria, polidipsia e calo ponderale), la
diagnosi di diabete deve essere posta con il riscontro, confermato in almeno due
diverse occasioni di:
• glicemia
a digiuno ≥ 126 mg/dl
con dosaggio su prelievo eseguito al mattino, alle ore 8 circa, dopo almeno 8 ore di digiuno
oppure
• glicemia ≥ 200 mg/dl - 2 ore dopo carico orale di glucosio (eseguito
con 75 g)
oppure
• HbA1c ≥ 6,5% (solo con dosaggio standardizzato)
DIABETE MELLITO
Diagnosi
Risultati dell’ OGTT
Normale
Ridotta
tolleranza
Diabete
Glicemia
basale
< 110 mg/dl
110-125 mg/dl
≥ 126 mg/dl
Glicemia a 30,
60, 90 min
< 200 mg/dl
140 -199 mg/dl
≥ 200 mg/dl
< 140 mg/dl
140 -199 mg/dl
≥ 200 mg/dl
Glicemia a
120 min
DIABETE MELLITO
Diagnosi
Criteri diagnostici
Sono valori di attenzione in quanto identificano soggetti a rischio di diabete e di
malattia cardiovascolare, per i quali, comunque, dovrebbe essere evitato l’uso
del termine pre-diabete*:
• glicemia a digiuno 100-125 mg/dl
condizione nota come alterata glicemia a digiuno o IFG
• glicemia 2 ore dopo carico orale di glucosio 140-199 mg/dl
condizione nota come ridotta tolleranza ai carboidrati o IGT
• HbA1c 6,00-6,49%
solo con dosaggio allineato con il metodo DCCT/UKPDS
*
un’elevata percentuale di soggetti con IFG e/o IGT e/o con HbA1c non ottimale
(valore fra 6,00 e 6,49%) non sviluppa il diabete. Le condizioni di IFG e IGT non
rappresentano situazioni di malattia, ma solo condizioni di maggiore rischio di
diabete e di aterosclerosi e malattie cardiovascolari
DIABETE MELLITO
Diagnosi
DIABETE MELLITO:
LINEE GUIDA OMS, ADA e PNLG
Normale (mg/dl)
Diagnosi di IFG,
Alterata Glicemia a
Digiuno (mg/dl)
Diagnosi di IGT,
Alterata Tolleranza
Glucidica (mg/dl)
Diagnosi di Diabete Mellito
(mg/dl)
Glicemia a Digiuno
(dopo almeno 8 ore)
Glicemia a Digiuno
(dopo almeno 8 ore)
Glicemia a Digiuno
(dopo almeno 8 ore)
<110
110-125
OGTT
75 g glucosio x os
Glicemia a 2-ore
≥ 126
140-200
STATO NON DIAGNOSTICO MA
A RISCHIO DI DIABETE
oppure
OGTT
75 g glucosio x os
Glicemia a 2-ore
> 200
oppure
Glicemia casuale
≥ 200 + tipici sintomi:
poliuria, polidipsia, perdita di
peso, polifagia, visione
sfuocata, vaginite
DIABETE MELLITO
Diagnosi
Impaired Fasting Glycemia
L'alterata glicemia a digiuno o IFG è una condizione in cui i livelli
di glucosio nel sangue, rilevati a digiuno da almeno otto ore,
superano per eccesso il limite di normalità, pur rimanendo al di
sotto dei valori che sanciscono lo stato diabetico. Per questo
motivo, quando si rileva un'alterata glicemia a digiuno, si parla
spesso di pre-diabete.
L'alterata glicemia a digiuno si accompagna ad insulinoresistenza e ad un aumento del rischio cardiovascolare; può
inoltre evolvere in diabete mellito di tipo II conclamato, con un
rischio del 50% che tale progressione si manifesti nel decennio
successivo alla diagnosi.
DIABETE MELLITO
Diagnosi
Criteri diagnostici
Valori di concentrazione del glucosio del plasma a
digiuno e diagnosi di diabete
alterata glicemia
a digiuno (IFG)
fisiologico
110 mg/dL
diabete
125 mg/dL
Panteghini - 2011 modificata
DIABETE MELLITO
Diagnosi
Impaired Glucose Tolerance
Si diagnostica alterata tolleranza al glucosio o IGT attraverso il
cosiddetto carico orale di glucosio, in cui si registra nel tempo
la risposta glicemica del paziente dopo somministrazione di
glucosio; se dopo 2h i livelli di glucosio nel sangue sono
superiori a determinati valori soglia (>140 mg/dL ma inferiori a
200 mg/dL), si parla di IGT.
Tale condizione presenta un maggior rischio di evoluzione in
diabete conclamato rispetto all'IFG ed è per questo che dopo il
riscontro di un'alterata glicemia a digiuno molto spesso il
medico indirizza il paziente verso un test da carico orale di
glucosio.
DIABETE MELLITO
Diagnosi
Impaired Glucose Tolerance
L'alterata tolleranza al glucosio è tipicamente associata alla sindrome
metabolica, caratterizzata dalla presenza di insulino-resistenza, iperinsulinemia compensatoria, iper-trigliceridemia, livelli ridotti
di colesterolemia HDL e ipertensione arteriosa.
Il filo conduttore, nonché principale agente causale, di queste
patologie è il sovrappeso, specialmente quando l'eccesso adiposo è
concentrato a livello viscerale.
La principale strategia di intervento per riportare nella norma i livelli
glicemici postprandiali è quindi basata sull'avvicinamento o il
mantenimento del peso forma.
PATOLOGIA CLINICA – C. Scapellato
DIABETE MELLITO
Diagnosi
Criteri diagnostici
Valori di concentrazione del glucosio del plasma
2 ore dopo un carico orale di glucosio (OGTT) (75 g)
e diagnosi di diabete
alterata tolleranza
glucidica (IGT)
fisiologico
140 mg/dL
diabete
200 mg/dL
Panteghini - 2011 modificata
DIABETE MELLITO
Diagnosi
Criteri diagnostici
“NORMALITA’”:
Glicemia a digiuno < 110 mg/dl
Glicemia dopo OGTT < 140 mg dl
DIABETE:
Glicemia a digiuno > 126 mg/dl
Glicemia causale >200 mg/dl + segni e sintomi
Glicemia dopo OGTT > 200 mg/dl
IFG ( alterata glicemia a digiuno):
Glicemia a digiuno >110 e < 126 mg/dl
IGT (alterata tolleranza glucidica):
Glicemia dopo OGTT >140 e < 200 mg/dl
DIABETE MELLITO
Diagnosi
Criteri diagnostici
Per formulare la diagnosi di diabete non sono
necessarie le misurazioni di 2° livello:
•
•
•
•
glicemia post-prandiale o profilo glicemico
insulinemia basale o durante OGTT
C-peptide
autoanticorpi
DIABETE MELLITO
Diagnosi
Diabete Gestazionale
Diagnosi con curva da carico glucidico 75 gr
Glicemia
Plasmatica
mg/dl
mmol/l
Digiuno
≥92
≥5.1
Dopo 1 ora
≥180
≥10.0
Dopo 2 ore
≥153
≥8.5
Sono definite affette da Diabete Gestazionale le donne con 1 o
più valori di glicemia plasmatica superiori alle soglie riportate
in tabella
DIABETE MELLITO
Diagnosi
MISURA
•Valori basali: 8 -24 mU/L.
•Particolarmente indicata per diagnosticare un
insulinoma in caso di ipoglicemia pronunciata.
•Può essere misurato con maggior comodità il peptide
C, in quanto caratterizzato da un metabolismo più
lento di quello dell’insulina.
•Possibilità di misura del peptide C in corso di terapia
insulinica, dal momento che questo deriva solo
dall’insulina endogena.
DIABETE MELLITO
Diagnosi
Emoglobina glicata (HbA1c)
Prodotto di una reazione non enzimatica fra il glucosio e
l’HbA1, lenta e irreversibile.
Gli eritrociti umani sono facilmente permeabili al
glucosio, il quale si combina con l’emoglobina. Da
questa reazione non enzimatica fra il gruppo αamminico della valina N-terminale della catena β dell’Hb
e il glucosio si forma una base di Schiff.
DIABETE MELLITO
Diagnosi
Emoglobina glicata (HbA1c)
La reazione è determinata dalla concentrazione dei
reagenti, il grado di glicosilazione è proporzionale alla
concentrazione media del glucosio nel sangue durante il
periodo di sopravvivenza dell’Hb nel globulo rosso in
circolazione.
L’utilità delle misurazioni dell’HbA1c percentuale per la
diagnosi di diabete è stata dimostrata nello studio
sperimentale DCCT (Diabetes Control and Complications
Trial), dal quale deriva una correlazione diretta tra il valore
di HbA1c e la prognosi del paziente rispetto alle
complicanze a lungo termine.
DIABETE MELLITO
Diagnosi
Glicazione
reazione non enzimatica fra un carboidrato e un gruppo aminico
di proteine (gruppo amino-terminale)
L’Hb A1c costituisce circa l’80% delle emoglobine glicate (Hb A1)
DIABETE MELLITO
Diagnosi
DIABETE MELLITO
Diagnosi
La glicazione dell’emoglobina è irreversibile
La velocità di formazione della Hb glicata è
proporzionale alla concentrazione ematica del
glucosio
La concentrazione della Hb glicata rappresenta una
integrazione dei valori della glicemia nelle ultime 68 settimane
POSSIBILI PROBLEMI
- pazienti con anemie emolitiche
- effetto delle varianti di Hb (Hb F, Hb S, Hb C)
DIABETE MELLITO
Diagnosi
RACCOMANDAZIONI
HbA1c deve essere misurata:
- almeno due volte all’anno in tutti i pazienti
- ogni tre mesi nei pazienti la cui terapia è stata
modificata o che presentano un diabete non
controllato
DIABETE MELLITO
Diagnosi
Valori di concentrazione dell’emoglobina glicata
e diagnosi di diabete
borderline
fisiologico
42 mmol/mol
(6,0%)
39 mmol/mol
(5,7%)
Am Diab Ass 2010
diabete
47 mmol/mol
(6,5%)
DIABETE MELLITO
Diagnosi
Correlazione tra livelli di HbA1c e glicemia plasmatica
media basati sullo studio ADAG
HbA1c (%)
Glicemia plasmatica media
6
126 mg/dl
7
154 mg/dl
8
183 mg/dl
9
212 mg/dl
10
240 mg/dl
11
269 mg/dl
12
298 mg/dl
DIABETE MELLITO
Diagnosi
Uso della Hb glicata per la diagnosi di diabete mellito:
vantaggi e limitazioni
VANTAGGI
• Non è necessario il digiuno del
soggetto
• Si correla allo sviluppo delle
complicanze
• Variabilità
biologica
intraindividuale minore della glicemia
• Instabilità
preanalitica
molto
minore rispetto alla glicemia
• Riflette il controllo glicemico degli
ultimi 2-3 mesi e non subisce
interferenze dalle variazioni rapide
della glicemia
LIMITAZIONI
• La determinazione può essere
influenzata
da
variabili
preanalitiche
non
note
(es.
emoglobinopatie)
• Il costo della determinazione è più
alto di quello della glicemia
• La misura potrebbe essere non
disponibile come quella della
glicemia (es. paesi in via di
sviluppo)
DIABETE MELLITO
Diagnosi
indica le chetoamine prodotte dalla interazione del
glucosio con i gruppi e-aminico dei residui di lisina
dell’albumina
l’emivita dell’albumina è circa 20 giorni
la concentrazione dell’albumina glicata riflette il
controllo glicemico delle 2-3 settimane precedenti
RACCOMANDAZIONI
"Sono necessari ulteriori studi per determinare se le
proteine glicate, quali le fruttosamine, siano
clinicamente utili per il monitoraggio di routine dello
stato glicemico del paziente“.
DIABETE MELLITO
Diagnosi
ruolo in combinazione con l’Hb A1
utile nei pazienti con varianti emoglobiniche
(Hb S o Hb C associate con ridotta emivita degli
eritrociti)
non utilizzabile in pazienti con importanti
perdite proteiche: sindrome nefrosica, gravi
epatopatie, dopo flogosi acute.
Il test non dovrebbe essere eseguito se la
concentrazione di albumina è < 30 g/L
DIABETE MELLITO
Diagnosi
1) Insulina e Peptide C sono secreti in quantità equimolari,
ma nonostante ciò, in virtù della maggiore emivita, la
concentrazione plasmatica di Peptide C è superiore.
2) Le concentrazioni ematiche del Peptide C riflettono la
sintesi endogena di insulina. A livelli ematici di Peptide C
bassi, quindi, corrisponde sintesi di insulina scarsa.
3) Nei diabetici quindi livelli di Peptide C sono bassi?
In realtà spesso è vero l'opposto
Nel diabete di tipo II l'insulina è normalmente aumentata
e con essa i livelli di Peptide C.
Perché in tali situazioni più che mancare l'insulina in sé,
viene meno la sensibilità delle cellule alla sua azione; si
parla, non a caso, di insulino-resistenza
DIABETE MELLITO
GLICEMIA
alta
bassa
alta
bassa
PEPTIDE C
alto
Diagnosi
POSSIBILE CAUSA
Diabete di tipo II, Diabete gestazionale, Prediabete, Insulino resistenza (spesso conseguente
a sindrome da ovaio policistico, S. di Cushing,
Obesità
alto
Insulinoma, eccessivo utilizzo di ipoglicemizzanti
orali, come sulfaniluree e meglitinidi.
basso
Diabete mellito di tipo I, diabete di tipo II in fase
avanzata
basso
Malattie epatiche, infezioni severe, morbo di
Addison, iniezione di una dose eccessiva di
insulina.
DIABETE MELLITO
Diagnosi
PEPTIDE C basale
Indicazione:
Consente di valutare capacità del pancreas di secernere insulina
ma, per la sua lunga emivita, non permette studi sulla cinetica
dell’insulina
Diabete mellito di tipo 1 e 2 nelle diverse fasi
Procedura:
Digiuno di 12 ore
Dosaggio di C-peptide
Interpretazione:
Valori basali normali 0,9-4 ng/dl;
valori basali <0,9 ng/dl indicano inadeguata riserva insulinica.
DIABETE MELLITO
Diagnosi
PEPTIDE C dopo stimolo
Indicazione:
Consente di valutare la riserva insulinica nel diabete
mellito di tipo 1 e 2 nelle diverse fasi
Può essere effettuato dopo pasto standard dopo un
digiuno di 12 ore oppure dopo test al glucagone.
Nel primo caso il dosaggio del C-peptide si effettua
basale e dopo 1 ora dal pasto.
Il diabete tipo 1
• DMT1 è una malattia autoimmune organo specifica
caratterizzata dalla distruzione delle cellule beta
pancreatiche mediata dai linfociti T.
• Esordisce tra l’infanzia e la pubertà, ma nessuna
età è risparmiata.
• L’esordio clinico è spesso brusco, con forte
dimagrimento, poliuria, iperglicemia elevata
accompagnata da chetosi.
Il diabete tipo 1
le basi autoimmuni
Gli Autoanticorpi
• Il termine “Islet autoantibody” è un termine generico che
identifica qualunque elemento di un gruppo di autoanticorpi
diretto contro le isole di Langherans o, in alcuni casi, diretti
specificatamente contro autoantigeni delle cellule β che
secernono insulina.
• Gli Autoanticorpi anti-insula sono comunemente presenti
all’esordio della malattia e persistono per periodi vari dopo
l’esordio.
• Gli Autoanticorpi precedono l’esordio del DMT1 di mesi o anni.
• Esistono evidenze che, nei soggetti positivi per gli autoanticorpi,
alcuni antigeni delle isole siano riconosciuti come estranei e
portino ad una risposta immunitaria di tipo umorale.
Il diabete tipo 1
le basi autoimmuni
La prova definitiva della natura autoimmune del
Diabete mellito di tipo1 -DMT1- è stata fornita
dalla dimostrazione dell’esistenza, nel siero dei
pazienti affetti, di autoanticorpi anti-insula
pancreatica [“islet cell antibodies” (ICA)],
evidenziati tramite immunofluorescenza indiretta
su sezioni criostatiche di pancreas umano.
Bottazzo GF, Florin-Christensen A, Doniach D. Islet cell antibodies in diabetes mellitus with
autoimmune polyendocrine deficiencies. Lancet 1974;2(7892):1279.
Il diabete tipo 1
le basi autoimmuni
Gli autoanticorpi circolanti confermano la diagnosi
• Il
dosaggio
degli • Circa il 3-5% dei
autoanticorpi
nei
pazienti clinicamente
parenti di primo grado
DMT1 sono negativi al
di soggetti con DMT1
dosaggio
degli
combinato
con
la
autoanticorpi.
valutazione
della
secrezione insulinica è
un
valido
valore
predittivo di insorgenza
di DMT1.
Il diabete tipo 1
le basi autoimmuni
Gli Autoanticorpi nel DMT1
Insulin, insulin processing and insulin storage
IAA
Proinsulin autoantibodies
ZnT8A
Protein tyrosine phosphates
IA-2A
IA-2β autoantibodies
Enzymes
Carbonic anhydrase II
Chymotrypsinogen-related 30-kDa pancreatic autoantibody
GADA
51-kDA aromatic L-amino-acid decarboxylase autoantibodies
Miscellaneous
Aminoacyl-tRNA synthetase autoantibodies
Glycolipid autoantibodies Islet cell surface autoantibodies
ICA
Islet cell-specific 38-kDa autoantibodies
Winter EW et al. Clin Chem 57: 168, 2011.
Il diabete tipo 1
le basi autoimmuni
Gli Autoanticorpi
I 4 principali Autoanticorpi di interesse in campo clinico
e di ricerca, rivolti verso varie strutture dell’insula
pancreatica, sono:
ICA: anticorpi diretti contro il citoplasma delle cellule
dell’insula
GADA: anticorpi
decarbossilasi
diretti
contro
la
glutammato
IA-2A: anticorpi diretti contro la tirosina-fosfatasi
IAA: anticorpi diretti contro l’insulina nativa
Il diabete tipo 1
le basi autoimmuni
Gli Autoanticorpi
Gli autoanticorpi circolanti confermano la diagnosi
•
•
•
•
•
Islet Cell Antibodies (ICA)
Glutamic Acid Decarboxylase Antib. (GADA)
Insulinoma-associated protein 2 Antib. (IA-2)
Insulin autoantibodies (IAA)
ZnT8 autoantibodies (ZnT8A)
Il diabete tipo 1
le basi autoimmuni
ICA
Diretti verso antigeni bersaglio dell’insula estremamente eterogenei
In bambini ed adolescenti con DMT1, la sensibilità diagnostica degli ICA al
momento dell’esordio clinico della malattia è pari al 70-90%.
Nel caso di esordio in età adulta, gli ICA hanno una sensibilità inferiore
La specificità diagnostica degli ICA per DMT1 è circa pari a 97-98%
I risultati dimostrano che la positività può precedere di molti anni l’esordio
clinico e che il valore predittivo degli stessi, per sviluppo di diabete entro 5
anni, è del 53%.
Tale valore è fortemente influenzato da numerose variabili:
è maggiore in presenza di alti titoli anticorpali ed in soggetti positivi per
altri autoanticorpi anti-insulari
è basso in soggetti positivi solo per ICA a basso titolo
Dopo l’esordio clinico del DMT1, gli ICA sono transitori e scompaiono entro
pochi anni (la scomparsa potrebbe essere legata alla scomparsa di uno o
più autoantigeni, per la distruzione delle cellule β
La persistenza degli ICA sembra predire un aumentato tasso di perdita della
produzione endogena di insulina
Il diabete tipo 1
GADA
le basi autoimmuni
I GADA - gli anticorpi contro GAD65- sono riscontrabili nel 70-75% dei
pazienti con DMT1 di recente insorgenza e nel 1-2% di soggetti sani di
controllo.
Sono evidenziabili già mesi e perfino anni prima della manifestazione della
patologia.
I GADA sono più persistenti degli ICA dopo l’insorgenza del DMT1.
A differenza di altri autoanticorpi anti-insula, la frequenza dei GADA in
pazienti con DMT1 di recente diagnosi, non è influenzata dall’età.
I GADA rappresentano il marcatore immunologico a più alta sensibilità
diagnostica in pazienti con esordio clinico della malattia diabetica in età
adulta.
Malgrado l’alta specificità diagnostica (99%), la frequenza di soggetti
GADA-positivi nella popolazione generale è 10 volte superiore alla
prevalenza della malattia.
Ne consegue che il valore predittivo dei GADA per lo sviluppo futuro di
DMT1 (7-8%) non è migliore di quello di altri autoanticorpi.
Il diabete tipo 1
IA-2A
le basi autoimmuni
Attraverso lo screening di librerie di cDNA insulari con sieri di pazienti
DMT1, è stato identificato un nuovo autoantigene denominato “islet cell
antigen 512- ICA512”.
E’ stato dimostrato essere una sequenza parziale di un antigene di
maggiori dimensioni denominato IA-2.
Studi ulteriori hanno messo in evidenza una nuova proteina con elevato
grado di omologia con IA-2, che è stata denominata IA-2β.
Le sequenze aminoacidiche delle due proteine sono identiche per oltre
l’80%.
Studi di sequenza hanno dimostrato che appartengono alla famiglia delle
tirosina-fosfatasi, con modificazioni che ne annullano l’attività enzimatica
effettiva.
Autoanticorpi anti-IA-2A sono presenti nel 70-80% dei bambini con
DMT1 di recente insorgenza e sono meno frequenti in pazienti con
esordio in età adulta.
Rappresentano uno dei più importanti marcatori del diabete di tipo 1.
Il diabete tipo 1
ZnT8-A
le basi autoimmuni
Zinc transporter 8 autoanticorpi
Il più recente autoantigene identificato: trasportatore dello zinco ZnT8
(Slc30A8) (2007)
Zinc trasporter 8 (ZnT8) è una proteina trans-membrana dei granuli
secretori delle cellule β pancreatiche
Appartiene ad una famiglia di proteine che regolano l’efflusso dei cationi:
attualmente sono stati identificati 10 membri.
ZnT8 concentra lo zinco nei granuli secretori dell’insulina
Gli anti-ZnT8 sono diretti principalmente verso il residuo carbossiterminale della proteina.
Anticorpi anti-ZnT8 (ZnT8A) sono stati rilevati nel 60-80% di pazienti
DMT1 di recente insorgenza ed in meno del 2% di soggetti di controllo.
Più precisamente, ZnT8A sono stati identificati nel 26% di soggetti
diabetici classificati come negativi per autoanticorpi anti-insula.
Il diabete tipo 1
le basi autoimmuni
associazione degli anticorpi
Il 5,8% dei pazienti con DMT1 all’esordio, analizzati per GADA, IA-2A,
IAA, risultava negativo a tutti e 3 gli autoanticorpi.
Solo 1,8% dei pazienti si confermava negativo, quando il saggio per
ZnT8A era aggiunto al pannello.
72% di pazienti all’esordio risultavano positivi per 2 o più anticorpi, se
analizzati per GADA, IA-2A e IAA.
82% di pazienti all’esordio risultavano positivi per 2 o più anticorpi, se
testati anche per ZnT8A.
ZnT8A sono più frequenti all’esordio di DMT1 con l’aumentare dell’età
del paziente, mentre la prevalenza di IAA declina con l’aumentare
dell’età.
Necessità di testare i 4 markers di autoimmunità.
Pancreatiti
MALATTIA INFIAMMATORIA
DEL PANCREAS
A DECORSO
ACUTO
CRONICO
Pancreatiti
La
pancreatite
è
un
processo
infiammatorio
acuto o cronico a carico del
pancreas.
Nelle
forme
più
lievi
guarisce in pochi giorni
senza conseguenze; le
forme più gravi possono
lasciare esiti come diabete
o disturbi digestivi o nei
peggiori dei casi essere
fatali.
PANCREATITE
Pancreatite acuta
Flogosi acuta del pancreas e dei tessuti
peripancreatici
caratterizzata morfologicamente da lesioni che
vanno dal semplice edema interstiziale alla
necrosi parenchimale
E’ un processo patologico caratterizzato dal fenomeno di
autodigestione del parenchima esocrino causato dai suoi stessi enzimi
digestivi.
Nel 70% dei casi può essere conseguenza di alcolismo o di calcoli
biliari e altre patologie dei dotti biliari.
Il restante 30% possono essere iperlipemia, ostruzione del dotto
pancreatico principale, ferite a carico del pancreas, traumi
postoperatori, avvelenamento.
PANCREATITE
Pancreatite acuta
PANCREATITE
Pancreatite acuta
PANCREATITE
Pancreatite acuta
PANCREATITE
Pancreatite acuta
TRAUMI
Danno diretto (rottura del Wirsung)
Stenosi cicatriziali duttali
CHIRURGIA: ADDOMINALE IN GENERE, BILIARE IN
PARTICOLARE
- Traumatismo diretto
- Fenomeni ischemici
PANCREATITE
Pancreatite acuta
Patofisiologia: meccanismi patogenetici
Attivazione intrapancreatica della componente
enzimatica
AUTODIGESTIONE GHIANDOLARE
PANCREATITE
Pancreatite acuta
Le pancreatiti acute sono mortali nel 15% dei casi, ma
la percentuale mortalità è diversa per ogni tipo di
pancreatite acuta: nella forma edematosa i casi di
morte sono meno del 2%, mentre nei casi di pancreatite
necrotico-emorragica si ha una mortalità superiore al
30-40%.
Se il pancreas viene colpito interamente da necrosi, la
mortalità è superiore al 60% e i casi più gravi di
pancreatite acuta, se non curati, provocano la morte del
paziente entro 48 ore.
PANCREATITE
Pancreatite cronica
Processo
infiammatorio
cronico
del
pancreas che coinvolge inizialmente il
sistema
duttale
pancreatico
e
successivamente anche il settore acinoso
ed endocrino della ghiandola.
SECONDARIA
a ripetuti episodi di pancreatite
acuta che esitano in lesioni
cicatriziali duttali
PRIMITIVA
PANCREATITE
Pancreatite cronica
Con pancreatite cronica si indicano tutte le affezioni
del pancreas a carattere cronico che possono
produrre un danno permanente o disfunzione
dell’organo.
Talvolta ci sono rapporti tra forme croniche e acute,
in altri casi tra i due fenomeni non vi è alcuna
relazione
La diagnosi deve essere tempestiva, e si ottiene
interpretando i sintomi e facendo ricorso a indagini
quali Raggi X, TAC e Risonanza Magnetica.
PANCREATITE
FATTORI
Pancreatite cronica
PRIMITIVA
EZIOLOGICI
Autoimmunitaria (± alcol)
Ostruttiva (± alcol)
Distrofia cistica della parete duodenale (± alcol)
Fibrosi cistica (± alcol)
Mutazioni del gene del tripsinogeno (± alcol)-ereditaria
Alcolica pura
Tropicale (malnutrizione calorico-proteica)
FATTORI di RISCHIO
• abuso di bevande alcoliche
• fumo di sigaretta
• squilibri dietetici
PANCREATITE
Pancreatite cronica
Insufficienza pancreatica
Maldigestione ± steatorrea, quando si ha una
riduzione di circa 80% della secrezione enzimatica
Deficit vit. Liposolubili, alterazioni ossee
Intolleranza glucidica, diabete non chetoacidosico
PANCREATITE
Pancreatite cronica
Test diretti di funzione pancreatica
Test secretina-ceruleina
Dosaggio chimotripsina fecale
Dosaggio elastasi fecale
o Glicemia basale
o OGTT (oral glucose tolerance test)
o Dosaggio C-peptide dopo stimolo
con glucagone
o ITT (insulin tolerance test)
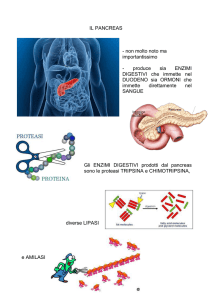
PANCREAS
Sindrome metabolica
L’insulinoresistenza o sindrome metabolica è una
patologia associata ad obesità ed alla diminuzione di
attività fisica; viene diagnosticata quando un individuo
presenta 3 o più dei seguenti sintomi:
•
•
•
•
•
Obesità addominale ( M>102 cm F>88 cm )
Valore dei trigliceridi ≥150 mg/dl
Colesterolo HDL basso (M ≤40 mg/dl F ≤50 mg/dl)
Pressione sanguigna elevata ( ≥140/90 mmHg )
Glicemia a digiuno ≥110 mg/dl
PANCREAS
Sindrome metabolica
Normalmente l’insulina permette al glucosio ematico
di penetrare nelle cellule dell’organismo per fornire
energia, tuttavia quando quantità normali di insulina
non riescono a trasportare il glucosio all’interno
delle cellule ha luogo la “resistenza all’insulina”, in
altre parole la cellula resiste all’azione dell’insulina e
il glucosio non riesce a penetrarvi.
Quando accade ciò il pancreas deve produrre più
insulina per mantenere normali i livelli di glicemia;
anche se le persone con questa patologia hanno
livelli glicemici elevati, i valori rientrano comunque
nella norma e non si parla di diabete.
PANCREAS
Sindrome metabolica
PANCREAS
• Insulinoma
• Glucagonoma
NEOPLASIE
PANCREAS
INSULINOMA
L’insulinoma è una forma di tumore che colpisce le
cellule β delle isole di Langerhans del pancreas, e
fra tutte le forme di neoplasie di tale zona è la più
frequente.
Caratteristica clinica fondamentale è l’ipoglicemia a
digiuno, causata da una secrezione di insulina
eccessiva in relazione ai livelli di glucosio nel
sangue.
Colpisce prevalentemente i maschi in età adulta fra
i 30 e i 60 anni.
PANCREAS
GLUCAGONOMA
Per glucagonoma si intende una forma rara di neoplasia che
interessa le cellule α del pancreas, è voluminoso e
localizzato per lo più nel corpo e nella coda dell’organo, la
sua attività principale è quella di secernere il glucagone
provocando nell’individuo la nascita di iperglicemia.
La sua progressione è quasi sempre a carattere maligno e
tende ad infiltrarsi anche nei linfonodi e nel fegato
(provocando spesso metastasi epatiche), ma mentre di
solito le neoplasie maligne lasciano una sopravvivenza
molto bassa, questa forma permette di vivere anche oltre 18
anni dalla comparsa dei primi sintomi.