Prof. Tazzioli, 11/11/04
LA MAMMELLA
Oggigiorno l’inquadramento diagnostico-terapeutico della patologia mammaria è
cambiato completamente; fino a vent’anni fa l’intervento eseguito routinariamente
era la mastectomia radicale, sia per la donna che presentava un piccolo nodulo che
per quella che mostrava segni di una neoplasia avanzata, associata allo svuotamento
del cavo ascellare.
Mentre fino agli anni ’60 l’intervento standard era quello sec. Halsted che consisteva
nell’eseguire la mastectomia allargata con asportazione dei muscoli pettorali: piccolo
e grande, associata allo svuotamento ascellare.
La tendenza attuale è quella di stadiare il più possibile la ghiandola mammaria, anche
perché si hanno a disposizione terapie e strategie che consentono di ottenere una
buona prognosi e % di guarigioni molto alte senza ricorrere all’intervento demolitivo
(screening e diagnosi precoce).
La mammella è un annesso cutaneo, più precisamente è una ghiandola sudoripara
modificata ricoperta da cute; dal punto di vista anatomico è situata sopra la fascia del
muscolo grande pettorale. Attraverso il tessuto adiposo della mammella, dalla cute
alla fascia profonda, si diramano tralci di tessuto connettivo (legamenti di Cooper)
che suddividono la ghiandola in lobuli, inoltre forniscono la forma e sostengono la
mammella verso l’alto; questi elementi in quanto ancorati alla cute sono anche i
responsabili dell’eventuale retrazione cutanea che si verifica a seguito di una
neoplasia.
I lobuli sono collegati tra loro mediante i dotti galattofori (in numero di 10-12 circa)
che convogliano il secreto ghiandolare al capezzolo.
La ghiandola mammaria ha un controllo di tipo endocrino, mediato dalla prolattina e
risente anche dell’attività ormonale genitale (estrogeni e progesterone).
Verso i 38-40 anni inizia la fase di involuzione fibroadiposa ; questo ci fa capire
come mai dopo una certa età, la ghiandola e meglio investigabile con indagini
strumentali specifiche (ECO in età fertile e mammografia dopo i 40 anni).
La vascolarizzazione della mammella è data da rami provenienti dall’arteria ascellare
e dall’arteria mammaria interna (ramo della succlavia) deputata alla
vascolarizzazione della porzione mediale della ghiandola, mentre la porzione laterale
compete ai rami dell’ascellare (acromiotoracica e toracica lunga o mammaria
esterna).
Il drenaggio venoso segue le rispettive arterie e assicura, in senso inverso, il deflusso
di sangue verso i tronchi maggiori (ascellare-succlavia-azygos). Anche la
vascolarizzazione risente delle modifiche ormonali che la ghiandola subisce.
La consistenza della mammella varia durante le fasi del ciclo ormonale; questo
concetto è molto importante da sapere in quanto la visita senologica dovrebbe essere
svolta dopo 4-5 giorni dal termine del ciclo mestruale, perché prima è presente
turgore che potrebbe confondere il quadro, poi alcune formazioni cistiche
1
eventualmente presenti possono, in questa fase, prendere il sopravvento e quindi
condizionare il parere medico.
La ghiandola mammaria è presente anche nel maschio, anche se è un organo
rudimentale; l’areola ha un diametro molto più piccolo rispetto a quella femminile.
La quantità di tessuto ghiandolare non supera l’estensione dell’areola ed ha uno
spessore di circa ½ centimetro. Durante il periodo puberale aumenta un po’ di
dimensioni ma poi scompare, dopo la fase puberale, con la normale increzione di
testosterone ; mentre la sua eventuale persistenza prende il nome di ginecomastia. La
patogenesi è da ricondurre ad una maggiore increzione di estrogeni o una loro
diminuita metabolizzazione. L’aumento della quantità di estrogeni è legata a fattori:
METABOLICI: cirrosi epatica
FARMACOLOGICI: Antiandrogeni (Terapia del K prostatico)
Digitale,Antipertensivi,Ranitidina
NEOPLASTICI: Testicolo,Surreni,Sindromi paraneoplastiche.
L’uomo quindi è sempre bene che venga prima sottoposto ad una visita
endocrinologia, e che venga condotta una corretta anamnesi farmacologia.
Il cancro della ghiandola mammaria maschile è infrequente, incide infatti per meno
dell’1 % rispetto alle donne, però è estremamente aggressivo forse perché il tessuto
ghiandolare è scarso e quindi c’è un più rapido e frequente interessamento del
muscolo pettorale. La diagnosi è il più delle volte tardiva, quando è a uno stadio già
avanzato.
TUMORI MALIGNI DELLA MAMMELLA
Epidemiologia e fattori di rischio:
Il carcinoma della mammella è al 1° posto d’incidenza nelle neoplasie della donna, e
nel mondo occidentale è la più frequente causa di morte tra i 40 e 50 anni. In Italia si
registrano circa 30.000 nuovi casi / anno; la fascia d’età maggiormente colpita è
rappresentata dalle donne tra i 50 e 70 anni comunque esiste anche una percentuale
non trascurabile di casi in donne con meno di 50 anni e in quelle con più di 70
(7.000-8.000 donne con meno di 50aa).
Lo screening mammografico viene condotto fra i 50 e 65 anni, perché le alterazioni
ghiandolari e l’incidenza di malattia è massima in questa fascia.
NB: anche le donne con meno di 40 anni, oggigiorno, non sono da sottovalutare
perché l’incidenza della malattia si sta abbassando come fascia d’età.
Per quanto riguarda la prognosi, in Italia, il numero di donne che hanno superato la
malattia è di circa 300.000; un valore elevato che denota come l’approccio
diagnostico-terapeutico abbia compiuto negli anni un trend in continua ascesa.
I fattori di rischio si possono suddividere in 3 gruppi:
1. Fattori demografici e sociologici: età (50-70aa), popolazioni occidentali ricche
(uso di anticoncezionali orali e riduzione del numero di gravidanze), classi
socio-culturali agiate, migrazione in paesi ricchi in età prepubere o puberale;
infatti nelle popolazioni meno sviluppate c’è un’incidenza di malattia molto
più bassa.
2
2. Fattori costituzionali, fisiologici, riproduttivi: famiglie ad alto rischio
(famigliarità per linea materna), elevato peso alla nascita (superiore ai 4.5 Kg),
menarca precoce, statura elevata, nulliparità, primigravidanza tardiva,
mancanza di latte o allattamento breve, età della menopausa, obesità, elevati
livelli di testosterone e di estradiolo e bassi livelli di SHBG in menopausa
3. Fattori ambientali: radiazioni ionizzanti, Tp ormonali sostitutive, contraccettivi
orali, dieta ricca povera di frutta e verdura e di fitoestrogeni (ex. soia) cioè
prodotti vegetali che hanno struttura simile agli estrogeni, che vanno ad
occupare i recettori estrogenici, bloccando gli effetti di questi ormoni. Per
questo motivo dall’ultimo protocollo del CONCAM??? Viene consigliata una
dieta contenente questa sostanze nel periodo premenopausale e menopausale.
Il 5-7% dei tumori della mammella sono ereditari, studi genetici hanno mostrato
delle mutazioni a carico dei geni BRCA1 e 2, che pare siano responsabili dei 2/3 dei
Ca ereditari; queste donne hanno una probabilità di ammalarsi superiore al 50-80%
rispetto a chi non è portatrice.
Inoltre questi geni pare siano coinvolti anche in altri tipi di neoplasie quali: ovaio e
surrene, per questo motivo dovrebbero essere indagati tutti i familiari.
Criteri di sospetto di predisposizione genetica:
Famiglie con più di 2 casi di Ca mammario e 1 o 2 all’ovaio
Famiglie con più di 3 casi di Ca mammario diagnosticati prima dei 50
anni
Coppie di sorelle con i seguenti tumori diagnosticati prima dei 50 anni:
1. entrambe tumore alla mammella
2. entrambe tumore all’ovaio
3. una con tumore alla mammella l’altra all’ovaio
Queste donne non possono sottoporsi ad uno screening normale, bensì a procedure
più mirate; infatti nei soggetti con probabilità maggiore del 10% si procede nel
seguente modo:
Mammografia dopo i 30-35 anni ogni 12 mesi
Autopalpazione dopo i 20 anni ogni mese
Esame clinico (ginecologico e senologico) ed ecografia mammaria ogni 6 mesi
(donne con meno di 40 anni)
Eco transvaginale e valutazione del marker per l’ovaio: ca 125 dopo i 35 anni
ogni 12 mesi.
In questo modo possono essere rilevate lesioni anche piccole, con una prognosi e
guarigione sicuramente migliori.
3
Classificazione dei tumori epiteliali maligni (OMS):
1. Non invasivi: la proliferazione cellulare è confinata alla membrana basale, c’è
l’indicazione ad un trattamento chirurgico conservativo.
Carcinoma duttale in situ o intaduttale
Carcinoma lobulare in situ: è multicentrico nel 70% dei casi e bilaterale
nel 20-40%, è considerato una forma precancerosa (1/3 delle pz
sviluppa successivamente un carcinoma lobulare infiltrante) e quindi va
sottoposto ad un attento controllo nel tempo.
2. Invasivi: è presente invasione stromale
Carcinoma duttale infiltrante: è il più frequente, 70-75% dei casi
Carcinoma lobulare infiltrante
Carcinoma mucinoso
Carcinoma midollare
3. Malattia di Paget del capezzolo
Classificazione dei tumori epiteliali benigni
1. Papilloma intraduttale
2. Adenoma del capezzolo
3. Adenoma: non necessita di terapia, viene diagnosticato con eco,
mammografia e agoaspirato (attendibilità diagnostica soddisfacente)
Classificazione dei tumori misti epiteliali e stromali
1. Fibroadenoma
2. Tumore filloide: deve essere considerato attentamente perché può
raggiungere notevoli dimensioni e avere ripercussioni in senso di
trasformazione maligna; va trattato chirurgicamente.
La diagnosi nella patologia mammaria si avvale di:
Educazione della pz ovvero autopalpazione: da effettuarsi a partire dai 30-35
anni almeno 1 volta al mese lontano dal ciclo.
Esame clinico: anche se oramai è stato superato da altre metodiche, perché
presuppone che ci sia una neoplasia ormai evidente (retrazione cutanea,
buccia d’arancia, nodulo duro fisso).Un nodulo per essere palpato deve
almeno aver raggiunto le dimensioni di 1 cm, inoltre all’esame clinico è
difficile fare DD tra lesione benigna e maligna. Per quanto riguarda il
capezzolo, l’esame clinico è volto alla ricerca di eventuali secrezioni che il
più delle volte sono legate ad un fatto infiammatorio (secrezione sierosa);
mentre una secrezione ematica non deve spaventare ma neanche essere
sottovalutata, perchè dovuta ad un papilloma intraduttale, lesione benigna che
tuttavia deve essere asportata e fatta diagnosi certa.
Oggi si fa diagnosi infraclinica perché si scoprono lesioni minori di 1 cm di diametro.
4
Mammografia: esame radiologico principe per il riscontro delle lesioni; le
donne intorno ai 40 anni dovrebbero sottoporsi al primo accertamento, poi si
stabilirà se ripetere l’esame dopo un anno o più in base alle caratteristiche del
seno e dei fattori di rischio della donna.
Tra i 50 e 65 anni esiste lo screening dove le donne vengono sottoposte alla
mammografia ogni 2 anni, se però sorgono dubbi si può anticipare il
successivo controllo oppure eseguire altri accertamenti.
Ecografia: di solito è di completamento alla mammografia, risulta molto utile
nello studio della ghiandola ancora florida. E’ inoltre importante perché
consente di eseguire, in maniera accurata, l’agoaspirazione delle lesioni.
Duttogalattografia: consiste nell’introdurre mdc all’interno di un dotto
galattoforo per evidenziare alterazioni di calibro e/o difetti di riempimento
dell’albero duttale, dovute a lesioni proliferative.
RMN: sta assumendo un ruolo molto importante perché ha il vantaggio di
studiare mammelle già sottoposte ad intervento chirurgico, permette di
distinguere il tessuto cicatriziale da quello neoplastico di un’eventuale
recidiva.
Altre lesioni oltre i noduli sono rappresentate dalle Microcalcificazioni, che spesso si
accompagnano alla presenza di cellule neoplastiche; per questo motivo bisogna
almeno arrivare ad una diagnosi Citologica: mediante ago sottile sotto guida
ecografia. Se invece la lesione è più grossa si può eseguire un vero e proprio prelievo
di tessuto (Tru cut) per l’esame istologico.
Mammotome: prelievo bioptico eseguito con un particolare strumento
collegato al mammografo; permette di asportare lesioni di diversi mm, a volte
dopo il mammotome non resta neanche più la lesione. E’ un esame che
consente di avere un grado istologico molto preciso.
Malattia di Paget: neoplasia che interessa il capezzolo, che colpisce l’1-4% di tutte
le pazienti affette da cancro della mammella, che si associa spesso ad altre forme di
neoplasia mammaria. Si presenta come una lesione eczematoide, caratterizzata da
bruciori, prurito e sanguinamento locale; in realtà queste sono manifestazioni
secondarie all’insorgenza di un carcinoma primitivo dei dotti mammari del capezzolo
con successiva invasione cutanea. La mammografia in questi casi risulterà negativa e
la diagnosi necessita oltre che della clinica anche di una citologia delle cellule
ottenute per apposizione diretta di un vetrino sull’ulcerazione cutanea. Nei casi dubbi
(lesioni di competenza dermatologica) si può procedere alla biopsia, per non
sottovalutare la lesione. La prognosi è buona, se scoperta per tempo, anche se
dipende dall’istologia del carcinoma sottostante.
5
Mastite: processo infiammatorio che insorge in seguito all’infezione dei dotti
galattofori. Ne esistono di diversi tipi, il più frequente dei quali è la mastite
puerperale; infatti durante l’allattamento è più facile che la mammella vada incontro
ad infezioni batteriche. Il seno si presenterà dolente alla palpazione con iperemia
cutanea, accompagnati da febbre e leucocitosi. Il trattamento consta di copertura
antibiotica e sospensione dell’allattamento, onde evitare la progressione del processo
ad ascesso mammario.
Nelle donne in menopausa o lontano dall’allattamento, la stessa sintomatologia, deve
fare sospettare la presenza di una mastite carcinomatosa (neoplasia non è limitata ad
un nodulo ma tende alla diffusione), la prognosi logicamente non sarà buona.
Dopo tutto l’iter diagnostico elencato, se ci fossero ancora dubbi, si può eseguire la
Biopsia Chirurgica (il radiologo fornirà un aiuto perché durante l’agoaspirato,
introduce intorno o all’interno del nodulo, del colorante vegetale, che prende il nome
di marcatore o tracciante) in questo modo il chirurgo andrà ad asportare la lesione
messa in risalto.
Oggi queste biopsie vengono eseguite sempre meno perché grazie agli esami la
paziente arriva al chirurgo già stadiata.
STADIAZIONE TNM
Tumore primitivo (T):
T0: nessuna evidenza di tumore primitivo
Tis: carcinoma in situ: carcinoma intraduttale o lobulare in situ, malattia di Paget
del capezzolo senza evidenza del tumore.
T1: tumore con dimensione massima di 2 cm:
T1a < 0.5 cm
T1b da 0.5 a 1 cm
T1c da 1 fino a 2 cm
T2: tumore con dimensione tra 2 e 5 cm
T3: tumore con dimensione > 5 cm
T4: tumore con qualsiasi dimensione, ma con estensione alla parete toracica o
alla cute.
Linfonodi regionali (N):
N0: linfonodi ascellari omolaterali non palpabili
N1: linfonodi ascellari omolaterali coinvolti ma mobili
N2: linfonodi ascellari omolaterali convolti, fissi fra loro o ad altre strutture
N3: linfonodi omolaterali sovraclaveari o infraclaveari, oppure edema del
braccio.
Metastasi a distanza (M):
M0: nessuna evidenza di metastasi a distanza
M1: Presenza di metastasi a distanza
6
La prognosi e la sopravvivenza delle pz cambia profondamente tra i vari stadi,
influenzati soprattutto dal diverso coinvolgimento linfonodale. Il significato della
linfoadenectomia è infatti prognostico e non terapeutico.
Drenaggio linfatico della ghiandola è ricchissimo, infatti si possono considerare 3
vie principali di deflusso: ascellare, interpettorale (linfonodi di Rotter)
e mammaria interna.
La più importante è sicuramente quella ascellare, che viene divisa in 3 livelli, per
standardizzare l’estensione della dissezione ascellare:
1° livello: linfonodi laterali all’inserzione del piccolo pettorale
2° livello: linfonodi retromuscolari
3° livello: linfonodi mediali all’inserzione del muscolo piccolo
pettorale
NB: non necessariamente i tre livelli sono raggiunti nell’ordine dalle metastasi.
Il cavo ascellare si dice che sia composto da 50 linfonodi, ma l’oncologo si
accontenta di una decina per poter programmare le terapie successive.
Un tumore T1 e N0 (stadio1) probabilmente non verrà sottoposto a terapie adiuvanti,
mentre se i linfonodi dovessero risultare positivi allora si deve procedere con la
chemioterapia.
Le metastasi a distanza nel K della mammella interessano soprattutto fegato-ossopolmone-encefalo; per una corretta stadiazione si deve eseguire: scintigrafia ossea,
Rx torace, ecografia epatica e Tc encefalo.
I tumori della mammella presentano spesso dei recettori per gli estrogeni e
progestinici sulle cellule neoplastiche; questo è un fattore importante perché si è visto
che le neoplasie che risultano negative per i recettori degli estrogeni hanno mostrato
una prognosi peggiore, infatti oggigiorno esistono terapie ormonali efficaci da
associare alla chemioterapia e/o radioterapia, o in sostituzione ad esse, che stanno
dando buoni risultati (ex. Tamoxifene = antiestrogeno).
Terapia Chirurgica
La terapia chirurgica è molto cambiata nel corso degli anni, oggi le resezioni sono
sempre più limitate e conservative.
Se la lesione ha una dimensione > di 2 cm , l’oncologo propone un ciclo di
chemioterapia neoadiuvante cioè prima dell’intervento; in tal modo prepara la pz
all’intervento 3 mesi prima, perché questa terapia è in grado di ridurre
significativamente la massa neoplastica. Tanto è vero che per queste dimensioni si
dovrebbe proporre una mastectomia , mentre molte volte le lesioni vengono ridotte a
tal punto che la pz viene sottoposta a intervento di quadrantectomia.
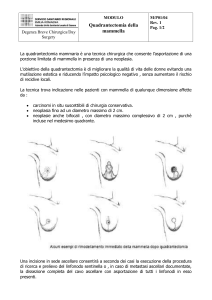
Oggi la maggior parte degli interventi sono di tipo conservativo, cioè la
quadrantectomia che consiste nell’asportazione di un settore di ghiandola mammaria,
che contenga la lesione neoplastica confinata “ben all’interno” del pezzo asportato,
con margini di resezione liberi da malattia. In passato si cercava di ottenere almeno 2
cm di distanza dal tumore, mentre ora ci si accontenta anche di un solo cm;
logicamente si parla dei margini laterali perché quelli profondi e superficiali della
7
mammella, devono essere asportati in tutta la loro profondità, anzi l’asportazione
deve riguardare anche la fascia del muscolo pettorale.
La linfoadenectomia ascellare va condotta cercando di arrivare fin quasi contro la
clavicola facendo attenzione alle strutture anatomiche: vena ascellare (lesioni
accidentali) e nervi (toracico lungo o di Bell e il nervo toraco-dorsale).
L’asportazione dei linfonodi ascellari può portare (<5%) alla sindrome del braccio
grosso, cioè a linfedema dovuto alle alterazioni del circolo linfatico del braccio, che
va trattato con fisioterapia e linfodrenaggio.
La mastectomia è invece l’intervento classico di asportazione della ghiandola in toto
da eseguire per:
Lesioni di notevoli dimensioni
Malattia multicentrica
Ghiandola mammaria di piccole dimensioni
Volontà della paziente
Fino a qualche decennio fa la tecnica utilizzata era quella sec. Halsted (Mastectomia
radicale), che è stata sostituita poi dalla mastectomia radicale modificata, ovvero una
mastectomia totale con l’asportazione dei linfonodi ascellari in continuità con la
ghiandola mammaria asportata. In questo caso viene lasciato indenne il muscolo
grande pettorale con tutti i vantaggi che ne conseguono. Esistono 2 tipi di
mastectomie modificate:
1. Intervento sec. Madden: conservazione di entrambi i
pettorali
2. Intervento sec. Patey: asportazione del muscolo piccolo
pettorale e grande pettorale risparmiato.
Esiste anche un intervento definito “Sistema skeen spearing” ovvero il risparmio di
cute, tecnica che consente, in tempi rapidi e con risultati migliori, la ricostruzione con
protesi (espansore per 5-6 mesi e seguente protesi).
Terapia Radiante
L’escissione chirurgica associata all’irradiazione della mammella residua consente di
ottenere il controllo locale e la cura del carcinoma della mammella , con
sopravvivenza comparabili a quelle dopo mastectomia .
Dopo la chirurgia conservativa si deve sempre associare la radioterapia; di solito
viene eseguita a distanza di 2-3 mesi dall’intervento, sulla ghiandola residua per
evitare l’insorgenza di recidive.
Controindicazioni alla radioterapia:
Malattia multifocale occulta
Pregresse terapie radianti al polmone, parete toracica, mammella
Gravidanza
8
Osservando che il 70% dei cavi ascellari di donne, che non presentavano linfonodi
all’esame clinico, risultavano negativi e sapendo che la linfoadenectomia ascellare
porta spesso a complicanze, si era pensato che forse non era necessario eseguire lo
svuotamento del cavo ascellare in tutte le pazienti.
Prendendo in considerazione la clinica del melanoma e la teoria che le cellule
neoplastiche finiscono per arrivare ad una prima stazione linfonodale, si è pensato
che potesse essere così anche per la mammella e il cavo ascellare; infatti se
riuscissimo ad individuare la prima stazione linfatica, e se questa risultasse negativa,
ci si potrebbe accontentare di asportare solo la ghiandola evitando lo svuotamento del
cavo.
Linfonodo sentinella: è la prima stazione linfoghiandolare che drena il tessuto
neoplastico.
Si da per certo che questa stazione faccia da barriera, cioè che le cellule tumorali non
saltino questo linfonodo.
Tecnica: in principio si impiegava un colorante vitale (blu di metilene) intorno al
tumore, che finiva poi nel linfonodo che risaltava alla vista del chirurgo durante
l’intervento; l’inconveniente però era quello dello spargimento del colorante che
rendeva la tecnica non molto precisa.
Oggi invece si utilizza una tecnica radioisotopica, introducendo intorno alla neoplasia
mdc radioattivo (molecola che non fuoriesce dal linfonodono) il giorno prima o la
mattina prima dell’intervento (devono passare almeno alcune ore). Utilizzando il
tecnezio colloidale marcato il linfonodo viene poi ricercato tramite una gamma
sonda, che viene introdotta nel cavo ascellare e che capterà il contrasto, che sarà
visualizzato mediante un contatore Geigher, e quindi asportato. In questo modo
avendo solo un linfonodo da osservare, il patologo si potrà concentrare meglio sullo
studio, evitando se possibile errori di stadiazione.
A distanza di 7 / 10 giorni arriva la risposta istologica, che se risulta negativa l’iter
terapeutico termina, altrimenti se dovesse risultare positiva bisognerà procedere con
lo svuotamento del cavo ascellare. Oggi questo intervento si esegue
ambulatorialmente, in anestesia locale, in modo tale da arrivare poi, eventualmente
all’intervento vero e proprio solo quando si è in possesso dell’esame istologico
definitivo.
Micrometastasi
Le micrometastasi hanno dimensioni tra 0.2 – 2 mm, mentre le macrometastasi sono
quelle che hanno dimensioni > 2 mm.
In caso di micrometastasi cosa bisogna fare? È necessario fare l’asportazione del
cavo ascellare? Molte volte quando si è in presenza di micrometastasi, i restanti
linfonodi ascellari risultano liberi da malattia. Questo dipende anche dalle dimensioni
delle micrometastasi infatti:
< 1 mm: 16% incidenza di linfonodi positivi
1-2 mm: 36% incidenza di linfonodi positivi
9
> 2 mm (macrometastasi): 64% incidenza di linfonodi positivi
Bisogna comunque tenere sempre presente la regola che all’aumentare delle
dimensioni della neoplasia, aumenta la probabilità dell’invasione linfonodale.
Caso clinico (vedi foto allegate): donna di 54aa, con neoplasia di 1.2 cm (T1c)
sottoposta alla ricerca del linfonodo sentinella, che risulta negativo all’ematossilinaeosina ma positivo per micrometastasi con le citocheratine. Si è proceduto alla
quadrantectomia arrivando fino alla fascia del gran pettorale.
Osservando il pezzo operatorio, non si nota la zona neoplastica marcata col carbone
perché tutta all’interno del pezzo asportato, il che indica che la resezione è stata
ampia e radicale.
Foto dell’intervento, che volge al termine, mostrante il cavo ascellare svuotato del
suo contenuto.
Percentuale di sopravvivenza in risposta allo stadio:
Stadio 1 a 10 anni si aggira sul 90% , poi dal grafico si evidenzia come la
sopravvivenza cala rapidamente all’aumentare dello stadio di malattia.
Terapia adiuvante
L’associazione di chemioterapia o di trattamenti ormonali all’exeresi locale è in
grado di ridurre significativamente l’incidenza di recidive e la mortalità in donne con
carcinoma della mammella operabile e linfoadenopatia ascellare metastatica o in
quelle ad alto rischio senza interessamento linfonodale. Infatti la vasta popolazione
che beneficia della chemioterapia e della terapia ormonale, lo fa perché le metastasi
vengono prevenute, curate o ritardate.
Ormonoterapia: la presenza di recettori per gli estrogeni è indice di maggiore
differenziazione del tumore, infatti la risposta al trattamento raggiunge l’80% circa,
mentre le neoplasie che non presentano questi recettori forniscono una risposta al
trattamento ormonale < del 10%.
Questo tipo di terapia può essere condotta in 2 modi differenti:
1. Metodo chirurgico tramite l’ovariectomia
2. Metodo farmacologico impiegando gli antiestrogeni
Il farmaco più conosciuto e utilizzato è sicuramente il Tamoxifene.
Chemioterapia: l’obiettivo della terapia adiuvante è di eradicare metastasi occulte a
distanza e cellule neoplastiche residue, mentre ancora questi foci neoplastici sono
piccoli a sufficienza da essere vulnerabili agli agenti antitumorali.
Attualmente si pratica la somministrazione di una polichemioterapia, quale ad
esempio
CMF (ciclofosfamide-metotrexate-5.fluoruracile) oppure AC (adriamicinaciclofosfamide) o
10
CAF (ciclofosfamide-adriamicina-5.fluoruracile).
Chirurgia ricostruttiva
La ricostruzione dopo mastectomia può essere eseguita mediante:
1. Tessuto autologo
2. Materiale alloplastico
Indifferentemente dal tipo di ricostruzione si possono avere però delle complicanze,
che portano come conseguenza principale ad un possibile ritardo dell’inizio della
terapia adiuvante. In caso di necrosi totale o parziale del lembo utilizzato per la
ricostruzione, deiscenza della ferita chirurgica e infezione; sia la chemioterapia che la
radioterapia devono così essere rimandate.
La ricostruzione con materiale autologo viene eseguita sfruttando lembi muscolari:
Rotazione del muscolo grande dorsale
Lembo miocutaneo di retto addominale (TRAM)
Muscolo gluteo
Questi muscoli vengono trasposti sulla regione mammaria per ricostruire la salienza
anatomica.
La ricostruzione con materiale alloplastico prevede l’impiego di espansori + protesi o
di sole protesi purchè, come ogni impianto alloplastico, siano collocate al di sotto di
un tessuto spesso ed eutrofico.
“Nelle pazienti sottoposte a mastectomia e posizionamento di espansore, bisogna
essere certi che non ci sia ripresa di malattia perché la radioterapia può essere molto
critica, cioè portare a necrosi e conseguente intervento di rimozione delle protesi”.
Nelle mastectomie oncologiche si deve procedere anche con la rimozione del
complesso areola-capezzolo, che può essere ricostruito mediante:
Pigmentazione con tatuaggio
Recuperando tessuto erettile dalle piccole labbra e
modellandolo a forma di spirale.
Prelevando tessuto dell’areola controlaterale nella
misura del 50% e trasferito con innesto libero.
Negli ultimi anni e “nei centri all’avanguardia”, sta prendendo sempre più piede la
radioterapia intraoperatoria; cioè il trattamento radiante eseguito durante la
seduta chirurgica.
I vantaggi sono sicuramente notevoli in quanto: la paziente non deve essere chiamata
successivamente per il trattamento perché già svolto, inoltre la radioterapia eseguita
in questa modo risulta essere estremamente focalizzata sul campo chirurgico (>
radicalità).
11
12