ALLERGIE ALIMENTARI: STIMOLARE LA RICERCA PER
TUTELARE IL CONSUMATORE
Torino, 9 Novembre 2012
Valutazione della tossicità delle proteine del glutine di
Triticum monococcum nei pazienti celiaci
Maria Mazza, BSc
S.C. Neuroscienze - CEA
S.S. Genetica e Immunobiochimica
Istituto Zooprofilattico Sperimentale del Piemonte, Liguria e
Valle d’Aosta
LA CELIACHIA
La malattia celiaca è una malattia infiammatoria cronica immuno-mediata
Ingestione del glutine presente nelle farine di grano, orzo e segale
Può manifestarsi a qualsiasi età con ampio spettro di manifestazioni cliniche
Esistono diverse forme cliniche:
•forma tipica o classica;
•forma atipica;
•forma silente;
•forma latente
Forma tipica o classica
• Esordio della malattia nei primi mesi di vita (6°-15°mese)
• Quadro clinico: diarrea cronica, inappetenza, rallentamento della crescita, perdita di
peso, ipotonia muscolare, irritabilità. Alterazioni della mucosa intestinale.
Forma atipica
• Sintomatologia extra-intestinale
• Manifestazioni cliniche secondarie al malassorbimento: anemia, bassa statura, rachitismo,
displasia dello smalto dentario, dolori addominali ricorrenti, ritardo
puberale, aftosi
recidivante, stipsi, ipertransaminasemia idiopatica, sindromi emorragiche, alopecia.
Forma silente
• Presenza delle tipiche lesioni istologiche della mucosa intestinale
• Forma apparentemente asintomatica
Forma latente
•Soggetti asintomatici con mucosa intestinale normale ma con marcatori anticorpali positivi.
Complicanze
Nel caso di diagnosi tardiva o per mancato trattamento possono presentarsi
diversi problemi piuttosto gravi a carico di diversi apparati, quali:
• gastroenterico
(linfoma)
• osteoscheletrico (osteoporosi, osteomalacia)
• genitale femminile (infertilità, poliabortività)
Diagnosi
Markers sierologici:
• ricerca di anticorpi anti-gliadina (AGA)
• ricerca di anticorpi anti-endomisio (IgA-EMA)
• ricerca di anticorpi anti-transglutaminasi tessutale (IgA-tTG)
Biopsia intestino tenue
Diagnosi definitiva
Esame istologico
Soggetto sano
Soggetto celiaco
Assenza villi
villi
cripte
cripte
Totale o parziale atrofia dei villi con perdita dell’orletto a spazzola;
ipertrofia delle cripte; aumentato numero dei IEL;
infiltrazione nella lamina propria di cellule infiammatorie .
Epidemiologia della celiachia
La malattia celiaca coinvolge tra lo 0.5% e l’ 1% della popolazione mondiale.
Patologia ancora sottodiagnosticata
Modello ad iceberg della celiachia
diagnosticato
non diagnosticato
GLUTEN FREE DIET
Frumento,
Orzo,
Avena,
Farro,
Spelta, Triticale.
Segale,
Kamut,
NO
pane, pasta, prodotti da forno,
birra,alimenti “lavorati” (gelati,
salumi)
Amaranto, grano saraceno,
riso,mais, miglio, sesamo, sorgo
tapioca,castagna patata, legumi,
latte, uova, formaggi,
prodotti da forno preparati con
proteine alternative a quelle del
glutine
SI
La spiga di grano barrata
compare sulla confezione
degli alimenti e bevande
privi di prolamine tossiche
(≤ 20ppm).
Basi genetiche della celiachia
Associazione con alcune varianti del complesso HLA
(Human Leucocyte Antigen)
La predisposizione alla celiachia si correla con la presenza degli alleli
DQA1*05 e DQB1*02
APC
catena β
DQB1*02
catena α
DQA1*05
HLA-DQ2
~ 90% celiaci
catena β
DQB1*0302
catena α
DQA1*03
HLA-DQ8
~ 6% celiaci
DQA1*05 e DQB1*02 sono alleli comuni nella popolazione sana , quindi la presenza delle
molecole HLA-DQ2 o DQ8 rappresenta una condizione necessaria ma non sufficiente.
Probabile coinvolgimento di altri geni e/o altri fattori.
Eziologia
Prolamine:ricche di prolina e
glutamina
Glutenine - elasticità
Gliadine - estensibilità
Gliadine: frazione alcool-solubile coinvolta nella patogenesi della celiachia
Glutenine: frazione idro-solubile poco coinvolta nella tossicità
Gliadine
Costituiscono il 40% delle proteine di riserva della cariosside
A-PAGE
Caratteristiche principali
monomeriche
solubili in alcool (etanolo)
distinte in tre famiglie (ω, γ e α/β)
p.m. compreso tra 28 e 70 kDa
ω
γ
α/β
1
2
3
4
Glutenine
HMW
SDS-PAGE
A
D
LMW
B
C
1
2
3
4
5
Caratteristiche principali
polimeriche, HMW (80-130 kDa) e LMW
(10-70 kDa)
idro-solubili
distinte in 4 gruppi:A (HMW);
D, B e C (LMW)
Prolamine
Glutenine
Gliadine
Prolamine (ricche di prolina e glutamina)
epitelio int. celiaco
Proteasi
Azione tossica
2-5 kDa
Zonulina
Patogenesi della malattia celiaca
Attività citotossica
Sistema immunitario innato
Patogenesi della malattia celiaca
Attività immunogenica
Sistema immunitario adattativo
PNAS October 14, 2003 vol. 100 no. 21
The HLA-DQ2 gene dose effect in celiac disease is directly related to the magnitude
and breadth of gluten-specific T cell responses
Willemijn Vader†, Dariusz Stepniak†, Yvonne Kooy†, Luisa Mearin‡, Allan Thompson†, Jon
J. van Rood†, Liesbeth Spaenij†, and Frits Koning†§
Soglia patologica
Il numero di peptidi che interagiscono con i recettori HLA-DQ2 o
HLA-DQ8 nella mucosa intestinale e l’intensità della risposta delle
cellule T indotta da ciascun peptide prolaminico determinano una
soglia che deve essere superata affinchè in un individuo
geneticamente predisposto alla celiachia si abbia una reazione
immunitaria patologica verso le proteine del glutine.
Test in vitro
Utilizzo di colture in vitro per studiare gli effetti dell’esposizione alle prolamine
e i meccanismi cellulari e molecolari della celiachia
IMMUNITA’ INNATA
Cellule K562(S)
(mieloma leucemico umano)
Agglutinazione
Minimal
Agglutination
Concentration
Cellule Caco2
(adenocarcinoma umano)
Riduzione
resistenza
elettrica
transepiteliale
Attivazione
apoptosi
Crescita epiteliale simile
alla mucosa in testinale
Test in vitro
IMMUNITA’ ADATTATIVA
• Proliferazione cellulare
• Secrezione INF-γ
Linfociti T prelevati dalla
mucosa di pazienti celiaci
Peptidi tossici
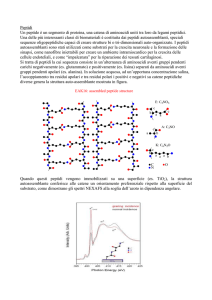
Esistono numerose sequenze peptidiche coinvolte nei processi di tossici
Peptide 13-mer LGQQQPFPPQQPY (31-43 α-gliadina o A-gliadina), molto
attivo nell’indurre lesioni della mucosa intestinale e apoptosi dell’enterocita
(peptide citotossico). Questo peptide o la sua variante PGQQQPFPPQQPY è
presente in molte delle sequenze α-gliadine
Peptide
33-mer
LQLQPFPQPQLPYPQPQLPYPQPQLPYPQPQPF
presente nel grano tenero e contiene tre epitopi immunodominanti lunghi 11, 12 o
13 aa noti come DQ2-a-I (LQPFPQPQLPY), DQ2-a-II (PQPQLPYPQPQL) e
DQ2-a-III (QLPYPQPQLPYPQ) che reagiscono fortemente
intestinali di tutti i pazienti celiaci (peptide immunogenico).
con i linfociti T
Peptide protettivo
Peptide 10-mer QQPQDAVQPF (~1,2 kDa), isolato tra i peptidi
prolaminici
della
varietà
di
grano
duro
Adamello,
previene
l’agglutinazione delle cellule K562 (S) causata dalle prolamine di grano
tenero, grano spelta e di alcune accessioni di farro.
Azione protettiva legata: 1. alla presenza di acido aspartico (D) in pos. 5;
2. alla presenza dell’alanina (A) in posizione 6.
I residui di aspartato e alanina competono per il legame con le APC e
blocco della risposta immunitaria.
Triticum monococcum
E’ un frumento diploide a cariosside vestita con genoma AA (2n=14).
Rappresenta una varietà antica di frumento coltivata attualmente su
poche centinaia di ettari in aree remote della regione mediterranea.
Caratteristiche peculiari di questa varietà sono:
1.
grande resistenza a stress ambientali e a vari patogeni;
2. elevato valore nutrizionale (maggiore contenuto
carotenoidi, vitamina E, lipidi, zinco e ferro);
3. migliore tollerabilità alimentare delle prolamine
in
proteine,
Ricerca Corrente IZS PLV 14/10
Obiettivi
Valutare la presenza ed il numero di peptidi tossici in
alcune varietà di grano monococco attraverso studi
immunobiochimici e test di tossicità in vitro.
Selezionare linee di monococco tollerate dai celiaci ma
soprattutto di ridurre l’esposizione della popolazione umana
alle proteine tossiche del glutine
Unità Operative coinvolte
1. S.S. Genetica e Immunobiochimica (IZSPLV); Dr.ssa M. Mazza;
2. CRA-QCE; Dr. Norberto Pogna;
3. Ospedale “G. Gaslini” di Genova; Dr. Giovanni Candiano.
Materiali e metodi
Varietà di grano monococco: Stendhal, Monlis e ID331
1.Estrazione e purificazione delle proteine del glutine dalle tre linee di
grano monococco.
2.Separazione elettroforetica bidimensionale (A-PAGE x SDS-PAGE)
delle proteine estratte.
3.Identificazione immunologica mediante Western Blot degli epitopi
prolaminici immunodominanti.
4.Identificazione mediante spettrometria di massa degli spot proteici
immunodominanti.
5.Valutazione della tossicità dei pepetidi prolaminici in vitro su cellule
K562(S) e linfociti T di mucosa intestinale umana.
Risultati immunobiochimici
Assenza nelle tre linee di monococco del peptide 13mer (P31-43) con attività citotossica.
Presenza di diversi peptidi con sequenza simile al
peptide 33-mer con attività immunogenica.
Assenza del peptide protettivo 10-mer.
Citotossicità
Stendhal e ID331 non risultano tossici verso la mucosa
celiaca, eccetto il Monlis che sembra comportarsi come il
frumento tenero.
Citotossicità del Monlis associata a peptidi diversi dal 13mer.
Presenza nel monococco di peptidi protettivi diversi dal
peptide 10-mer.
Triticum monococcum
Dal sequenziamento dei geni delle ω-gliadine di monococco, è stata
individuata una sequenza codificante un peptide di 9 aa, con sequenza
simile a quella ritrovata in grano duro varietà Adamello:
Adamello
Monococco
QQPQDAVQPF
QQPQRPQPF
Sebbene siano leggermente diverse, queste sequenze sono accomunate
dalla presenza di aa carichi in posizione centrale.
Se questo peptide viene somministrato in combinazione con le prolamine
di grano tenero, viene ridotta la produzione di IL-15 (responsabile
dell’effetto citotossico sulle cellule della mucosa intestinale).
Perché alcune linee di monococco non scatenano l’immunità innata?
Dall’analisi elettroforetica A-PAGE delle tre linee si osserva che Monlis è priva di
ω-gliadine, Stendhal presenta 4 bande che, in seconda dimensione, si risolvono in
c.ca 13 spot e ID331 presenta una sola banda che si risolve, in seconda dimensione,
in un solo spot a basso peso molecolare.
1. Stendhal
2. Monlis
3. ID 331
Stendhal
ID331
Triticum monococcum
I digesti PT-gliadinici delle tre accessioni di monococco sono stati testati sulle
cellule K562 e su espianti bioptici del duodeno di pazienti celiaci in remissione:
I digesti di Monlis hanno lo stesso comportamento dei digesti del grano
tenero, sono quindi in grado di agglutinare le cellule K562 e stimolare l’immunità
innata.
I digesti di ID331 non agglutinano le cellule K562 e non sono in grado di
stimolare l’immunità innata
La proprietà “protettiva” di ID331 è dovuta
all’ω-gliadina, assente in Monlis?
Ringraziamenti
Laboratorio Fisiopatologia
dell’Uremia
Giovanni Candiano
Unità di Ricerca per la Valorizzazione
Qualitativa dei Cereali (QCE) di Roma
Norberto Pogna
SS Genetica e Immunobiochimica
Pier Luigi Acutis
Simona Carrella
Grazie a tutti per l’attenzione