ottobre 2015
Diagnostic
Update
Ipotiroidismo nel cane
L’ipotiroidismo è un’endocrinopatia frequente nel cane. La diagnosi corretta in alcuni pazienti è
complessa, poiché la malattia può decorrere in modo silente nel corso degli anni e la manifestazione
clinica è altamente variabile. Inoltre, tutti i test diagnostici di laboratorio disponibili presentano dei limiti.
In particolare possono condizionare l’esito del test la presenza di altre malattie e l’uso condi farmaci,
rendendo potenzialmente difficile la corretta interpretazione. La sola diminuzione della concentrazione
di T4 totale (TT4) non basta a confermare una diagnosi di ipotiroidismo.
Eziologia
In base alla sede del disturbo all’interno dell’asse ipotalamoipofisi-tiroide possiamo differenziare 3 forme di ipotiroidismo
acquisito.
Ipotiroidismo primario
Più del 95% dei casi di ipotiroidismo acquisito nel cane è
riconducibile a una riduzione della sintesi e del rilascio degli
ormoni tiroidei in sede tiroidea.
Nella maggioranza dei casi, questo è dovuto a una tiroidite
linfocitaria (circa il 50 %) (Graham et al. 2007) oppure a
un’atrofia idiopatica. Negli animali con tiroidite linfocitaria
si osserva un’infiammazione immunomediata della tiroide e
la presenza di autoanticorpi anti-tireoglobulina (anti-TG) e, in
alcuni casi, di anticorpi anti-T3 e T4. La progressiva distruzione
dovuta allo stato infiammatorio del follicolo tiroideo è un processo lento, i cui sintomi clinici si manifestano solo quando è
distrutto più del 75 % del parenchima.
Nei casi di atrofia idiopatica si osserva la sostituzione del tessuto funzionale tiroideo con tessuto connettivo e la presenza
di autoanticorpi anti-TG non è evidenziabile. Non è del tutto
chiaro se si tratti di un processo patologico autonomo o dello
stadio finale di una tiroidite linfocitaria (Scott-Moncrieff 2015).
Altre cause da citare sono le neoplasie e l’iperplasia adenomatosa che peró sono molto più rare.
Partendo dal presupposto che l’atrofia idiopatica rappresenta
lo stadio finale della tiroidite linfocitaria, si possono distinguere 4 diversi stadi nella patogenesi di un ipotiroidismo
atrofico (Graham et al. 2007):
1. T
iroidite subclinica
Assenza di sintomi clinici
Positività agli anti-TG, TT4 nell’intervallo di riferimento,
TSH < 0,5 ng/ml
2. Ipotiroidismo subclinico
Assenza di sintomi clinici
Tiroide distrutta per il 60 – 70 % circa
Positività agli anti-TG, TT4 nell’intervallo di riferimento,
livelli aumentati di TSH
3. Ipotiroidismo positivo agli anticorpi
Sintomi clinici
Tiroide distrutta per il 75 % circa
Anti-TG evidenziabili, livelli ridotti di TT4, livelli
aumentati di TSH
4. Ipotiroidismo atrofico non infiammatorio
Sintomi clinici evidenti
Tessuto tiroideo sostituito da tessuto adiposo e connettivo
Anti-TG non (più) evidenziabili, livelli ridotti di TT4,
livelli aumentati di TSH
L’ipotiroidismo secondario (ridotto rilascio di TSH dall’ipofisi)
è una forma molto rara di ipotiroidismo (<5 %). Le cause riportate sono: ipoplasia ipofisaria con nanismo ipofisario, traumi,
formazioni neoplastiche o alterazioni cistiche (Scott-Moncrieff
2015).
La diagnosi di ipotiroidismo secondario o ipofisario è molto
complessa, poiché la sensibilità diagnostica del test per il TSH
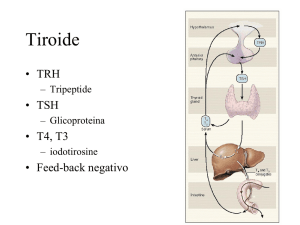
Ipotalamo
–
TRH
Ipofisi
TSH
T4
T4
Tiroide
T4
Proteine
T4
T4
fT4
fT3
T3
T3
T3
Proteine
T3
T3
Circolazione
Tessuto
fT4
fT4
fT3
fT3
modificato secondo: Manual of Small Animal Endocrinology 1998
attualmente disponibile non è sufficiente ai fini della differenziazione tra concentrazioni di TSH fisiologiche e concentrazioni
molto basse. Pertanto, non è da escludere che la frequenza
di ipotiroidismo secondario nei cani sia superiore a quanto si
sospetti (Scott-Moncrieff 2015).
L’ipotiroidismo terziario (ridotto rilascio di TRH dall’ipotalamo) è stato descritto in letteratura una sola volta come case
report (Shiel et al. 2007).
L’ipotiroidismo congenito è raro nel cane, anche se è possibile
che l’incidenza effettiva sia sottostimata, poiché spesso esita
nella morte prematura dei cuccioli interessati (Scott-Moncrieff
2015).
Regolazione
La sintesi e il rilascio degli ormoni tiroidei sono sotto il controllo
del TSH, prodotto dal lobo ipofisario anteriore (adenoipofisi),
che, a sua volta, è regolato dall’ipotalamo attraverso il rilascio
di TRH.
Sotto l’effetto del TSH si osserva un aumentato rilascio di T3
e T4 dalla tiroide. Il T4 viene sintetizzato nella tiroide, mentre
il T3 si forma per l’80 % circa in regione periferica nelle cellule
target attraverso un meccanismo di deiodazione. Gli ormoni
tiroidei sono legati in circolo alle proteine plasmatiche. Solo
una minima parte (circa l’1 %) è libera e rappresenta la frazione metabolicamente attiva degli ormoni tiroidei (T3 libero
(fT3) e T4 libero (fT4)). Solo fT3 e fT4 sono responsabili del feedback negativo sull’ipofisi e sull’ipotalamo. Se la concentrazione degli ormoni tiroidei liberi in circolo diminuisce, l’assenza di
feedback negativo determina un aumento della sintesi di TSH
nell’ipofisi.
Quadro clinico
L’ipotiroidismo è una malattia che colpisce il cane in età
adulta-geriatrica, anche se, in alcune razze predisposte, i sintomi possono insorgere prima. Il sesso o la castrazione non
hanno alcun effetto sull’esordio della malattia. Sono interessati
da questa patologia soprattutto i cani di taglia medio-grande.
Nella letteratura anglo-americana le razze predisposte sono i
Golden Retriever, i Labrador Retriever e i Dobermann (ScottMoncrieff 2015) ma, nella tipologia di pazienti dell’Università di
Zurigo, tale predisposizione di razza non ha trovato conferma
(Boretti et al. 2003).
I sintomi clinici di ipotiroidismo sono vari e rispecchiano sia
i diversi effetti degli ormoni tiroidei sul metabolismo nel suo
complesso sia la loro influenza su molteplici sistemi e organi.
Alla base vi sono alterazioni metaboliche (letargia, aumento
ponderale, intolleranza all’esercizio, intolleranza al freddo),
circa l’80 % dei pazienti evidenzia alterazioni dermatologiche
(modificazioni della struttura o del colore del pelo, alopecia,
ipertricosi, seborrea, otite esterna ...).
A causa della lenta progressione della malattia, i vari cambiamenti non vengono rilevati tempestivamente dal proprietario
del cane e vengono correlati al processo di invecchiamento
fisiologico.
In casi isolati insorgono anche sintomi neurologici, che sono
stati riportati da soli o in associazione ad altri sintomi di ipotiroidismo (Cizinauskas et al. 2000).
Il sistema nervoso periferico può essere coinvolto (neuropatia
periferica come paresi o paralisi, sindrome vestibolare periferica, paresi facciale, megaesofago) così come il sistema
nervoso centrale (coma da mixedema, crisi epilettiformi).
Attualmente la correlazione causale diretta tra neuropatia
periferica e ipotiroidismo è messa in discussione, perché in
un modello sperimentale di ipotiroidismo non è stato possibile
riprodurre una neuropatia periferica (Rossmeisl 2010).
D’altro canto in letteratura sono riportati casi in cui, dopo
somministrazione di T4, le crisi neurologiche scomparivano
(Scott-Moncrieff 2015).
Più volte, invece, è stata documentata la presenza di una
miopatia, caratterizzata da aumentati livelli di CK, AST e LDH.
Tali alterazioni contri-buiscono presumibilmente all’intolleranza
all’esercizio che si riscontra nei soggetti ipotiroidei. Raramente
si osservano sintomi gastrointestinali, cardiaci e oculari.
Disturbi di fertilità sono stati descritti nella cagna (Pancierra
et al. 2012).
Diagnosi
Alterazioni dei parametri ematologici e
chimico-clinici nel cane ipotiroideo
L’alterazione più frequente è una marcata ipercolesterolemia
e ipertrigliceridemia a digiuno (Boretti et al. 2003, Mooney et
al. 2012).
I livelli di fruttosamine sono spesso vicini al limite superiore
dell’intervallo di riferimento o comunque superiori alla norma
a fronte di una euglicemia. La causa è da ascriversi a una più
lenta metabolizzazione delle fruttosamine nel paziente ipotiroideo (Reusch et al. 2002).
Circa il 50 – 70 % dei cani ipotiroidei evidenzia un’anemia
lieve, al limite moderata, non rigenerativa. Sullo striscio si
possono riscontrare leptociti (Panciera 2001).
•Trigliceridi Û
•Colesterolo Û
•Fruttosamine Û
•Anemia lieve, non rigenerativa •Creatinchinasi (CK) Û
Û
•Enzima epatico (50 – 88 %)
(70 – 80 %)
(~ 70 %)
(50 – 70 %)
(30 – 35 %)
(~ 30 %)
Fattori che influenzano la concentrazione basale di
TT4, fT4 e TSH
Williamson et al. 2002, Daminet et al. 2003, Scott-Moncrieff 2015
Fattori
TT4
fT4
TSH
Età: <
3 mesi
> 6 anni
Û
Ü
Peso: <
10 kg
> 30 kg
Û
Ü
Razza:
(per es. levriero)
Ü
Obesità
Û
Digiuno
Ü
=
Sforzo fisico
intenso
Û
=
Ü
Gestazione
(progesterone)
Û
Carprofene
Ü
=oÜ
Ü
Aspirina
Ü
=oÜ
=
Glucocorticoidi
Ü
=oÜ
=oÜ
Furosemide
Ü
Metimazolo
Ü
Ü
Û
Fenobarbital
=oÜ
=oÜ
=oÛ
Fenilbutazone
Ü
Sulfamidici
Ü
Ü
Û
Integrazione di iodio
Ü
Ü
Û
Autoanticorpi anti-T4
ÛoÜ
in base
al test
utilizzato
fT4 dosaggio Solo se
immunoanche
logico: ÛfT4 ipotiroideo
(procedura
dialitica):
nessun
effetto
Ü
Panciera 2001, Boretti et al. 2003, Mooney 2012, Scott-Moncrieff 2015
Test per la valutazione della funzione tiroidea
Prima della determinazione degli ormoni tiroidei
e del cTSH è essenziale:
•escludere malattie non tiroidee (NTI)
•raccogliere un’anamnesi farmacologica accurata, poiché le
concentrazioni di ormoni tiroidei e i livelli di TSH subiscono
gli effetti di numerosi farmaci.
In particolare i sulfamidici possono determinare, a livello
clinico ed emato-biochimico, un quadro di ipotiroidismo.
Nell’ambito di studi sperimentali sugli animali (Williamson et al.
2002) è stato possibile dimostrare che i sulfamidici inibiscono
la perossidasi tiroidea e, di fatto, determinano una riduzione
della sintesi degli ormoni tiroidei, con il risultato che, a fronte
di un calo di concentrazione del T4 complessivo e a titolo
compensatorio, si determina un aumento della sintesi e del
rilascio di TSH.
La concentrazione di T4 totale (TT4)
La concentrazione di T4 totale (TT4) comprende la quota di
ormone libero (fT4) e quella legata a proteine (T4). Il T4 fisiologico viene prodotto, diversamente dal T3, esclusivamente
in sede tiroidea e pertanto è un parametro molto utile ai
fini dell’esclusione della presenza di ipotiroidismo, poiché
solo una percentuale minima di cani affetti da ipotiroidismo
evidenzia concentrazioni di TT4 all’interno dell’intervallo di
riferimento (elevata sensibilità) (Scott-Mon-crieff 2015).
Valori al di sotto dell’intervallo di riferimento non confermano
la presenza dii ipotiroidismo (bassa specificità), poiché
esistono svariate altre cause (variazioni naturali, un calo
ponderale dovuto all’invecchiamento, la correlazione con la
razza, altre malattie concomitanti e molti farmaci) che possono determinare una riduzione della concentrazione di T4.
Anche la somministrazione topica di glucocorticoidi può in
breve tempo dare origine a un calo di questo valore
(Gottschalk et al. 2011).
In presenza di autoanticorpi anti-TT4 esiste l’eventualità che si
determinino valori di TT4 falsamente alti o bassi indotti dalle
interferenze sul test, in base al singolo metodo. In particolare
valori falsamente elevati possono determinare un mancato
riconoscimento di ipotiroidismo, poiché, a causa dell’interferenza nel test, i valori TT4 risultano nell’intervallo di riferimento.
Nel cane ipotiroideo gli autoanticorpi T4 compaiono con una
percentuale dell’8 %, rispetto a quelli verso T3 (28 %) (Graham
et al. 2007).
Qualora si rilevino livelli elevati di TT4 in un cane che non
manifesta sintomi clinici di ipotiroidismo, si consiglia di raccogliere con urgenza l’anamnesi alimentare. Spesso, a seguito
di somministrazione di alimenti crudi da frattaglie con trachea
essiccata, si può verificare un aumento della concentrazione
di TT4 (Köhler et al. 2012).
T4 libero
Il T4 libero (fT4) è la forma metabolicamente attiva, non legata
a proteine, del TT4 ed è responsabile del feedback negativo
sul rilascio di TSH dall’ipofisi. Poiché l’fT4 rappresenta la forma
attiva del T4, sono state riposte grandi speranze nella determinazione dell’fT4. Tuttavia è emerso che anche la concentrazione di T4 libero (fT4) legata all’uso di farmaci e alla presenza di
malattie non tiroidee subisce degli effetti, anche se non nella
stessa misura del TT4.
Ai fini della determinazione di fT4 esistono due procedure di
misurazione diverse dal punto di vista metodologico e del
principio:
Procedura analogica (dosaggi immunologici)
Questo metodo ha dimostrato che il veterinary-tT4-Assay utilizzato da IDEXX Laboratories ha un’ottima concordanza con i
risultati ottenuti mediante la procedura dialitica di fT4 (ScottMoncrieff 2014). Solo in presenza di autoanticorpi anti-T4 le
procedure dialitiche sono superiori al veterinary-fT4, poiché
non comportano un’interferenza nel test. Altri tipi di test usati
in medicina umana sono, in linea di principio, sconsigliabili
(Scott-Moncrieff 2014).
Procedura dialitica
Nella procedura dialitica il T4 legato alle proteine è trattenuto
da una membrana semipermeabile, che solo l’fT4 riesce ad
attraversare. Il Dialysat misura i livelli di fT4 mediante RIA. La
determinazione della concentrazione di fT4 mediante procedura dialitica è consigliabile in pazienti con sospetta presenza
di autoanticorpi anti-T4, poiché solo questa procedura consente di ottenere il valore corretto relativo alla concentrazione
di fT4 (Scott-Moncrieff 2014). Questa procedura molto complessa è attualmente disponibile in Europa presso il Laboratorio
di riferimento IDEXX
cTSH
Una riduzione degli ormoni tiroidei in circolo determina
un aumento della secrezione di TSH dall’ipofisi attraverso
l’eliminazione del meccanismo di feedback negativo.
In presenza di un’anamnesi e sintomatologia compatibili
è sufficiente, in molti casi, rilevare l’insorgenza comune
di un calo della concentrazione di TT4 e un aumento del
TSH, al fine di formulare la diagnosi di ipotiroidismo.
Tuttavia, circa il 30 % dei cani ipotiroidei non mostra un aumento di TSH (Scott-Moncrieff 2014).
Attualmente, si discute sull’eventualità che la forma secondaria di ipotiroidismo (riduzione della sintesi e della secrezione
di TSH) sia sottovalutata, (Scott-Moncrieff 2015). Inoltre, si
suppone che, con il saggio altamente specifico per il TSH,
non tutti gli isomeri del TSH siano rilevati (Boretti et al.2015).
Anche le variazioni nella secrezione del TSH dovute ad
un esaurimento dell’ipofisi in presenza di ipotiroidismo di
lunga durata (Diaz-Espineira et al. 2008) o ad un mixedema
ipofisario sono in corso di valutazione quali possibili cause
(D. C Ferguson 2007).
IL TSH può subire un aumento anche in assenza di ipotiroidismo clinicamente rilevante. Si tratta di un fenomeno che interviene in corso di convalescenza da una malattia non tiroidea,
in presenza di ipotiroidi-smo subclinico (TT4, fT4D nell’intervallo
di riferimento, TSH) e dopo somministrazione di alcuni
farmaci, in particolare sulfamidici o trilostano (Williamson et
al. 2002, Boretti et al. 2015).
T3
Il T3 viene prodotto dalla tiroide solo in quantità minima, ma la
gran parte origina da deiodazione da T4 nelle cellule target.
In presenza di ridotta produzione di T4 si determina spesso, a
titolo compensatorio, un aumento della conversione da T4 in T3
(forma ormonalmente attiva, ad azione più rapida). Nel cane
ipotiroideo, la concentrazione di T3 risulta spesso all’interno
dell’intervallo di riferimento. La valutazione dei livelli di T3 ai
fini della diagnosi di ipotiroidismo ha, di conseguenza,scarsa
utilità.
Anticorpi anti-tireoglobulina (anti-TG)
In conseguenza della tiroidite linfocitaria si rileva di frequente
la presenza di anticorpi anti-tireoglobulina, che sono indicativi
di processi patologici in corso a carico della tiroide.
Tuttavia, la presenza di anticorpi non è utile per dimostrare un
disturbo della funzionalità tiroidea, poiché la loro esistenza è
stata rilevata anche in cani eutiroidei e, d’altro canto, non sono
evidenziabili nella fase finale di una tiroidite o in presenza di
atrofia idiopatica della tiroide.
L’assenza di anti-TG non esclude, dunque, una diagnosi di
ipotiroidismo e un esito di positività non ne implica necessariamente la presenza. Nell’ambito di uno studio è stato possibile
dimostrare che circa il 20 % dei cani positivi agli anti-TG aveva
sviluppato ipotiroidismo nell’arco di un anno, ma al contempo
circa il 15 % dei pazienti sono tornati nuovamente negativi agli
anti-TG nel medesimo lasso di tempo (Graham et al. 2007).
Aumentate concentrazioni di anticorpi anti-tireoglobulina
possono indicare la presenza di una tiroidite linfocitaria in
stadio precoce. Inoltre è stato possibile dimostrare che i cani
con autoanticorpi anti-T4 evidenziano al contempo anticorpi
anti-TG nel 95 % dei casi (Graham et al. 2007).
La determinazione di questo parametro aggiuntivo può
contribuire a chiarire l’eziologia o confermare la diagnosi di
ipotiroidismo come “test di seconda linea”. Esiste la possibilità
che emergano falsi positivi, in particolare subito dopo una
vaccinazione o dopo un’infezione virale.
Test di stimolazione con TSH
Il test di stimolazione con TSH è basato sull’induzione della
tiroide mediante somministrazione di una dose sovrafisiologica di TSH e in tal modo sulla valutazione della capacità
di riserva. Poiché il TSH bovino non è più disponibile per uso
farmacologico, è necessario ricorrere all’uso di TSH umano
ricombinato. Il gruppo di lavoro dell’Università di Zurigo
(Boretti et al. 2009) ha potuto dimostrare che, nell’impiego di
una dose nettamente più alta (150 µg/cane) di quella descritta
finora, è stato possibile differenziare correttamente tra ipotiroidismo effettivo e NTI in un numero superiore di pazienti.
Esecuzione del test:
•Prelievo di sangue e determinazione della concentrazione
basale di T4
• Somministrazione (im o ev) di 150 µg rh TSH
• Prelievo di sangue dopo 6 ore e determinazione
della concentrazione di T4
Interpretazione:
T4 post-TSH:
un valore <19,3 nmol/l (1,5 µg/dl) è indicativo di ipotiroidismo
T4 post-TSH:
un valore >32,2 nmol/l (2,5 µg/dl) e un aumento minimo di
1,5 volte il valore basale sono prova di una stimolazione
sufficiente.
Terapia
Per quanto concerne l’approccio terapeutico all’ipotiroidismo,
esso prevede la somministrazione giornaliera di L-tirosina
sintetica per via orale, con indicazioni di dosaggio comprese
tra 10 e 20 µg/kg da una a due volte al giorno in base al
produttore. Nel Consensus Statement del 1996 si consiglia
una dose iniziale di L-tirosina pari a 20 µg/kg due volte al
giorno.
La biodisponibilità mostra un’elevata variabilità individuale e si
esprime con una percentuale compresa tra il 10 % e il 50 %,
in funzione dell’orario dei pasti. Alla luce di tali considerazioni
la compressa deve essere somministrata sempre, per quanto
possibile, prima o dopo i pasti (Scott-Moncrieff 2014). La dose
iniziale massima è 800 µg/cane. In pazienti cardiopatici o nei
cani affetti da concomitante nefropatia o epatopatia la dose
iniziale è da ridursi alla metà o a un quarto e da aumentarsi
successivamente (Scott-Moncrieff 2015).
Monitoraggio terapeutico
Il primo controllo è previsto dopo 4 – 8 settimane dall’inizio
della terapia in base al quadro clinico e alla concentrazione di
TT4 nel sangue. In quasi tutti i pazienti, già dopo questo primo
intervallo temporale, ci si aspetta di rilevare un sensibile
aumento della funzionalità e una normalizzazione dei
parametri chimico-clinici di laboratorio fuori norma (ScottMoncrieff 2015).
Per il monitoraggio della dose di L-tirosina si effettua un
prelievo di sangue dopo 4 – 6 ore dalla somministrazione
della compressa e contestualmente si determina la concentrazione di TT4. L’obiettivo è raggiungere una concentrazione di TT4 nell’intervallo di riferimento superiore
o lievemente al di sopra (Scott-Moncrieff 2015). Trattasi
di un valore indicativo, poiché il calcolo del target definitivo è effettuato su base individuale e in considerazione
dell’obiettivo clinico della terapia nonché del singolo
quadro, per esempio la presenza di altre patologie o la
somministrazione di altri farmaci (Scott-Moncrieff 2014).
Se, in sede di formulazione della diagnosi, la dose di TSH
risulta aumentata, allora anche il controllo e la determinazione parallela del TSH ha un senso. Qualora l’integrazione
risulti sufficiente, si prevede che la concentrazione di TSH
rientri nella norma. Poiché la sensibilità diagnostica del
test con TSH non consente, purtroppo, di misurare correttamente concentrazioni di TSH molto basse, la determinazione della concentrazione di TSH non può comunque
rilevare casi di integrazione eccessiva. Se la terapia con
L-tirosina prevede una sola somministrazione giornaliera, il
prelievo di sangue per la determinazione dei livelli di TT4 e
di TSH si effettua subito prima della successiva assunzione
della compressa. In tal senso l’obiettivo è raggiungere una
concentrazione di TT4 all’interno dell’intervallo di riferimento
(Scott-Moncrieff 2015).
Qualora sia necessario modificare la dose, il successivo
controllo terapeutico sarà fissato dopo 4 – 8 settimane.
Se gli esami del paziente evidenziano la presenza di
autoanticorpi T4, è necessario procedere al monitoraggio
mediante procedura dialitica a causa dell’interferenza nel
test rispetto a fT4.
Se la diagnosi di ipotiroidismo è corretta, quasi tutti i
sintomi clinici sono reversibili con una terapia adeguata.
Un’aumentata attività fisica e un diverso comportamento
sono rilevabili già entro la prima settimana. La normalizzazione dei parametri di laboratorio fuori norma (per es. ipercolesterolemia) è prevista dopo 2 – 4 settimane. Il miglioramento delle anomalie dermatologiche e neurologiche
richiede, invece, fino a 3 – 4 mesi di tempo (Scott-Moncrieff
2015).
Qualora persistano alcuni sintomi sebbene sia stata
impostata una terapia adeguata, occorre rivalutare
attentamente la diagnosi di ipotiroidismo.
Dr. med. vet. Elke Huisinga
Specialista dei piccoli animali
Key Account Manager
IDEXX Laboratories
Diagnostic
Update
Sospetto
ipotiroidismo
Esclusione di altre patologie
(nessuna indicazione emersa dalle analisi ematologiche,
chimico-cliniche e dall’analisi delle urine)
Per quanto possibile, nessuna terapia farmacologica nelle ultime 4 – 6 settimane
Misurazione di TT4
TT4 <1,0 µg/dl
TT4 : 1,0 – 2,0 µg/dl
TT4 : 2,0 – 4,0 µg/dl
TT4 > 4,0 µg/dl
Possibile
eutiroideo
Misurazione di cTSH (+ fT4)
(fT4 Ô +) cTSH Ó
(fT4 Ô +) cTSH n
(fT4 Ó +) cTSH Ó
Compatibile con
ipotiroidismo
fT4-D
Test di stimolazione con TSH o
terapia “diagnostica” in caso di
quadro clinico inequivocabile
Ô
n
ipotiroideo
eutiroideo
Bibliografia:
Boretti FS, et al..: Clinical, haematological, biochemical and endocrinological aspects of 32 dogs with hypothyroeidism; Schweiz Arch Tierheild 145 (4) 149-159 (2003)
Boretti FS, et al..: Comparison of 2 doses of recombinant human thyrotropin for thyroid function testing in healthy and suspected hypothyroid dogs: J Vet Intern Med 23 (4): 856-861 (2009)
Boretti FS, et al.. : Diagnostische und therapeutische Aspekte der canine Hypothyreose; Kleintierpraxis 60 (7) 372-386 (2015)
Daminet S and D. C. Ferguson: Influence of Drugs on Thyroid Function in Dogs, J. Vet. Intern. Med. 17: 463-472 (2003)
Diaz-Espineira et al..: Adenohypophyseal functions in dogs with primary hypothyroidism and non thyroidal illness; J Vet Intern Med 23:100 (2009)
Ferguson D.C.: Testing for Hypotyroidism in Dogs: Vet Clin N Am Small Anim Pract ; 647-669 (2007)
Graham P.A. et al..: Etiopathologic findings of canine hypothyroidism. Vet Clin N Am Small Anim Pract; 37 (4): 617-32 (2007)
Köhler B, et al..: Dietary hyperthyroidism in dogs, Journal of Small Animal Practice, 53: 182–184 (2012)
Kooistra HS, et al..: Secretion pattern of thyroid-stimulating hormone in dogs during euthyroidism and hypothyroidism , Domest Anim Endocrinol; 18, 19-29 (2000)
Mooney CT: Canine Hypothyroidism in: Mooney CT, Peterson M (eds) Manual of canine and feline endocrinology 4th ed. (2012)
Nachreiner RF, et al..: Prevalence of serum thyroid hormone autoantibodies in dogs with clinical signs of hypothyroidism, J Am Vet Med Assoc. Feb 15;220(4):466-71 (2002)
Panciera DL: Conditions associated with canine hypothyroidism, Vet Clin N Am Small Anim Pract 31: 935-942 (2001)
Panciera DL et al.: Reproductive Effects of Prolonged Experimentally Induced Hypothyroidism in Bitches. Journal of Veterinary Internal Medicine, 26: 326–333 (2012)
Pichotta M, et al.: Autoantibodies against thyroid hormones and their influence on thyroxine determination with chemiluminescent immunoassay in dogs, J Vet Sci 11: 191 (2010)
Reusch CE, et al.: Serum Fructosamine Concentrations in Dogs with Hypothyroidism, Vet Res Comm 26, 7; 531-536 (2002)
Scott-Moncrieff JC , et al.: Accuracy of serum free thyroxine concentrations determined by a new veterinary chemiluminescent immunoassay in euthyroid and hypothyroid dogs (abstract),
J Vet Intern Med 25, 1493 (2011)
Scott-Moncrieff JC: Hypothyroidism. In: Feldman EC, Reusch CE, Scott-Moncrieff JC (eds), Canine and Feline Endocrinology. Elsevier Saunders, 4th ed; St.Louis, Missouri, 77-135 (2015)
Scott-Moncrieff JC : Canine Hypothyroidism. In: Bonagura J.D & Twedt, DC (eds), Kirk´s Current Veterinary Therapy XV (2014)
Shiel RE, et al.: Tertiary hypothyroidism in a dog, Irish Vet J 60:88 (2007)
Von Kloppmann T, et al.: Euthyroid sick syndrome in dogs with idiopathic epilepsy before treatment with anticonvulsant drugs, J Vet Intern Med 20, 516-520 (2006)
Williamson NL, et al.: Effects of short term trimethoprim sulfamethoxazole administration on thyroid function in dogs, J Am Vet Med Assoc ; 221 802-6 (2002)
IDEXX Laboratorio di riferimento
Via Guglielmo Silva, 36
20149 Milano
Tutti i marchi ®/TM sono di proprietà di IDEXX Laboratories, Inc. o di suoi associati negli Stati Uniti e/o in altri paesi.
La politica di tutela della privacy di IDEXX è disponibile sul sito idexx.it
© 2015 IDEXX Laboratories, Inc. Tutti i diritti riservati · 1510011-1015-IT
Numero verde 800 917 940 opz. 1
Numero verde fax 800 906 945
[email protected]
www.idexx.it