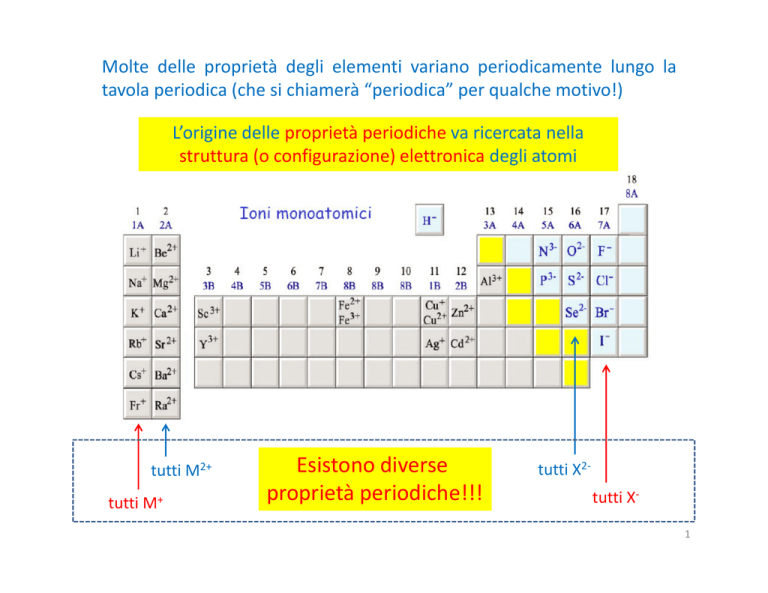
Molte delle proprietà degli elementi variano periodicamente lungo la
tavola periodica (che si chiamerà “periodica” per qualche motivo!)
L’origine delle proprietà periodiche va ricercata nella
struttura (o configurazione) elettronica degli atomi
tutti M2+
tutti M+
Esistono diverse
proprietà periodiche!!!
tutti X2tutti X1
L’ elettronegatività
2
Il raggio atomico
Il raggio atomico aumenta scendendo lungo un gruppo e spostandosi da destra a
sinistra lungo un periodo
251-300
201-250
151-200
101-150
51-100
Raggio
atomico
(in pm)
Come si spiega tutto questo? In prima approssimazione con un modello a gusci (o
strati) concentrici: passando da un periodo al successivo si passa da un guscio più
piccolo ad uno più grande
3
Il modello a gusci (o strati)
e-
e-
+1
Il primo guscio può contenere al
massimo 2e-: H (1e-), He (2e-)
+2
e-
H
He
ee-
e-
e-
ee-
+8
e-
Be
e-
+10
e-
e-
e-
Li
ee-
+4
e-
e-
e-
+3
e-
e-
e-
ee-
e-
e-
ee-
O
Ne
Il secondo guscio può contenere fino a 8e-: Li, Be, B, C, N, O, F, Ne
(altri 2e- sono già presenti nel primo guscio!!!)
Passando al Na ha inizio il riempimento del terzo guscio:
2e- nel primo guscio, 8e- nel secondo e 1e- nel terzo
4
Effetto schermo
Nell'ambito di questa rappresentazione a strati, un dato guscio elettronico
non percepisce solo l'attrazione della carica nucleare, ma anche la
repulsione dei gusci elettronici più interni.
In pratica, dal punto di vista del guscio elettronico considerato, è come se la
carica nucleare fosse, per l'appunto, schermata; l'effetto schermo fa sì che la
carica nucleare effettivamente percepita dal guscio elettronico in questione
sia minore di quanto si potrebbe prevedere sulla base del numero atomico.
Partendo dal modello a gusci e tenendo conto dell’effetto schermo, siamo in
grado di razionalizzare l’andamento dei raggi atomici osservato?
5
Le proprietà periodiche: il raggio atomico
Spostandosi nel periodo: gli elettroni vengono aggiungendosi nello stesso strato e, quindi,
più o meno alla stessa distanza dal nucleo di quelli preesistenti. Data la loro condizione
diffusa non esercitano l’uno sull’altro uno schermo efficace nei confronti della carica
nucleare sicché lungo il periodo la carica nucleare effettiva cresce attraendo gli elettroni e
contraendo il volume dell’atomo
Scendendo lungo il gruppo: di periodo in periodo gli elettroni più esterni occupano strati
via via più lontani dal nucleo
6
Le proprietà periodiche: il raggio ionico
Il raggio ionico aumenta scendendo lungo un gruppo e diminuisce
spostandosi da sinistra a destra
cationi
anioni
7
Le proprietà periodiche: il raggio ionico
● I cationi sono più piccoli degli atomi dai quali derivano
perché si formano da essi grazie alla perdita di uno o più
elettroni ed espongono il nocciolo generalmente più
piccolo dell’atomo progenitore. Come i raggi atomici
diminuiscono lungo il periodo (aumenta la carica del
nucleo) ed aumentano scendendo lungo il gruppo (si
occupano strati di numero atomico crescente).
● Gli anioni sono più voluminosi degli atomi progenitori
per l’aumentato numero di elettroni nello strato di
valenza e gli effetti repulsivi che si generano. Come i raggi
atomici diminuiscono lungo il periodo (aumenta la carica
del nucleo) ed aumentano scendendo lungo il gruppo (si
occupano strati di numero atomico crescente).
8
Le proprietà periodiche: l’energia di ionizzazione
Energia di ionizzazione: è la quantità di energia che un atomo isolato deve
assorbire per rimuovere l’elettrone più esterno (cioè legato più labilmente)
Mg
Mg+
Mg+ + e- I1 = energia di prima ionizzazione
Mg2+ + e- I2 = energia di seconda ionizzazione
I2 > I1
Energia di prima
ionizzazione in kJ/mol
2001-2500
1501-2000
1001-1500
501-1000
1-500
L’energia di ionizzazione cala scendendo lungo il gruppo e cala (anche se con
qualche irregolarità) spostandosi da destra a sinistra lungo il periodo (diminuisce
con l’aumentare del raggio atomico)
9
Le proprietà periodiche: l’energia di ionizzazione
Scendendo lungo il gruppo: gli elettroni più esterni occupano strati via via più lontani dal
nucleo che lo lega, di conseguenza, più labilmente
Spostandosi nel periodo: gli elettroni vengono aggiungendosi nello stesso strato e, quindi,
più o meno alla stessa distanza dal nucleo di quelli preesistenti. Data la loro condizione
diffusa non esercitano l’uno sull’altro uno schermo efficace nei confronti della carica
nucleare sicché lungo il periodo la carica nucleare effettiva cresce attraendo gli elettroni e
incrementando l’energia di ionizzazione
Quando un atomo perde un
e-, da quale guscio proviene
tale elettrone? Ovviamente
da quello più esterno!!!
10
Le proprietà periodiche: l’energia di ionizzazione
… riassumendo
L’energia di prima ionizzazione è massima per gli elementi vicini all’elio e minima per quelli
vicini al cesio.
L’energia di secondo ionizzazione è più elevata della primaria (per un certo elemento) a
causa della presenza di una carica positiva, e molto più alta se l’elettrone da allontanare
appartiene ad uno strato chiuso (completo = stabile).
Un blocco di metallo è
costituito da un insieme
ordinato di cationi (sfere)
circondati da un mare di
elettroni. Gli elettroni sono
mobili.
I metalli si trovano nella porzione inferiore sinistra
della tavola periodica perché questi elementi
possiedono bassa energia di ionizzazione e
possono facilmente cedere i loro elettroni.
Le energie di
ionizzazione
successive
di
alcuni elementi.
Si noti il grande
aumento
di
energia
necessario per
rimuovere un
elettrone da un
guscio interno.
11
Le proprietà periodiche: l’affinità elettronica
Affinità elettronica: è una misura dell’energia che si libera quando un atomo
isolato acquista un elettrone
L’affinità elettronica cala (anche se ci sono alcune irregolarità) scendendo lungo il gruppo
e spostandosi da destra a sinistra lungo il periodo (diminuisce con il raggio atomico)
O + eO- + e-
O- AE1 = prima affinità elettronica
O2- AE2 = seconda affinità elettronica
AE2 < AE1
12
Conseguenze sui materiali
13
Conseguenze sui materiali
Un pezzo di zolfo (a sinistra) se percosso con un martello si frantuma in
polvere fine. Il rame (a destra) si può ottenere in grandi pezzi di rame nativo,
modellare in palline, martellare in lamine sottili o tirarne fili.
14
I metalli alcalini e alcalino-terrosi
Gli elementi del blocco s godono di energia di ionizzazione bassa il che vuol dire che gli
elettroni più esterni sono ceduti con facilità:
● Un elemento del gruppo 1 formerà ioni +1 (Li+, Na+, K+). Un elemento del gruppo 2
formerà ioni +2 (Mg2+, Ca2+, Ba2+).
● Un elemento del gruppo s sarà un metallo reattivo.
● Poiché l’energia di ionizzazione è minima in fondo al gruppo gli elementi più pesanti
(cesio, bario) reagiscono più vigorosamente.
Data la loro grande attitudine a perdere elettroni:
1. Formano composti ionici
2. Si usano spesso come riducenti
I metalli alcalini sono tutti teneri e
di
colore
argenteo.
Per
proteggerlo dal contatto con l’aria
il sodio viene conservato sotto
olio di paraffina; una superficie
tagliata di fresco ed esposta si
ricopre di uno strato di ossido
15
Gli elementi del blocco p a destra
● Gli elementi che occupano la parte a destra del blocco p hanno affinità
elettronica elevata: tendono ad acquistare elettroni completando gli strati esterni.
● Fatta eccezione per i tellurio e polonio, i componenti dei gruppi 16 e 17 sono
non metalli.
● Reagiscono con i metalli formando anioni e, quindi, composti ionici.
Gli elementi del
gruppo
16.
Da
sinistra a destra:
ossigeno,
zolfo,
selenio e tellurio. Si
noti l’evoluzione da
non
metallo
a
metallo
16
Utilizzando il modello a gusci (o a strati) è stato possibile razionalizzare
diverse proprietà periodiche e capire qualcosa di più sulla struttura
dell’atomo e su come questa influenzi le proprietà della materia.
Ma è tutto così semplice? Ovviamente no!!!
Il modello a gusci è utile per la sua semplicità ma è, appunto, troppo
semplice.
Il moto di un elettrone attorno al nucleo non è infatti confinato sulla
superficie del guscio a cui appartiene. E’ invece descritto da funzioni
matematiche estremamente complesse che prendono il nome di funzioni
d’onda orbitaliche o, più semplicemente, orbitali.
A seconda dell’atomo con cui avremo a che fare sarà necessario considerare
gli orbitali: s, p, d, f
17
Come sono fatti gli orbitali s?
Gli orbitali s hanno simmetria sferica: quello che cambia nel passare da un
orbitale s al successivo sono le dimensioni che crescono nell’ordine 1s < 2s < 3s
18
Come sono fatti gli orbitali p?
L’orbitale p è in genere rappresentato come diretto lungo gli assi perpendicolari, x, y, z, e si
usano i simboli px, py, pz. Cambia l’orientazione ma la forma è sempre la stessa.
Analogamente agli orbitali s, anche per i p le dimensioni crescono nell’ordine: 2p < 3p < 4p…
Come sono fatti gli orbitali d?
19
Come sono fatti gli orbitali f?
20
La tavola periodica rivisitata alla luce degli orbitali s, p, d, f
21
Gli orbitali sono definiti in funzione di QUATTRO Numeri Quantici
Numero quantico principale
principale, n: può avere valori interi e positivi (non zero).
E’ legato alle dimensioni dell’orbitale (1s, 2s e 3s differiscono per il valore di n)
n = 1, 2, 3, …
Numero quantico secondario o orbitale
orbitale, l: può assumere tutti i valori interi tra 0
ed n-1. E’ legato alla forma dell’orbitale (2s e 2p differiscono per il valore di l)
l = 0, 1, 2, 3, … , n-1
s, p, d, f
Numero quantico magnetico
magnetico, ml,: può assumere tutti i valori interi, positivi e
negativi, compresi tra +l e –l. E’ legato all’orientazione spaziale dell’orbitale (px,
py e pz differiscono per il valore di ml)
-l, -l+1, -l+2, …, 0, 1, 2, …, l-1, l
E il quarto????
22
Lo spin elettronico: il quarto numero quantico
• L’elettrone ruota intorno a se stesso generando un campo magnetico
• Esistono due possibilità di rotazione dell’elettrone (o spin elettronico)
descritte dal numero quantico di spin, ms.
• Il numero quantico di spin non dipende da altri numeri quantici ma può
assumere valore +1/2 o -1/2
23
Gli Orbitali
24
Configurazioni elettroniche e processo di Aufbau
Regole per l’assegnazione degli elettroni agli orbitali
• Gli elettroni occupano gli orbitali in modo da minimizzare l’energia dell’atomo
Orbitali
caratterizzati
dagli stessi
valori di n ed l,
ma diverso
valore di ml
hanno la stessa
energia e sono
detti orbitali
degeneri
25
Processo di Aufbau
• In un atomo non possono esistere due elettroni aventi tutti i quattro numeri
quantici uguali (Principio di esclusione di Pauli); in un orbitale possono quindi
esistere al massimo due elettroni purché abbiano spin opposti
• Quando sono disponibili orbitali di energia identica gli elettroni inizialmente
occupano questi orbitali singolarmente e con spin paralleli (Regola di Hund)
Esempio: descrizione della configurazione elettronica del carbonio (Z = 6):
C 1s2 2s2 2p2
Ordine di riempimento dei sottolivelli elettronici:
Iniziando dalla riga in alto si seguono le frecce
Perché gli atomi seguono queste
regole????
26
27
28
29
Elettroni di valenza ed interni
Gli elettroni contenuti nel guscio elettronico più esterno sono chiamati
elettroni di valenza.
Gli elettroni che si trovano nei gusci sottostanti a quello di valenza sono
chiamati elettroni interni.
Gli elettroni di valenza sono quelli che si trovano a più alta energia e
pertanto sono quelli che entrano in gioco durante le reazioni chimiche.
Nel caso del carbonio (Z = 6):
C 1s2 2s2 2p2
Elettroni Elettroni
interni di valenza
Gli elettroni di valenza servono a
“costruire” i legami chimici.
Infatti essendo più esterni sono
meno legati al nucleo e possono
essere più facilmente messi in
gioco nella formazione di legami
30












