Gli oli essenziali
Ogni volta che, schiacciando il petalo di un fiore, una foglia, un rametto, una
parte qualsiasi di una pianta, si sprigiona un profumo, significa che si è
liberato un olio essenziale.
Gli Egizi importavano dall’Oriente oli essenziali e minerali utili alla produzione
di unguenti e profumi già 3500 anni prima di Cristo. I sacerdoti
confezionavano e conservavano, in vasi di alabastro, timo, origano, mirra,
incenso, lavanda, oli di sesamo, di oliva e di mandorle. L’uso di questi
unguenti fu poi adottato anche da altri popoli del Mediterraneo.
Anche gli Ebrei,molto sobri, usavano oli ed unguenti profumati ma non
cosmetici.
DEFINIZIONE
Gli oli essenziali, chiamati anche essenze,
oli volatili, oli eterei, sono delle miscele
aromatiche di sostanze organiche diverse.
Sono prodotti da molte piante e presenti
sotto forma di minuscole goccioline nelle
foglie, nella buccia dei frutti, nella resina,
nei rami, nel legno.
Hanno una chimica complessa, ma generalmente sono una mescolanza di terpeni,
alcoli, aldeidi, chetoni, esteri.
Alcuni oli essenziali hanno fino a 250 differenti molecole attive ed in proporzioni
perfettamente adattate. Sono solubili negli oli e in alcool e sono insolubili in
acqua a cui, per altro, trasmettono il profumo.
La composizione di un'essenza naturale è molto più complessa della somma dei
suoi costituenti.
Gli Arabi - Gli oli essenziali: la distillazione a vapore
Gli arabi misero a punto la tecnica di distillazione a vapore utilizzando più recipienti. Nel
primo si mette l’acqua da scaldare il cui vapore prodotto viene convogliato al di sotto di in
un secondo recipiente in cui sono contenute le parti della pianta da distillare. In questo,
oltre all’acqua, si liberano gli oli essenziali. Vapore acqueo carico di oli entra in un terzo
recipiente e attraversa una serpentina raffreddata ad acqua. I vapori condensano e sono
raccolti in un quarto recipiente dove avviene la separazione tra acqua e olio. Alcuni oli
devono subire più processi di distillazione per essere purificati dalle impurità.
Oggi…………………………….
Si deve tener conto che gli oli essenziali ottenuti per distillazione in corrente di
vapore non sono identici alle sostanze aromatiche contenute nell'apparato
secretore della pianta, in quanto risultano più o meno modificati a seguito del
metodo di estrazione.
Si formano così delle nuove molecole - a partire da precursori - per ciclizzazione,
polimerizzazione, ossidazione, perossidazione e apertura degli anelli lattonici dei
composti originariamente contenuti.
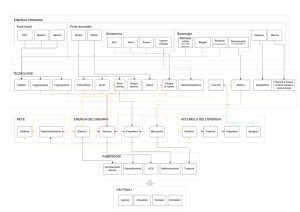
3) LA DISTILLAZIONE IN
CORRENTE DI VAPORE
•La distillazione di una miscela di due
sostanze immiscibili avviene ad una
temperatura di ebollizione inferiore a
quella delle due sostanze pure. Tale
caratteristica torna utile per sostanze
termolabili e altobollenti insolubili in
acqua, ad esempio gli oli essenziali
•Dato che tutti i gas sono miscibili tra
di loro, le sostanze codistillano con il
vapore e durante la condensazione,
essendo immiscibili, si separano.
•Se uno dei due componenti è l’acqua
allora si parla di distillazione in
corrente di vapore.
•Fu adottata per la prima volta dal
medico arabo Avicenna (1000 d. C.)
Miscela vapore-olio
Il vapore attraversa il
materiale e distilla
l’olio
Acqua in uscita dal
condensatore
Acqua fredda in entrata
Vapore in ingresso
Sostanza oleosa raccolta
dalla parte alta del distillato
Interessa la maggior parte delle piante aromatiche. Può essere operata con un
alambicco formato da una caldaia (nella parte inferiore), nella quale è posta
l’acqua per la generazione del vapore, e da un cestello forato (nella parte
superiore), contenente la pianta officinale essiccata. I vapori condensati sono
raccolti in un recipiente dove si separano dall’acqua per il differente peso
specifico.
Gli oli essenziali: idrodiffusione e percolazione
In questo caso però il vapore
viene diffuso dall’alto e percola
alla base del recipiente, dopo
aver attraversato il materiale
vegetale.
Il vantaggio della idrodiffusione
rispetto alla distillazione a
vapore è dato dal minor tempo
impiegato per la distillazione,
soprattutto per le parti legnose
e fibrose (legno, corteccia). Gli
oli così prodotti pare abbiano un
aroma superiore e un colore più
intenso rispetto a quelli ottenuti
con la distillazione a vapore.
Gli Oli
Essenziali
arancio
malva
pino mugo
camomilla
calendula
A cosa servono gli oli essenziali e come si utilizzano?
Gli oli essenziali sono utili per tutta una serie di
problematiche
e
di
disfunzioni
agendo
sostanzialmente in tre modi:
farmacologicamente
psicologicamente
fisiologicamente
rosmarino
sandalo
tea tree
valeriana
limone
sandalo
ylang ylang
Perché le piante contengono gli oli essenziali ?
per difendersi dai batteri, funghi e altri microrganismi infestanti;
per difendersi dalle aggressioni da parte di insetti e animali erbivori;
per favorire l’impollinazione, attirando le api e altri insetti, ma anche i
pipistrelli;
per riuscire a sopravvivere in ambienti difficili (alcuni oli sono riversati
sul suolo circostante e impediscono la crescita di altre piante);
per prevenire la disidratazione in ambienti molto secchi (gli oli
circondano con un alone di vapore le parti della pianta e impediscono
alla pianta di perdere troppa acqua)
L’utilizzo degli oli essenziali a scopo cosmetico, profumiere e terapeutico è
antichissimo e presente in tutte le civiltà dell’antichità. Gli stessi egiziani
utilizzavano gli oli essenziali nei processi di mummificazione, impiegando il
cedro, la cannella e la trementina.
Gli oli essenziali sono utilizzati in cosmetologia in pressoché tutte le formulazioni
(saponette, sali da bagno, creme, dopobarba, profumi,ecc.)
Molti hanno anche delle caratteristiche funzionali; alcuni oli essenziali si usano per
trattamenti dimagranti, idratanti, purificanti, efficaci per la pelle, per i capelli,
per il viso, contro la cellulite, ecc.
OLI AROMATICI
Associazione di oli vegetali vergine e oli essenziali puri.
Oli essenziali (OE): distillazione al vapore a bassa pressione
(garantiti
per
un'utilizzazione
in
Aromaterapia).
Oli vegetali (OV) : di qualità vergine e di prima pressione a
freddo.
Gli oli essenziali, secondo una tradizione introdotta da M.M.Charabot e Dupont, sono
classificati in base al costituente chimico contenuto in maggior concentrazione. In
base a questo criterio abbiamo:
* oli essenziali a prevalente contenuto in idrocarburi mono o sesquiterpenici (Limone,
Ginepro, Trementina);
* oli essenziali a prevalente contenuto in aldeidi (aldeide cinnamica nella Cannella, aldeide
benzoica nel Mandorlo amaro);
* oli essenziali a prevalente contenuto in alcoli (geraniolo nel Geranio, santalolo nel
Sandalo, linalolo nel Coriandolo);
* oli essenziali a prevalente contenuto in chetoni (carvone nel Carvi, tujone nell'Assenzio,
nella Thuja e nella Salvia);
* oli essenziali a prevalente contenuto in fenoli (eugenolo nel Garofano, timolo nel Timo,
carvacrolo nella Santoreggia);
* oli essenziali a prevalente contenuto in composti solforati (bisolfuro di allile nell'Aglio);
* oli essenziali a prevalente contenuto in esteri e alcoli (linalolo e acetato di linalile nella
Lavanda);
* oli essenziali a prevalente contenuto in aldeidi e fenoli (aldeide cinnamica ed eugenolo
nella Cannella di Ceylon);
* oli essenziali a prevalente contenuto in perossidi (ascaridolo nel Chenopodio).
Composizione chimica
La costituzione chimica degli oli essenziali è molto complessa, tuttavia è
possibile riunire i loro componenti in alcuni gruppi fondamentali:
a)
gruppo dei composti contenenti carbonio (C) e idrogeno (H):
b)
gruppo dei composti contenenti carbonio (C), idrogeno (H) e ossigeno (O).
c)
gruppo dei composti contenenti carbonio (C), idrogeno (H), ossigeno (O),
azoto (N) e zolfo (S): non sono molto importanti per uso cosmetico perché
non hanno un buon odore
La maggior parte di questi composti sono terpenoidi
Gruppo dei composti contenenti carbonio (C) e idrogeno (H):
* idrocarburi monoterpenici (C 10) alifatici e aromatici insaturi mono e bicicli:
mircene (Verbena, Sassafrasso), limonene (Limone, Bergamotto, Finocchio, Carvi,
Macis), pinene (Trementina, Cipresso, Eucalipto, Basilico, Rosmarino), canfene
(Ginepro, Trementina), terpinene (Cardamomo, Maggiorana, Trementina, Aneto),
sabinene (Sabina, Maggiorana, Cardamomo), fellandrene (Angelica, Badiana,
Fellandrio, Finocchio, Eucalipto, Limone, Salvia, Sassafrasso), silvestrene (Cipresso
n Pino).
* idrocarburi sesquiterpenici (C 15):
cardinene (Ginepro, Cade, Limone), selinene (Sedano), cariofillene (Garofano,
Cannella), umulene (Luppolo, Pioppo, Betulla), cedrene (Cedro, Ginepro).
* azuleni: camazulene (Achillea, Camomilla), eucazulene (Eucalipto), gajazulene
(Guajaco), vetivazulene (Vetiver).
* idrocarburi diterpenici (C 20):
canforene (Canfora), cupressene (Cipresso).
Gruppo dei composti contenenti carbonio (C), idrogeno (H) e ossigeno
(O).
* alcoli: linalolo (Coriandolo, Limone, Lavanda, Basilico, Sassafrasso), geraniolo (Geranio,
Citronella, Rosa, Coriandolo), santalolo (Sandalo), mentolo (Menta), nerolo (Arancio,
Bergamotto, Mirto), terpineolo (Badiana, Bergamotto, Maggiorana, Geranio), farnesolo
(Rosa, Ylang-Ylang), citronellolo (Geranio, Citronella),
* aldeidi: aldeide cinnamica (Cannella), aldeide benzoica (Mandorle amare, Lauro, Benzoino),
citrale (Limone, Verbena, Melissa), citronellale (Limone, Citronella, Melissa), vanillina
(Vaniglia, Benzoino, Balsamo del Perù, Balsamo del Tolù).
* chetoni: carvone (Carvi, Aneto, Anice), tujone (Thuja, Assenzio, Artemisia, Salvia,
Tanaceto), canfora (Canfora, Cannella, Salvia, Basilico), fencone (Finocchio), mentone
(Menta).
* fenoli: timolo (Timo), eugenolo (Chiodi di Garofano, Sassafrasso), carvacrolo (Origano,
Timo, Menta).
* eteri: anetolo (Finocchio, Badiana, Anice, Aneto), apiolo (Prezzemolo, Aneto), safrolo
(Sassafrasso, Badiana, Noce moscata), eucaliptolo (Eucalipto), estragolo (Estragone).
* esteri: acetato dilinalile (Lavanda, Bergamotto), salicilato di metile (Gaulteria, Betulla),
acetato di geranile (Lavanda, Eucalipto), benzoato di benzile (Benzonio, Balsamo del Perù,
Balsamo deI Tolù), acetato di terpenile (Cipresso, Pino).
* acidi organici: acido benzoico (Ylang-Ylang, Benzoino, Balsamo del Tolù, Balsamo del Perù),
acido cinnamico (Benzoino, Storace, Balsamo del Perù, Balsamo del Tolù), acido salicilico
(Gaulteria, Betulla, Piopo), acido cuminico (Cumino).
Oli essenziali purificati
Alcuni oli essenziali non possono essere utilizzati grezzi perchè
contengono composti di odore sgradevole o irritanti per la pelle. E'
necessario allora purificare le essenze grezze dai costituenti
sgraditi che possono modificare le proprietà, il profumo e la
solubilità nell'alcool dell'olio essenziale.
La deterpenazione consiste nel separare gli idrocarburi
monoterpenici, poco solubili in acqua ed irritanti per la pelle, dai
costituenti sesquiterpenici e dai composti ossigenati (fenoli,
alcooli, aldeidi, chetoni, ecc.). In tal modo si perviene ad un olio
essenziale deterpenato.
Gli oli essenziali deterpenati sono più stabili, più solubili nell'acqua
e nell'alcool di basso titolo (anche 70° e 60°) mentre sono privi di
potere irritante per le vie respiratorie, per gli occhi e le mucose in
genere. Per contro si conservano con minore facilità.
La via del mevalonato
coda
testa
unità isoprenica (5 atomi di carbonio)
Attraverso la via del mevalonato
vengono sintetizzati i terpenoidi
Essi sono una vasta famiglia di
sostanze naturali tutte derivanti da
unità a cinque atomi di carbonio
chiamate unità isopreniche (C5) unite
in modo testa-coda.
L’isoprene come tale è stato identificato
come prodotto di decomposizione di
numerosi idrocarburi naturali ciclici ed è
stato quindi indicato come l’unità base
costitutiva di questi metaboliti. Esso
tuttavia non è coinvolto direttamente
nella biogenesi.
isoprene
I terpenoidi presentano strutture che contengono scheletri
carboniosi costituiti da unità (C5)n e sono classificate come:
Emiterpeni (C5)
Monoterpeni (C10)
Sesquiterpeni (C15)
Diterpeni (C20)
Sesterterpeni (C25)
Triterpeni (C30)
Tetraterpeni (C40)
Sono state identificate due unità isopreniche biologicamente “attive”:
Dimetilallilpirofosfato (DMAPP)
Isopentenilpirofosfato (IPP).
OPP
OPP
dimetilallil PP
(DMAPP) (C5)
isopentenil PP
(IPP) (C5)
Entrambe derivano dall’acido mevalonico (MVA)
L’acido mevalonico
L’acido
mevalonico
è stato individuato come il precursore del
colesterolo. Successivamente, è stato accertato che i primi stadi di
questa via biogenetica sono comuni all’intera gamma di derivati naturali
terpenoidici
6
OH
1
HOOC
3
2
4
5
OH
acido mevalonico (MVA)
Per sintetizzare l’acido mevalonico si utilizzano tre molecole di acetilcoenzima A
Biogenesi dell’acido mevalonico
O
reazione
di Claisen
H
H
O
SCoA
O
reazione aldolica
stereospecifica; essa
comporta anche
l'idrolisi del legame
acetil-enzima
OH O
HO2C
SCoA
SCoA
acetoacetil-CoA
O
acetil-CoA
EnzSH
SEnz
1
HO 2C
6
SCoA
HMG-CoA
β-idrossi-βmetilglutaril-CoA
O gruppo acetile legato
all'enzima: non si
utilizano malonil
derivati
HMG-CoA
reduttasi
riduzione da
aldeide ad alcol
OH
3
2 4
5
NADPH
OH
acido mevalonico
(MVA)
NADPH
OH OH
OH
HO 2C
+ EnzSH
HO 2C
O
acido mevaldico
H
SCoA
acido mevaldico
tioemiacetale
riduzione da
tioestere ad
aldeide via
tioemiacetale
Sono state identificate due unità isopreniche biologicamente “attive”:
Dimetilallilpirofosfato (DMAPP)
Isopentenilpirofosfato (IPP).
OPP
OPP
dimetilallil PP
(DMAPP) (C5)
isopentenil PP
(IPP) (C5)
Entrambe derivano dall’acido mevalonico (MVA)
Biogenesi DMAPP e IPP
Il composto MVA, a sei atomi di carbonio, viene trasformato nelle unità isopreniche
fosforilate a 5 atomi di carbonio attraverso trasformazioni che iniziano con la
fosforilazione dell’alcool primario
fosforilazione
dell'alcol
primario a
difosfato
O
H
O
isomerizzazione
allilica
stereospecifica;
l'equilibrio
favorisce DMAPP
O
HO
OH
P
O
OH
OPP
L'ATP facilita la
decarbossilazioneeliminazione
ADP
ATP
–CO2
5
H
3
4
1
2
OPP
isomerasi
OPP
HR HS
isopentenil PP
(IPP)
dimetilallil PP
(DMAPP)
L'isomerizzazione di IPP a DMAPP avviene ad opera di una isomerasi che rimuove
stereospecificamente il protone pro-R dal C-2 ed incorpora un protone dall'H2O
sul C-4. Sebbene l'isomerizzazione sia reversibile, l'equilibrio è spostato verso il
DMAPP, un elettrofilo reattivo.
Il DMAPP è un elettrofilo reattivo,
quindi un buon agente alchilante.
Infatti possiede un buon gruppo
uscente, il difosfato, che può
generare, attraverso un mecanismo
SN1,
un
carbocatione
allilico
stabilizzato per risonanza
OPP
dimetilallil PP
(DMAPP) (C5)
L’IPP, con il suo doppio legame
terminale, è più adatto ad agire
da nucleofilo
nucleofilo, specialmente verso
l’elettrofilo DMAPP. Infatti, può
utilizzare gli elettroni del doppio
legame terminale in una reazione di
addizione
elettrofila
sul
carbocatione formato dal DMAPP.
OPP
isopentenil PP
(IPP) (C5)
Queste due differenti reattività costituiscono le basi nella biosintesi dei
terpenoidi. IPP e DMAPP sono intermedi molto reattivi; vengono utilizzati in
questa via biogenetica per dare origine a strutture anche molto complesse.
La maggior parte dei terpenoidi presentano ulteriori modificaz<ioni e riarrangiamenti
successivi alla combinazione lineare delle unità isopreniche
OPP
OPP
dimetilallil PP
(DMAPP) (C5)
Emiterpeni (C5)
isopentenil PP
(IPP) (C5)
C10
Monoterpeni (C10)
Iridoidi
IPP
C15
Sesquiterpeni (C15)
C20
Diterpeni (C20)
C25
Sesterterpeni (C25)
IPP
x2
IPP
x2
C30
Triterpeni (C30)
Steroidi (C18-C30)
C40
Tetraterpeni (C40)
Carotenoidi
Sono i principali
costituenti degli
OLI ESSENZIALI
Emiterpeni : terpeni a 5 atomi di carbonio
IPP e DMAPP sono intermedi emiterpenici
IPP e DMAPP sono anche utilizzati come agenti alchilanti, per esempio, nella formazione di
metaboliti a biogenesi mista.
OPP
DMAPP
catione allilico stabilizzato dalla risonanza
Pochi sono in natura gli emiterpeni. L'esempio più significativo è rappresentato dall'isoprene, un
composto volatitile che è presente in molte specie di piante. L'isoprene si forma in seguito alla
perdita di un protone dal catione allilico.
–H
H
isoprene
Monoterpeni: terpeni a 10 atomi di carbonio
Monoterpeni
L'unione tra IPP e DMAPP, ad opera dell'enzima preniltrasferasi, porta alla formazione di
geranil PP (GPP), terpene a 10 C , in cui il nuovo doppio legame è trans (E).
addizione electrofila e formazione di un
catione terziario
OPP
OPP
OPP
DMAPP
HR HS
E
OPP
perdita
stereospecifica
del protone
HR HS
≡
OPP
geranil PP
(GPP)
Il linalil PP ed il neril PP sono isomeri del geranil PP, che si formano dal geranil
PP.
il singolo legame in LPP
permette la rotazione
OPP
E
OPP
OPP
Z
OPP
OPP
OPP
catione allilico stabilizzato per
risonanza (catione geranile)
linalil PP
(LPP)
≡
≡
geranil PP
(GPP)
catione allilico stabilizzato per risonanza
(catione nerile)
neril PP
(NPP)
La biosintesi dei terpenoidi è basata essenzialmente sulla reattività dei
carbocationi
I carbocationi possono:
Essere neutralizzati con nucleofili (specialmente acqua)
Perdere un protone
Ciclizzare
Dare origine a trasposizioni
Tutte queste possibilità si verificano nella biosintesi dei terpenoidi
Monoterpeni lineari che sono componenti degli oli volatili
Da GPP, NPP e LPP, in seguito a semplici modificazioni, si ottiene una vasta gamma di composti
naturali presenti negli oli volatili usati nella produzione di aromi e profumi.
O
OH
citronellolo
(olio di rosa)
geraniale (Z-citrale)
(olio di limone)
OPP
OH
geraniolo
(olio di
geranio)
O
GPP
citronellale
(olio di citronella)
OPP
OH
linalolo
(olio di
coriandolo)
β-mircene
(infiorescenze di luppolo)
LPP
nerolo
(olio di rosa)
OH
OPP
O
nerale (E-citrale)
(olio di limone)
Monoterpeni ciclici
La grande varietà di terpeni che si trovano in natura deriva dalla possibilità di avere delle reazioni di
ciclizzazione che possono portare alla formazione di sistemi mono e biciclicici.
OPP
OPP
OPP
OPP
GPP
LPP
NPP
coppia ionica
catione allilico delocalizzatodifosfato
catione mentile / αterpinile
Anche se gli enzimi monoterpene ciclasi sono capaci di accettare tutti e tre i difosfati,
non è presumibile che tali ciclizzazioni avvengano con il precursore GPP poiché la
stereochimica E del doppio legame è sfavorevole.
La specie coinvolta nella ciclizzazione è la coppia ionica catione allilico/difosfato; la
formazione del legame avviene grazie alla vicinanza degli elettroni π del doppio legame
Il carbocatione mentile (o α-terpinile) ha lo
scheletro del mentano. Esso può essere
neutralizzato dall’attacco dell’H2O (nucleofilo)
per dare l’α-terpineolo oppure eliminare un
protone per dare il limonene
catione
mentile / α-terpinile
pmentano
H2 O
–H
H
ciclizzazione
O
OH
α-terpineolo
cineolo
limonene
Il ripiegamento della catena laterale cationica verso il doppio legame permette una nuova
ciclizzazione e porta alla formazione dei cationi bornile o pinile a seconda di quale estremità del
doppio legame viene coinvolta.
catione pinile
- H+
catione bornile
- H+
H2O
O
α-pinene
β-pinene
canfora
O
OH
borneolo
STEREOCHIMICA
(+)-α-pinene
(-)-α-pinene
La maggior parte dei terpeni sono
otticamente attivi.
Alcune sostanze si ritrovano nello stesso
organismo
in
entrambe
le
forme
enantiomeriche
oppure
le
forme
enantiomeriche di uno stesso composto
possono essere isolate da fonti diverse.
Ad esempio, il (+) e (-)-α-pinene sono
entrambi presenti nel pino, mentre la (+)canfora è presente nella salvia e la (-)canfora nel tanaceto.
I singoli enantiomeri possono produrre
risposte biologiche differenti specialmente
verso i recettori olfattivi del naso. Ad
esempio, il (+)-limonene dà il caratteristico
odore alle arance mentre il (-)-limonene è
responsabile dell’odore dei limoni.
Una singola pianta in grado di produrre
entrambe le forme contiene due diversi
sistemi enzimatici, ognuno capace di
elaborare un singolo enantiomero.
(+)-( R )- limonene
(-)-( S )- limonene
In altri sistemi, un particolare struttura si può ritrovare come
miscela di diastereoisomeri
La menta piperita produce tipicamente (-)-mentolo insieme a piccole quantità degli
stereoisomeri (-)-neomentolo, (+)-isomentolo e (+)-neoisomentolo, coprendo quattro
degli otto possibili stereoisomeri
Gli oli estratti da varie specie di Mentha contengono anche significative quantità di
chetoni, come (-)-mentone, (+)-isomentone, (-)-piperitone e (+)-pulegone.
OH
(-)-mentolo
OH
OH
(-)-neomentolo
O
O
(-)-mentone
(+)-isomentone
(+)-isomentolo
O
(-)-piperitone
OH
(+)-neoisomentolo
O
(+)-pulegone.
La via biogenetica che porta a questi composti mostra che le funzioni ossigenate possono
essere introdotte nella molecola nelle posizioni attivate da doppi legami adiacenti (posizioni
alliliche). Questa reazione viene detta ossidazione allilica.
O
HO
Ossidazione
Ossidazione allilica
Il precursore di questi
composti è il limonene:
(-)-carvone
(-)-trans-carveolo
(-)-limonene
Ossidazione
Ossidazione allilica
OH
(-)-trans-isopiperitenolo
O
(-)-isopiperitone
La stereochimica ad ogni centro viene
stabilita da processi di riduzione specifica di
doppi legami o di gruppi carbonilici
O
riduzione
(-)-piperitone
isomerizzazione
O
(-)-isopiperitone
O
piperitenone
riduzione
O
(+)-piperitone
(-)-isopiperitone
O
riduzione
isomerizzazione
O
O
(+)-cis-isopulegone
(+)-pulegone
riduzione
riduzione
O
O
(+)-pulegone
(+)-isomentone
riduzione
riduzione
OH
(+)-neoisomentolo
O
(-)-mentone
riduzione
OH
(+)-isomentolo
riduzione
OH
(-)-mentolo
OH
(+)-isomentolo
Un piccolo gruppo di composti aromatici pure vengono prodotti attraverso
la via del mevalonato.
Possiedono lo scheletro carbonioso
tipico dei monoterpeni nmonociclici.
La loro relazione strutturale con il
limonene ed i suoi derivati ossigenati
suggeriscono l’ipotesi che essi siano
prodotti
da
reazioni
di
deidrogenazione.
p-cimene
OH
OH
timolo
carvacrolo