LE MALATTIE GENETICHE EREDITARIE
Facoltà di Medicina e Chirurgia di Catania
Platania Alessio
INTRODUZIONE
-il DNA
Il DNA costituisce il materiale ereditario della cellula. L’acido deossiribonucleico (DNA) è
costituito da una lunga catena di nucleotidi, ogni nucleotide è formato da una base azotata, dallo
zucchero deossiribosio e da un gruppo fosfato. Vi sono due tipi di basi azotate: le purine, che
presentano una struttura a due anelli e le pirimidina, che hanno un solo anello. Nel DNA vi sono
due tipi di purine, l’adenina (A) e la guanina (G), e due tipi di pirimidine, la citosina (C) e la timina
(T). Riunendo i vari dati Watson e Crick dedussero che il DNA è una doppia elica molto lunga e
spiralizzata, inoltre trovarono un importante vincolo legato alla sua conformazione, scoprirono
infatti che; non solo le purine non potevano appaiarsi con altre purine, e le pirimidine con altre
pirimidine, ma anche che, a causa della struttura delle basi azotate, l’adenina poteva appaiarsi
soltanto con la timina mediante due legami a idrogeno e la guanina soltanto con la citosina,
formando tre legami a idrogeno. Le basi appaiate erano complementari.
Ognuno dei due filamenti ha una direzione, ciascun gruppo fosfato è attaccato a una molecola di
zucchero in posizione 5’ e a un'altra molecola di zucchero in posizione 3’, ogni filamento ha perciò
un’estremità 5’ e una 3’. All’interno della doppia elica i due filamenti corrono in senso opposto,
vengono perciò definiti antiparalleli. Lungo una catena i nucleotidi possono disporsi in un ordine
qualunque, ma la loro sequenza determinerà l’ordine dei nucleotidi dell’altra catena, in quanto le
basi azotate sono complementari.
-duplicazione del DNA
La duplicazione del DNA è un processo che si verifica una sola volta a ogni generazione cellulare,
durante la fase S del ciclo cellulare. Nella maggior parte delle cellule eucariote la duplicazione del
Dna è seguita da mitosi, mentre nelle cellule che danno origine ai gameti viene seguita dalla meiosi.
Essa è semiconservativa, cioè da una molecola di DNA ne otteniamo due aventi ciascuna una catena
polinucleotidica parentale (quella originale) ed una catena di nuova sintesi. Per la sintesi del DNA
occorrono:
1) stampo di DNA
2) nucleotidi
3) enzima Dna Polimerasi
4) ATP/NADH (come energia)
Delle due catene di DNA una è il filamento Leader o veloce, cioè che viene copiato velocemente
dall’enzima, l’altra catena invece è il filamento lento. La DNA Polimerasi sa leggere solo in
direzione 5’ 3’. Per la duplicazione all’inizio occorre un enzima che si chiama DNA Elicasi, la
cui funzione è quella di aprire la doppia catena del DNA, dopodichè entra in gioco l’enzima Primasi
( si tratta di un enzima che deve fabbricare un Primer di RNA). La DNA Polimerasi ha bisogno di
un innesco (Primer) perché non sa dove cominciare a leggere. Quando si arriva a copiare il
filamento lento questo viene copiato sotto forma di frammenti detti “frammenti di Okazaki”;
siccome ci sono dei vuoti tra un frammento e l’altro, entra in gioco un quarto enzima che si chiama
DNA Ligasi aventete la funzione di riempire i vuoti. Alla fine della duplicazionedeve essere
rimosso il Primer che viene sostituito dalla DNA Polimerasi.
1
-il ruolo dell’RNA
Il Dna è il codice che contiene le istruzioni della struttura e della funzione biologica, queste
istruzioni sono eseguite dalle proteine. La sequenza lineare degli amminoacidi di una catena
polipeptidica determina la struttura tridimensionale dell’intera proteina, ed è questa struttura che
determina la sua funzione. Ma come fa la successione delle basi azotate a determinare la sequenza
degli amminoacidi di una proteina? La risposta è nell’ acido ribonucleico (RNA), una sostanza
chimicamente simile al DNA. Vi sono tre differenze principali tra l’RNA e il DNA:
1) nei nucleotidi dell’RNA lo zucchero è il ribosio e non il deossiribosio;
2) la base azotata timina, che si trova nel DNA, non è presente nell’RNA; al suo posto l’RNA
contiene una pirimidina molto simile, l’uracile (U) che, come la timina, si appaia solo con
l’adenina;
3) la maggior parte dell’RNA è composto da un filamento singolo.
Tre tipi di RNA agiscono come intermediari nei processi che, partendo dal DNA, portano alle
proteine, ma al momento ne descriverò soltanto uno: l’RNA messaggero.
Le molecole di RNA messaggero sono copie (trascrizioni) di sequenze nucleotidiche codificate nel
DNA. A differenza del DNA, tuttavia, le molecole di RNA hanno in genere un solo filamento. Ogni
nuova molecola di mRNA viene copiata, o trascritta, da uno dei due filamenti del DNA con lo
stesso principio dell’accoppiamento delle basi che regola la duplicazione del DNA.
Come un filamento di DNA, ogni molecola di RNA ha un’estremità 5’ e una 3’. I nucleotidi, che
sono presenti nella cellula come trifosfati, si aggiungono, uno alla volta alla catena di RNA in
formazione a partire dall’estremità 3’. Il processo conosciuto come trascrizione, è catalizzato
dall’enzima RNa Polimerasi; questo si muove in direzione 3’ 5’ lungo il filamento stampo del
DNA, sintetizzando un nuovo filamento complementare di nucleotidi in direzione da 5’3’. Il
DNA è la copia matrice dell’informazione genetica, costantemente a disposizione sui cromosomi.
L’RNA messaggero, invece, è la copia di lavoro dell’informazione genetica; acquisendo le
istruzioni codificate nella molecola di Dna, l’mRNA detta la sequenza di amminoacidi che
caratterizza le proteine. Quando il suo compito è terminato, l’mRNA si scompone nei nucleotidi che
lo costituiscono, i quali poi saranno di nuovo disponibili per la sintesi di altre molecole di mRNA.
-il codice genetico
Le proteine contengono 20 amminoacidi differenti, mentre il DNA e l’RNA solo quattro diversi
nucleotidi. Se ciascun nucleotide << codificasse>> per un amminoacido le quattro basi potrebbero
determinare solo quattro amminoacidi; Se un amminoacido corrispondesse a due nucleotidi, ci
sarebbe un massimo di 4x4 = 16 combinazioni possibili; perciò ogni amminoacido deve essere
determinato da almeno tre nucleotidi in sequenza; in questo modo si hanno 4x4x4= 64
combinazioni possibili, o codoni. Delle 64 possibili combinazioni di triplette, 61 determinano
amminoacidi e tre sono segnali di arresto. Essendoci 61 combinazioni codificanti per solo 20
amminoacidi, è chiaro che molti amminoacidi devono avere più di un codone , questo è un sistema
di protezione dalle mutazioni.
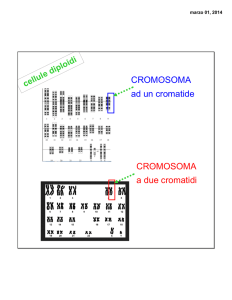
-i cromosomi
Il DNA è avvolto a formare i cromosomi, visibili al microscopio come strutture simili a bastoncini.
Normalmente, ciascuna cellula umana possiede 46 cromosomi, di cui 23 sono ereditati dalla madre,
23 dal padre.
Questo è il nostro corredo cromosomico:
2
2 cromosomi sessuali: il cromosoma X e il cromosoma Y. Le femmine possiedono due copie dell'X
(XX) i maschi possiedono un cromosoma X e un cromosoma Y (XY). Il cromosoma Y è sempre di
origine paterna.
22 coppie di cromosomi non sessuali, detti autosomi, uguali a due a due.
Questo fa sì che ciascun gene dell’organismo sia presente in due copie, una di origine materna e
l’altra di origina paterna. Ognuna delle due copie è detta allele.
Non sempre gli alleli sono uguali fra loro, anzi molto spesso presentano delle differenze. Gli alleli
sono quindi versioni diverse dello stesso gene. Fanno eccezione i geni contenuti nel cromosoma X e
Y, che sono presenti in una sola copia nel maschio, in due copie nella femmina.
Il cariotipo è l’insieme del corredo cromosomico di un individuo.
-i geni
All'interno di ciascun cromosoma si trovano migliaia di geni. Ognuno è un segmento di DNA che
contiene le istruzioni per fabbricare una proteina. I geni sono le unità funzionali del patrimonio
genetico: se paragoniamo il genoma ad una enciclopedia, ogni gene rappresenta una singola frase.
Si stima che nel genoma umano esistano 30-40mila geni. Curiosamente, i geni rappresentano solo il
2 % circa di tutto il DNA umano. La maggior parte del DNA non codifica per alcuna proteina, e la
sua funzione non è ancora del tutto chiara.
GENERALITA SULLE MALATTIE GENETICHE
Le malattie genetiche sono malattie causate da un'alterazione del patrimonio genetico (DNA) che,
nella maggior parte dei casi sono ereditarie. Non tutte queste patologie sono trasmesse alle
generazioni successive in quanto il patrimonio genetico di un individuo può subire modificazioni,
mediante fattori esterni (es.: radiazioni nucleari), anche dopo la nascita e, se queste mutazioni non
coinvolgono le cellule germinali (spermatozoi nel maschio e ovuli nella femmina), la persona che
ne è portatore non la trasmetterà ai propri figli. È questo il caso del cancro, malattia genetica in
genere non ereditaria.
Le malattie genetiche si possono dividere in monogeniche o mendeliane (alterazione di un singolo
gene), cromosomiche (alterazione del numero o della struttura di uno o più cromosomi),
multifattoriali (concorrono più geni ed intervengono fattori esterni affinché si instauri la malattia); a
queste si aggiunge una categoria particolare, quella delle malattie mitocondriali.
Ereditarietà monogenica
Molte malattie ereditarie dell'uomo sono determinate da mutazioni in singoli geni e sono quindi
trasmesse come caratteri monogenici.
In questo le malattie monogeniche si differenziano da quelle multifattoriali, ma questa distinzione
non è così netta, perché molte malattie monogeniche presentano sintomi che variano - per tipo e
gravità - da individuo a individuo, spesso per la presenza di geni modificatori diversi.
Le malattie monogeniche si possono trasmettere con tre modalità diverse:
-Autosomica dominante: Si verifica quando la presenza di un solo allele alterato è sufficiente per
dare origine alla malattia. La malattia quindi si manifesta sia negli individui eterozigoti che
omozigoti.
3
E' come se l'allele alterato dominasse su quello normale, per questo si parla di trasmissione
dominante. Per questa modalità di trasmissione non esistono portatori sani.
Si dice autosomica per differenziarla dalla trasmissione legata all' X.
-Autosomica recessiva: Perché si verifichi la malattia è necessario che entrambi gli alleli siano
alterati. La malattia quindi si manifesta solo negli individui omozigoti, mentre gli eterozigoti sono
portatori sani. Si dice autosomica per differenziarla dalla trasmissione legata alla X.
-Legata all' X: Si verifica quando l'alterazione riguarda geni contenuti nel cromosoma X. In questo
caso- a differenza della trasmissione autosomica - le probabilità di ammalarsi sono diverse nei
maschi e nelle femmine.
Le femmine eterozigoti in genere sono portatrici sane; i maschi eterozigoti -che in questo caso si
dicono emizigoti - si ammalano.
Non esistono maschi portatori sani.
Lo studio dell'albero genealogico permette in molti casi di distinguere tra questi diversi meccanismi
ereditari individuando il modello di trasmissione di una determinata malattia monogenica.
Eredità Cromosomica
Le malattie causate da anomalie cromosomiche sono tra le più importanti cause di morte prenatale o
di malattie congenite. Esse derivano da variazioni nel numero o nella struttura dei cromosomi.
La presenza di un cromosoma soprannumerario è detta trisomia (es. trisomia 21 o sindrome di
Down). Al contrario, la mancanza di un cromosoma è detta monosomia (es. sindrome di Turner).
Anomalie cromosomiche da modificazioni della struttura cromosomica
Le anomalie di struttura dei cromosomi hanno origine da rotture o da un alterato ricongiungimento
allorché un cromosoma subisce una rottura.
La più tipica anomalia strutturale è la delezione, ossia la perdita di una porzione più o meno grande
di cromosoma (es. sindrome del "crì du chat" da delezione del braccio corto del cromosoma 5).
A volte, come conseguenza di una rottura di una porzione di cromosoma si ha il trasferimento di
questa parte su un altro cromosoma: questa anomalia è detta traslocazione. Se con questo
riarrangiamento non viene perso DNA i soggetti eterozigoti sono clinicamente normali.
Eredità Multifattoriale
La maggior parte dei caratteri dell'essere umano non segue la trasmissione Mendeliana, ma è
determinata dall'intervento di più geni, che spesso interagiscono con l'ambiente. Questi caratteri, a
differenza di quelli monogenici, non sono facilmente riconoscibili con l'analisi dell'albero
genealogico.
Sono molti i difetti congeniti e le malattie dell'adulto che vengono ereditati come caratteri
multifattoriali. I fattori che concorrono a determinare la manifestazione del carattere si chiamano
fattori di suscettibilità. Quando il numero dei fattori di suscettibilità di una malattia supera un
determinato valore detto soglia la patologia ad essi legata comparirà.
Il numero di persone che superano il valore soglia definiscono la cosiddetta prevalenza della
malattia nella popolazione.
4
Nel caso di matrimonio tra consanguinei il numero medio dei fattori di suscettibilità di una
determinata malattia è superiore a quello del resto della popolazione.
Un numero elevato di persone affette da una determinata malattia in una stessa famiglia, o la
particolare gravità di essa, indica la presenza, in quella famiglia, di un numero relativamente elevato
di fattori di suscettibilità.
Eredità Mitocondriale
I mitocondri sono dei corpuscoli contenuti nel citoplasma della cellula che contengono un proprio
DNA, che possiede caratteristiche differenti dal DNA contenuto nel nucleo della cellula stessa:
è soggetto a mutazioni spontanee più frequentemente;
possiede meccanismi di riparazione poco efficaci;
è presente in oltre un migliaio di copie in ogni cellula;
viene trasmesso con eredità materna non mendeliana;
In questo tipo di ereditarietà l'espressione della malattia è in funzione della quantità di genomi
mutati presenti in ciascun organo e dalla dipendenza dell'organo dai processi ossidativi i quali
vengono proprio svolti nei mitocondri.
Il cuore, i muscoli ed il cervello sono pertanto gli organi più spesso colpiti da una malattia con
eredità mitocondriale.
Poiché il DNA mitocondriale interagisce con il DNA nucleare si possono distinguere tre gruppi di
malattie mitocondriali geneticamente determinate:
dovute a difetti del DNA nucleare;
dovute a difetti del DNA mitocondriale;
dovute a difetti di "comunicazione" tra i due genomi;
LA DIAGNOSI PRENATALE
Lo scopo della diagnosi prenatale (DP) è quello di offrire ai genitori e al medico le migliori
informazioni possibili sui rischi di dare alla luce un bambino affetto da un'anomalia congenita o da
una malattia genetica.
Fondamentalmente, possiamo dividere le tecniche di DP in due tipi: quelle invasive e quelle non
invasive.
- Si dice non invasiva una tecnica che permette di analizzare il feto "dall'esterno", senza rischi di
alterazioni o danni per la madre o per il nascituro. Le metodiche di DP non invasive attualmente
piu' in uso sono l'ecografia, il tri-test, la valutazione della translucenza nucale ed in alcuni casi il bitest.
-Si dice invasiva una tecnica di DP che comporta la penetrazione nella cavità uterina.
Le metodiche di DP invasive più utilizzate sono l'amniocentesi (prelievo di liquido amniotico), la
villocentesi (prelievo dei villi coriali), e la funicolocentesi (prelievo di sangue fetale). Non si tratta
di tecniche di analisi, ma di procedure di prelievo, che permettono di ottennere materiale di origine
fetale: cellule, liquidi o tessuti biologici. Il campione verrà poi analizzato in laboratorio utilizzando
a seconda dei casi tecniche biochimiche, citogenetiche o molecolari.
Le tecniche di diagnosi non invasive:
5
1)
2)
3)
4)
L'ecografia
La traslucenza nucale
Il TRI-TEST
Il BI-TEST
L'ecografia
L'esame ecografico si basa sulla capacità dei tessuti di riflettere particolari onde sonore chiamate
ultrasuoni.Questo permette di avere un immagine dell'interno dell'utero e del feto. L'ecografia
fornisce molte informazioni sul decorso della gravidanza e sullo stato del feto, come ad esempio:
- la localizzazione intra-uterina o extra-uterina della gravidanza
- l'eventuale presenza di gemelli
- l'epoca di gravidanza
- la crescita, la posizione e la vitalità del feto
- lo stato della placenta
- il sesso del feto
- la presenza di malformazioni fetali
- lo stato del liquido amniotico
- la presenza di alcune anomalie cromosomiche
Per la sua utilità e innocuità, l'esame ecografico è ormai praticato a scopo preventivo su tutte le
gestanti e a diverse epoche della gravidanza.
La traslucenza nucale
Un esame di recente introduzione è l'ecografia per la valutazione della translucenza nucale, che
evidenzia se nella parte posteriore della nuca del feto vi è un accumulo di liquido. Questa
condizione può infatti essere associata ad un problema genetico.
Viene effettuata tra la decima e la quattordicesima settimana di gestazione, in caso di rischio elevato
si può procedere per tempo a ulteriori analisi (villocentesi o amniocentesi).
Il TRI-TEST
Il tri-test si effettua preferibilmente tra la 15a e la 17a settimana di gravidanza, consiste nel
dosaggio di tre ormoni circolanti nel sangue materno durante la gravidanza, tali sostanze prodotte
dal feto e dalla placenta sono l'alfafetoproteina (AFP), l'estriolo-non-coniugato (uE3) e la
gonadotropina corionica (hCG).
L'epoca di gestazione va determinata con esattezza, infatti, la concentrazione degli ormoni varia
durante la gravidanza.
La valutazione combinata di queste tre sostanze e di altri parametri (eta' materna, peso, fumo, etcc.)
permette di individuare le donne con un rischio aumentato di partorire un feto affetto da Sindrome
di Down, difetti del tubo neurale o da altre anomalie cromosomiche.
Iil TRI-TEST può stabilire se esiste una probabilità' maggiore rispetto ad un valore di riferimento
scelto (cut-off), che il feto sia affetto, ma non significa che il feto sia sicuramente malato. Il valore
del cut-off, puo' cambiare da regione a regione.
La diagnosi puo' essere accertata solo attraverso l'indagine citogenetica fetale (amniocentesi).
In questo caso e' la coppia che deve decidere se sottoporsi o meno all'amniocentesi, non e' infatti
obbligatorio eseguire l'amniocentesi.
Un rischio di S. di Down inferiore al cut-off, non esclude completamente la possibilita' che il feto
sia affetto dalla Sindrome o da altre anomalie cromosomiche. Il tri-test e' in grado di individuare
circa 2 feti su 3 affetti da S. di Down e 3 feti su 4 affetti da trisomia 18.
Il BI-TEST
6
Il bi-test e' sostanzialmente sovrapponibile al tri-test, infatti si tratta anche in questo caso di una
stima di rischio. In molti centri e' svolto solo a livello sperimentale poiché si tratta di un esame di
recente introduzione.
Viene preferibilmente effettuato fra la 10ma e la 12a settimana di gravidanza, in questo modo si ha
a disposizione più tempo in caso si rendessero necessari ulteriori accertamenti.
E' importante tenere presente che che sia il tri-test che il bi-test consentono esclusivamente una
valutazione probabilistica, cioè, non permettono di identificare o di escludere direttamente le
anomalie cromosomiche ma di selezionare pazienti a basso e ad alto rischio.
Le tecniche invasive di prelievo:
1) L'amniocentesi
2) Il prelievo dei villi coriali
3) La funicolocentesi
L'amniocentesi
L'amniocentesi consiste nel prelievo, mediante un ago sottile, di liquido amniotico, cioè del liquido
che circonda il feto all'interno dell'utero. L'ago viene introdotto di solito attraverso l'addome, tutta
l'operazione viene guidata tramite ecografia, per evitare di procurare danni al feto o alla madre.
Nel liquido amniotico si trovano alcune cellule fetali (chiamate amniociti), che vengono prelevate
ed utilizzate per le analisi citogenetiche e/o molecolari.
L'analisi del liquido amniotico può dare importanti indicazioni sulla presenza di malattie genetiche.
Una proteina del liquido amniotico che viene frequentemente misurata è l'alfa-feto-proteina (AFP),
prodotta dal feto.
Quando il valore di AFP è elevato, può indicare la possibilità di malformazioni fetali, come difetti
del tubo neurale (spina bifida, anencefalia o meningocele), difetti della parete addominale e altri.
L'amniocentesi non è un procedimento doloroso (più o meno come una normale puntura), è veloce e
si pratica senza anestesia.
L'amniocentesi si può praticare a partire dalla 15a - 16a settimana di gravidanza.
Come tutte le procedure invasive, l'amniocentesi presenta una certa percentuale di rischio di aborto
spontaneo, calcolata intorno allo 0.5 per cento (se praticata da personale esperto e ben attrezzato).
Per questo motivo - oltre che per il costo - l'amniocentesi non viene offerta di routine a tutte le
madri, ma solo nei casi considerati a rischio.
Il prelievo dei villi coriali
E' una procedura che consiste nel prelievo di un minuscolo frammento di tessuto dalla placenta (o
meglio dal corion, la parte di placenta che "appartiene" al feto).
Il prelievo avviene per via transcervicale (cioè attraverso la cervice uterina) o per via
transaddominale (come l'amniocentesi), a secondo della posizione della placenta. Le cellule fetali
ottenute con il prelievo vengono poi utilizzate per le indagini citogenetiche e/o molecolari.
Quali sono i pro e i contro del prelievo dei villi coriali rispetto all'amniocentesi?
Vantaggi: Rispetto all'amniocentesi, il prelievo dei villi coriali offe il vantaggio di poter essere
effettuato più precocemente (intorno alla 10a - 12a settimana di gravidanza).
Svantaggi: il prelievo dei villi coriali presenta un rischio più elevato di aborto: circa il 2 per cento.
Inoltre, dato che non viene prelevato liquido amniotico, non è possibile effettuare indagini
biochimiche sul liquido. Generalmente, il prelievo dei villi coriali si utilizza quando esiste un
rischio elevato di malattie genetiche. Questo perchè, pur essendo più rischioso, il prelievo dei villi
coriali permette una diagnosi più precoce.
La funicolocentesi
7
Consiste nel prelievo di sangue fetale dal cordone ombelicale. Si pratica per la diagnosi di alcune
malattie ereditarie del sangue., o per verificare lo stato di salute del feto nel caso in cui la mamma
abbia contratto alcune gravi malattie infettive durante la gravidanza.
Le tecniche di analisi:
1) Le tecniche citogenetiche
2) Le tecniche di indagine molecolare
Le tecniche citogenetiche
Si tratta di indagini diagnostiche che permettono di stabilire il numero e le caratteristiche dei
cromosomi di un individuo. Per la diagnosi prenatale si analizzano i cromosomi delle cellule fetali
prelevate dal liquido amniotico o dai villi coriali. I cromosomi possono essere analizzati al
microscopio dopo.avere subito particolari trattamenti che li rendono visibili.
L'analisi citogenetica consente l'individuazione di aberrazioni cromosomiche, cioè anomalie nel
numero e nella struttura dei cromosomi. Ad esempio, indica con sicurezza se il feto è affetto da
Sindrome di Down (in cui è presente un cromosoma 21 in più).
Le tecniche di indagine molecolare
Si tratta di metodiche che studiando direttamente il DNA. permettono di, diagnosticare le
alterazioni genetiche conosciute,altrimenti invisibili all'esame citogenetico. La maggior parte delle
alterazioni, infatti, è talmente piccola che non provoca alcuna modificazione visibile nella struttura
dei cromosomi.
Esistono oggi tecniche di biologia molecolare talmente sensibili da permettere l'analisi anche di
campioni piccolissimi.
La diagnosi molecolare di una malattia è possibile solo se si conoscono le alterazioni genetiche che
la causano: si può così analizzare il DNA alla ricerca di queste alterazioni. A volte per la diagnosi è
necessario analizzare anche altri componenti della famiglia, soprattutto se affetti dalla malattia.
I limiti della diagnosi prenatale
La DP non può stabilire in assoluto se il nascituro sarà sano, ma può, in alcuni casi, indicare se sia o
meno portatore di una determinata alterazione genetica.
Anche se per moltissime malattie la DP offre un responso certo, per altre, purtroppo, non fornisce
una indicazione sicura al 100 per cento, ma la risposta può essere è espressa sotto forma di
probabilità percentuale; non si tratta di un limite specifico della DP, ma dipende dal grado di
accuratezza delle tecniche oggi a disposizione, per l'analisi genetica.
Spesso la stessa anomalia genetica può avere effetti molto diversi da un individuo all'altro. Alcune
malattie possono presentarsi in forma più o meno grave, oppure avere un'età di esordio variabile.
In questi casi la DP è in grado di identificare l'anomalia genetica ma non può predire se il nascituro
svilupperà la malattia in forma lieve o grave, né prevedere l'età di esordio.
E' quindi dovere dello specialista e del consulente genetico informare i genitori sull'accuratezza
della diagnosi nel caso specifico.
Le tecniche di tipo invasivo comportano una percentuale di rischio abortivo. In alcuni casi questo
rischio è trascurabile rispetto agli enormi benefici che una DP offre per al nascituro. Ad esempio:
- Alcune malattie genetiche sono curabili se diagnosticate precocemente.
Già da oggi, e si spera sempre di più in futuro, per alcune gravi malattie genetiche è importante una
diagnosi precoce, che permetta di instaurare tempestivamente una terapia.
Un esempio è offerto dalla SCID, una grave immunodeficienza che si può curare con il trapianto in
utero.
8
- Per alcune malattie, una DP permette in ogni caso di pianificare una serie di interventi importanti,
prima e dopo la nascita.
LA TERAPIA GENICA
Le basi della terapia genica
Si definisce terapia genica la procedura che consente di trasferire materiale genetico (DNA) allo
scopo di prevenire o curare una malattia. Nel caso delle malattie genetiche, in cui un gene è
difettoso o assente, la terapia genica consiste essenzialmente nel trasferire la versione funzionante
del gene nell’organismo del paziente, in modo da rimediare al difetto. In altre patologie si può
invece voler uccidere in modo mirato le cellule patologiche. Solitamente questo approccio è molto
diffuso nella terapia genica contro il cancro. Alcuni geni possono essere infatti trasferiti nelle
cellule tumorali in modo da causare la morte delle cellule che li ricevono. Un’altra strategia ancora
prevede il trasferimento di geni all’interno di cellule malate allo scopo di bloccare il meccanismo
alterato che causa la malattia.
L’idea di base della terapia genica è semplice, tuttavia la sua realizzazione pratica è un vero e
proprio percorso ad ostacoli.
La terapia genica è una scienza giovane: il primo tentativo fu effettuato negli Stati Uniti da Michael
Blaese nel 1990 su una bambina affetta da SCID, una grave immunodeficienza ereditaria. Da allora,
nonostante gli indubbi progressi raggiunti, sono ancora pochissimi i tentativi di terapia genica per i
quali si possa parlare di un successo dal punto di vista clinico. Il successo della terapia genica
rimane una prospettiva per il prossimo futuro. Ad oggi, le numerose ricerche condotte in tutto il
mondo hanno soprattutto lo scopo di migliorare le conoscenze biologiche di base e le metodiche di
terapia genica perché possa finalmente diventare uno strumento efficace nelle mani dei medici.
Anche se tutti i protocolli di terapia genica si basano essenzialmente sugli stessi principi ed
utilizzano metodiche simili, ogni malattia – oltre che l’isolamento del gene o dei geni specificirichiede spesso anche la messa a punto di una metodica differente. Molto spesso è il bersaglio ad
essere differente: ad esempio, i tentativi di terapia genica per curare la fibrosi cistica hanno come
principale bersaglio le cellule delle vie aeree, mentre quelli per le immunodeficienze mirano a
trasferire il gene nelle cellule del sangue. E’ evidente che ognuna di queste malattie, oltre che i
problemi comuni a tutte le tecniche di terapia genica, pone delle sfide tecniche peculiari.
Terapia genica in vivo e terapia genica ex-vivo
Le procedure di terapia genica in vivo mirano a trasferire il DNA direttamente nelle cellule o nei
tessuti del paziente. Nelle procedure ex-vivo, invece, il DNA viene dapprima trasferito in cellule
isolate dall’organismo e cresciute in laboratorio. Le cellule così modificate possono essere
reintrodotte nel paziente. Questa procedura indiretta, anche se più lunga, offre il vantaggio di una
migliore efficienza di trasferimento e la possibilità di selezionare e amplificare le cellule modificate
prima della reintroduzione.
Prima tappa: l’isolamento del gene
9
La prima tappa verso la terapia genica è l’identificazione del gene responsabile di una malattia o
coinvolto in un processo patologico. Un gene è una porzione di DNA che contiene le informazioni
necessarie a fabbricare una proteina. Quindi prima di pensare a trasferire un pezzo di DNA in un
paziente per riparare un difetto è necessario "avere in mano" il pezzo giusto.
Questa prima tappa si chiama isolamento o clonaggio del gene. Nessuna malattia è candidata alla
terapia genica fino a che non sia stato isolato il gene (o i geni) da trasferire.
Grazie ai progressi della biologia molecolare e della genetica questa prima tappa è oggi
relativamente più semplice rispetto a qualche anno fa. E’ stato possibile isolare numerosi geni
responsabili di malattie genetiche, ed altri se ne scoprono quasi ogni settimana.
Trasferimento del DNA nelle cellule bersaglio
Che si tratti di procedure in-vivo o ex-vivo lo scopo è lo stesso: il gene deve essere trasferito
all’interno delle cellule bersaglio, e una volta inserito deve "resistere" per un tempo sufficiente. In
questo tempo il gene “sano” deve essere funzionale e produrre sufficienti quantità di proteina,
rimediando così al difetto genetico.
Si possono riassumere tutte queste caratteristiche in un solo concetto: il gene estraneo si deve
esprimere in modo efficace nell’organismo ospite.
Il sistema più semplice sarebbe naturalmente quello di iniettare direttamente il DNA (DNA "nudo")
nelle cellule o nei tessuti da curare. Nella pratica questo sistema risulta estremamente inefficace: il
DNA nudo viene captato molto difficilmente dalle cellule. Inoltre questo processo richiede
l’iniezione di ogni singola cellula o gruppo di cellule del paziente.
Per questo quasi tutte le tecniche correnti per il trasferimento del materiale genetico implicano l’uso
di vettori, in grado di trasportare il DNA all’interno delle cellule "bersaglio" dell’ospite. I vettori
possono essere virali o non virali.
I vettori virali sono virus manipolati geneticamente in modo da non risultare pericolosi, che però
mantengono la capacità naturale di infettare le cellule dell’ospite e introdurre materiale genetico
all’interno. Con le tecniche di ingegneria genetica è possibile aggiungere al DNA del virus il gene
che si vuole trasferire. Così il virus, infettando la cellula bersaglio, porterà con sé una o più copie
del gene desiderato. I vettori virali possono essere di diverso tipo:
-i retrovirus che hanno la capacità di integrare il loro DNA all’interno dei cromosomi delle
cellule bersaglio determinando l’inserimento stabile del gene nei cromosomi della cellule infettata e
il suo trasferimento a tutte le cellule figlie; i retrovirus infettano solo cellule che stanno
proliferando;
-i lentivirus, come l'HIV, che permettono di trasferire materiale genetico anche in cellule che
non proliferano, come le cellule "mature" (es. neuroni, cellule del fegato ) o in cellule
particolarmente refrattarie ai retrovirus (es. cellule staminali prelevate del midollo osseo);
i virus adenoassociati che integrano il loro DNA nei cromosomi della cellula ospite come i
retrovirus, ma hanno rispetto a questi il vantaggio di essere per natura innocui; difficilmente
trasportano geni di grandi dimensioni.
-gli adenovirus, che non si integrano nei cromosomi della cellula ospite, ma possono
trasportare geni di grosse dimensioni; tuttavia la loro espressione non dura nel tempo.
virus dell’herpes simplex infettano soltanto alcuni tipi di cellule, in particolare i neuroni e sono
quindi indicati per la terapia di patologie neurologiche.
Per quanto riguarda i vettori non virali, i liposomi sono essenzialmente gli unici vettori non virali
correntemente utilizzati. Si tratta di sferette lipidiche all’interno delle quali viene impacchettato il
DNA da trasferire. Rispetto ai virus, hanno il vantaggio di non presentare alcun rischio in termini di
sicurezza, ma tendono ad avere un efficienza minore e ad essere poco selettivi.
10
Altre metodiche non basate sull’uso dei virus come trasportatori di geni per la terapia genica, sono
oggetto di sperimentazione.
I limiti della terapia genica
Sono numerosi i problemi irrisolti della terapia genica con i quali si trovano a combattere gli
scienziati.
La sicurezza della procedura
Questo è un problema particolarmente evidente per i vettori virali. Alcuni di questi derivano infatti
da virus pericolosi, come l’HIV. E’ quindi necessario che prima dell’utilizzo questi vettori siano
privati della virulenza originaria del virus e mantengano invece inalterata la capacità di infettare le
cellule bersaglio.
Efficienza di trasferimento
Negli studi sulla terapia genica, la maggior parte degli sforzi si concentra oggi sulla ricerca di
vettori in grado di trasferire il DNA in modo efficiente e di inserirlo stabilmente nelle cellule.
Selettività del bersaglio
In questi ultimi anni sono stati messi a punto una varietà di vettori, alcuni dei quali in grado di fare
esprimere il gene estraneo in uno specifico tipo cellulare (come i globuli bianchi, le cellule del
muscolo, delle vie respiratorie ecc…).
Durata dell’espressione del gene trasferito
La terapia genica risulta praticamente inutile se l’espressione del gene "estraneo" non viene
mantenuta per un tempo sufficiente. Le ricerche mirano a sviluppare sistemi che permettono un
espressione duratura, in modo da sottoporre il paziente ad un unico trattamento, o al limite a
trattamenti ripetuti a distanza di qualche anno.
La reazione immunitaria
Come ogni altra sostanza estranea, il prodotto del gene nuovo, il gene stesso e soprattutto il vettore
possono scatenare una risposta immunitaria da parte dell’organismo ospite. Questa può portare
all’eliminazione delle cellule modificate geneticamente, o all’inattivazione della proteina prodotta
dal nuovo gene, annullando quindi tutti gli effetti della terapia. Nello sviluppo delle nuove strategie
di terapia genica si cerca di evitare per quanto possibile che il vettore o il gene estraneo producano
una reazione immunitaria.
Le sperimentazioni cliniche in corso
Nel 1989 è stata approvata la prima sperimentazione sull’uomo di un protocollo di terapia genica.
Da allora, di più di mille protocolli sono stati approvati in tutto il mondo; di questi alcuni si sono
conclusi, altri sono in corso. Più del 90% delle sperimentazioni sono in fasi molto precoci del
protocollo (fase I o II) (vedi figura1). Queste fasi iniziali permettono di valutare l’eventuale
tossicità del trattamento, l’efficacia del trasferimento genico e l’espressione a breve/medio termine
del materiale genetico introdotto.
E’ nelle fasi successive (dalla III) che si valuta invece in modo più approfondito la reale efficacia
del trattamento in funzione della cura.
Ad oggi, la FDA americana (Food and Drug Administration), l’ente governativo cui spetta
l’approvazione di nuovi trattamenti terapeutici affinché possano essere introdotti nella pratica
medica corrente, non ha autorizzato la commercializzazione di nessun prodotto di terapia genica.
11
Tuttavia la ricerca in questo campo cresce a ritmi sempre più rapidi sia negli Stati Uniti che in altre
parti del mondo ed l’FDA è impegnata in un attento monitoraggio delle sperimentazioni.
ELENCO DELLE MALATTIE GENETICHE EREDITARIE
ACONDROPLASIA
ACROMATOPSIA CONGENITA
Agammaglobulinemia legata all'X tipo Bruton
ALBINISMO OCULARE tipo 1
AMILOIDOSI SISTEMICHE EREDITARIE
ANEMIA DI FANCONI
ANEMIA FALCIFORME
ANGIOEDEMA EREDITARIO
ANOMALIE CROMOSOMICHE
ATASSIA DI FRIEDREICH
ATASSIE SPINOCEREBELLARI
ATROFIA MUSCOLARE SPINALE TIPO I, II, III
AUTISMO
CARDIOMIOPATIA ARITMOGENA DEL VENTRICOLO DESTRO (ARVD)
CARDIOMIOPATIA DILATATIVA FAMILIARE
CARDIOMIOPATIA IPERTROFICA FAMILIARE
CEROIDOLIPOFUSCINOSI
CINCA
CISTINURIA
COLOBOMA
DEFICIT ALFA-1-ANTITRIPSINA
DEFICIT DI ADESIONE LEUCOCITARIA (LAD)
DEFICIT G6PD (FAVISMO)
DEFICIT SELETTIVO DI IgA
DIABETE GIOVANILE
DIFETTI DEL COMPLEMENTO
DISTONIA
DISTROFIA FACIOSCAPOLOMERALE
DISTROFIA MIOTONICA
DISTROFIA MUSCOLARE DI BECKER
DISTROFIA MUSCOLARE DI DUCHENNE
DISTROFIE DEI CINGOLI
EMOCROMATOSI EREDITARIA
EMOFILIA
EPIDERMOLISI BOLLOSA
EPILESSIE
FENILCHETONURIA
FIBROSI CISTICA
GLICOGENOSI
IMMUNODEFICIENZA CON IPER IGM
IMMUNODEFICIENZE COMBINATE GRAVI (SCID)
IMMUNODEFICIENZE DA DIFETTI DEI FAGOCITI
IMMUNODEFICIENZE PRIMITIVE
IPERCOLESTEROLEMIA FAMILIARE
12
IPERTERMIA MALIGNA
IPEX
LEUCODISTROFIA METACROMATICA
MALATTIA DI CHARCOT-MARIE-TOOTH
MALATTIA DI GAUCHER
MALATTIA DI HUNTINGTON
MALATTIA DI VON WILLEBRAND
MALATTIA GRANULOMATOSA CRONICA
MALATTIE LISOSOMIALI
MALATTIE METABOLICHE EREDITARIE
MALATTIE MITOCONDRIALI
MORBO DI ALZHEIMER
MORBO DI PARKINSON
NEUROFIBROMATOSI DI TIPO 1
NEUROFIBROMATOSI DI TIPO 2
OSTEOGENESI IMPERFETTA
PARAPLEGIA SPASTICA EREDITARIA
PORFIRIE
PSEUDOXANTHOMA ELASTICUM
RENE POLICISTICO
RETINITE PIGMENTOSA
SCLEROSI LATERALE AMIOTROFICA
SCLEROSI TUBEROSA
SINDROME 18-p (Delezione 18-p)
SINDROME ADRENO GENITALE
SINDROME DEL QT LUNGO
SINDROME DI ALPORT
SINDROME DI ANGELMAN
SINDROME DI BRUGADA
SINDROME DI CRIGLER-NAJJAR
SINDROME DI DOWN
SINDROME DI EDWARDS (TRISOMIA 18)
SINDROME DI KALLMANN
SINDROME DI KLINEFELTER
SINDROME DI LEIDEN
SINDROME DI LOWE
SINDROME DI MARFAN
SINDROME DI MARTIN BELL
SINDROME DI MC CUNE-ALBRIGHT - Displasia Fibrosa
SINDROME DI MENKES
SINDROME DI MOEBIUS
SINDROME DI PATAU (TRISOMIA 13)
SINDROME DI POLAND
SINDROME DI PRADER WILLI
SINDROME DI RETT
SINDROME DI SHWACHMAN
SINDROME DI SMITH-LEMLI-OPITZ
SINDROME DI TIMOTHY
SINDROME DI TURNER
13
SINDROME DI WEST
SINDROME DI WILLIAMS
SINDROME DI WISKOTT-ALDRICH
SINDROME X FRAGILE
SORDITA' EREDITARIE
TACHICARDIA VENTRICOLARE Polimorfa Catecolaminergica
TALASSEMIA ALFA
TALASSEMIA BETA
TELANGIECTASIA EMORRAGICA EREDITARIA, HHT
TROMBOFILIA EREDITARIA
MALATTIE IN DETTAGLIO
ALBINISMO OCULARE tipo 1
Nome Inglese: Ocular albinism (OA1)
Frequenza: 1:50.000
Che cos'è: L’albinismo oculare di tipo 1 è una forma di depigmentazione che colpisce
prevalentemente l’epitelio pigmentato dell’occhio, mentre la pelle e i capelli sono di solito
normalmente pigmentati. A differenza di altre forme di albinismo, nell’albinismo oculare di tipo 1
non è alterata la produzione di melanina ma bensì la sua distribuzione all’interno delle cellule.
Come si manifesta: La depigmentazione dell’epitelio pigmentato dell’occhio causa riduzione
dell’acuità visiva (diminuzione della vista), nistagmo (movimenti involontari degli occhi),
strabismo e fotofobia (ipersensibilità e conseguente fastidio alla luce). Infatti, i problemi maggiori si
manifestano nella retina, la parte dell’occhio in cui si trovano i fotorecettori (cellule deputate a
ricevere lo "stimolo visivo").
Le cause: Nel 1995 un gruppo di ricercatori dell’Istituto Telethon di Genetica e Medicina (TIGEM)
ha identificato il gene che risulta alterato nelle persone affette da questa malattia. Il gene è chiamato
OA1 e si trova sul cromosoma X: contiene le informazioni necessarie per produrre un recettore
importante per regolare la formazione dei melanosomi, strutture contenenti melanina e presenti
all’interno delle cellule pigmentate (melanociti).
Come si trasmette: La trasmissione è recessiva legata al cromosoma X: la malattia si manifesta nei
maschi ed è trasmessa da femmine portatrici del gene mutato. Le portatrici possono manifestare
sintomi, anche se in misura minore rispetto ai maschi affetti. Ad ogni gravidanza una donna
portatrice presenta un rischio del 50% di generare un figlio maschio affetto dalla malattia ed un
rischio del 50% di generare una figlia a sua volta portatrice.
La diagnosi: La diagnosi viene effettuata dall’oculista attraverso l’osservazione del fondo oculare,
che dimostra nei pazienti maschi una diffusa ipopigmentazione della retina. Inoltre è necessario
analizzare il fondo oculare anche nella madre del paziente. La caretteristica peculiare del fondo
14
oculare della madre portatrice di albinismo oculare di tipo 1 è la presenza di zone di
ipopigmentazione retinica accanto a zone normalmente pigmentate. Queste due indagini insieme
permettono di distinguere l’albinismo oculare di tipo 1 da altre forme di albinismo.
Esiste una terapia: Al momento non esiste una cura per questa malattia. Sono di aiuto degli
occhiali particolari. A volte, può essere indicato l’intervento chirurgico per lo strabismo.
ANEMIA FALCIFORME
Sinonimi: drepanocitosi
Nome Inglese: Sickle-cell disease (SCD)
Frequenza: variabile nelle diverse popolazioni.
Che cos'è l'Anemia Falciforme: L'anemia falciforme (AF) è una malattia genetica del sangue,
caratterizzata da anemia cronica (scarsità di globuli rossi e di emoglobina) e da episodi dolorosi più
o meno frequenti in varie parti del corpo, causati dall'occlusione dei vasi sanguigni.
L'AF prende il nome dalla forma "a falce" che assumono i globuli rossi dei malati, ed è
particolarmente frequente nelle regioni del mediterraneo (soprattutto in Africa).
Come si manifesta: L'AF non ha un decorso clinico uguale per tutti: alcune persone affette
mostrano sintomi molto lievi, mentre altre mostrano disturbi anche molto gravi. I disturbi principali
causati dall'AF sono:
Anemia cronica. I globuli rossi che contengono emoglobina S vengono distrutti molto prima di
quelli normali. Mentre la vita media di un globulo rosso normale è di circa 120 giorni, quella dei
globuli "falciformi " non supera in genere i 20 giorni. Questo causa una penuria di globuli rossi, e
quindi anemia (con senso continuo di fatica, pallore, "fiato corto" etc..)
Infezioni. I globuli rossi vengono ditrutti soprattutto nella milza, che può così risultare danneggiata.
La milza ha un ruolo importante anche nel proteggere l'organismo dalle infezioni, ed è per questo
che per le persone affette da AF (specialmente i bambini) alcune infezioni batteriche possono
risultare molto pericolose.
Dolori alle mani e ai piedi (dactilite -hand-foot syndrome-). Dolori e tumefazioni del dorso delle
mani e dei piedi (dactilite) sono causati dall'occlusione dei capillari da parte dei globuli rossi
alterati. Spesso questo è uno dei primi sintomi dell'AF nei bambini.
Dolori improvvisi. L'occlusione dei capillari può avvenire in modo imprevedibile in qualunque
parte del corpo, bloccando l'afflusso di sangue agli organi colpiti. La frequenza di queste "crisi" è
molto variabile: in alcuni pazienti sono rare (meno di una volta all'anno), mentre altri possono
averne anche 15 o più in un anno. Il dolore può durare poche ore oppure diverse settimane e può
richiedere un ricovero ospedaliero. I dolori sono la manifestazione più frequente dell'AF.
Sindrome polmonare acuta. E' una delle complicazioni più pericolose dell'AF, simile ad una
polmonite, causata dall'infiltrazione di gloguli rossi nei polmoni o da infezioni polmonari. Nel
peggiore dei casi, questa manifestazione può anche risultare letale.
Ictus. E' un rischio possibile, a causa dell' occlusione dei capillari che portano il sangue al cervello.
15
Le cause: L'AF, come le talassemie, è causata da alterazioni nel gene che dirige la produzione
dell'emoglobina, una grossa proteina contenuta nei globuli rossi, la cui funzione è quella di catturare
l'ossigeno dai polmoni e trasportarlo nei diversi tessuti. L'emoglobina raccoglie anche l'anidride
carbonica prodotta nei tessuti e la trasporta ai polmoni, dove viene eliminata. L'emoglobina è
costituita da 4 catene proteiche più piccole (chiamate sub-unità). Negli adulti ogni molecola di
emoglobina contiene 2 subunità dette di tipo alfa e 2 subunità dette di tipo beta. Nella AF le
alterazioni colpiscono la subunità di tipo beta, e danno origine ad una forma anomala di
emoglobina, chiamata emoglobina S. Le molecole di emoglobina S tendono facilmente ad
aggregarsi fra loro, formando dei microscopici filamenti all'interno del globulo rosso. A causa di
ciò, i globuli rossi diventano rigidi ed assumono la caratteristica forma "a falce" - o a mezzalunainvece della forma normale a disco. Questi globuli rossi sono incapaci di scorrere normalmente
all'interno dei capillari (vasi strettissimi dove i globuli rossi normali passano proprio grazie alla loro
elasticità) e quindi tendono a bloccarsi, causando "ingorghi" nella circolazione.
Come si trasmette: L'AF si trasmette geneticamente con una modalità chiamata autosomica
recessiva. In altre parole, un individuo presenta i sintomi della malattia solo se possiede
un'alterazione in entrambe le copie del gene per l'emoglobina beta che possiede. Chi invece ha una
copia del gene normale e una alterata è un portatore sano e non presenta alcun sintomo. Questo
significa che un bambino malato può nascere solo se entrambi i genitori sono portatori sani
dell'alterazione genetica che provoca la malattia. Una coppia di portatori sani avrà una probabilità
del 25%, ad ogni gravidanza, di concepire un figlio o una figlia malati, del 50% di avere un figlio o
una figlia portatori sani, del 25% di avere un figlio o una figlia sani e non portatori. Per le coppie in
cui uno dei partner appartenga ad una famiglia a rischio, un colloquio con un consulente genetista è
indispensabile per valutare le possibilità di dare alla luce figli affetti dalla malattia. I portatori sani
sono facilmente identificabili con un esame del sangue ed è anche possibile effettuare la diagnosi
prenatale.
Esiste una terapia: Attualmente, nessuna terapia è in grado di risolvere completamente i problemi
e i rischi causati dall'AF. Tuttavia, molti trattamenti si sono evoluti negli ultimi anni ed hanno
portato ad un sensibile miglioramento delle condizioni di vita delle persone affette da AF: Farmaci
antidolorifici sono utili per sedare le crisi di dolore più o meno frequenti; il trattamento preventivo
con antibiotici fin dalla prima infanza permette di limitare i rischi di infezione; regolari trasfusioni
di sangue possono aumentare il numero di globuli rossi normali, limitando i problemi alla milza e il
rischio di complicanze; una nutrizione adeguata, il riposo e una vita sana contribuiscono a limitare
gli effetti della malattia; Il trattamento con un farmaco chiamato idrossiurea, sperimentato già dal
1995, ha dato risultati molto positivi, ed è oggi utilizzato dagli specialisti per trattare le persone
affette da AF. Si tratta di un farmaco che da anni viene usato come antitumorale. Di recente si è
scoperto che questa farmaco ha anche l'effetto di aumentare la produzione di emoglobina fetale (un
tipo di emoglobina che normalmente non viene prodotta nell'adulto). La presenza di emoglobina
fetale ha l'effetto di "diluire" la quantità di emoglobina S presente nei globuli rossi e di limitare i
sintomi della malattia. Anche se gli effetti a lungo termine dell'idrossiurea non sono ancora noti, è
dimostrato che il trattamento porta ad una diminuzione delle crisi dolorose e diminuisce
sensibilmente il rischio di complicanze; pertanto è stato approvato come trattamento da effettuarsi
sotto stretto controllo medico. L'idrossiurea ha effetti collaterali anche gravi e solo uno specialista
pratico di AF può decidere le modalità del trattamento.
ANOMALIE CROMOSOMICHE
Nome Inglese: Chromosomal abnormalities, chromosome disorders.
16
Frequenza: 1/170 neonati.
Che cosa sono le anomalie cromosomiche: Con questa definizione si indicano tutte le alterazioni
che riguardano il numero o la struttura dei cromosomi
Le anomalie cromosomiche sono responsabili di circa il 50% degli aborti spontanei e sono
un’importante causa di malformazioni.
Si stima che 1 neonato su 170 presenti un’anomalia cromosomica.
I vari tipi di anomalie cromosomiche:
Le anomalie numeriche
Le monosomie sono condizioni in cui un cromosoma è presente in singola copia anziché in duplice
copia. Il numero totale di cromosomi è quindi 45 invece di 46. Ad esempio, monosomia 5 indica la
presenza di un solo cromosoma 5 invece di due.
L’assenza totale di un autosoma è talmente grave da essere incompatibile con la vita: pertanto
quando è presente in un feto causa un aborto spontaneo.
Talvolta si indica con il termine monosomia anche l’assenza di un braccio cromosomico, invece che
dell’intero cromosoma. L’assenza di un braccio cromosomico è a volte compatibile con la vita,
come nel caso della 18p-. Questa sindrome è causata dall’assenza del braccio corto (p) del
cromosoma 18, e viene detta anche monosomia 18p.
La monosomia 18p non è però una vera e propria anomalia numerica dei cromosomi (il numero
totale di cromosomi è 46) ma piuttosto una anomalia strutturale (una delezione - vedi più avanti).
Le trisomie sono condizioni in cui un cromosoma è presente in triplice copia, il numero totale di
cromosomi è quindi 47 invece di 46.
Le uniche trisomie che si riscontrano nella vita post-natale sono la trisomia del cromosoma X nelle
femmine, la trisomia 21, la trisomia 18, la trisomia 13. Le altre trisomie complete non sono
compatibili con la vita e quando sono presenti in un feto sono causa di aborto spontaneo.
Il termine trisomia viene impiegato anche per indicare la presenza in triplice copia di una regione
cromosomica. Ad esempio, la trisomia 9p consiste nella presenza in triplice copia del braccio corto
del cromosoma 9. Anche in questo caso non si tratta di una vera e propria anomalia numerica, ma
piuttosto di una anomalia strutturale dovuta a duplicazione o traslocazione (vedi più avanti).
Il meccanismo che più comunemente causa una trisomia è la non disgiunzione dei cromosomi
durante la divisione cellulare che porta alla formazione di ovociti e spermatozoi: anziché separarsi
l’uno dall’altro nelle 2 cellule figlie, i 2 cromosomi di una coppia vanno entrambi nella stessa
cellula figlia. Pertanto, in seguito alla fecondazione tale cromosoma sarà presente in 3 copie anziché
in 2 copie.
La causa della non disgiunzione non è ancora nota, anche se è stato dimostrato che l’età materna è
un fattore di rischio per eventi di non disgiunzione: all’aumentare dell’età tale evento si verifica più
frequentemente.
17
Le anomalie strutturali
Le delezioni consistono nella perdita di un frammento di cromosoma le cui dimensioni possono
essere molto diverse. Le delezioni si possono evidenziare in un cariotipo attraverso l’assenza di una
o più bande cromosomiche, o addirittura di un intero braccio, come avviene ad esempio nella
sindrome 18p.
L’effetto di una delezione dipende dalla grandezza della porzione mancante e dal tipo di
informazione genetica in essa contenuta: in una sola banda cromosomica possono trovarsi centinaia
di geni.
Le microdelezioni, rispetto alle delezioni, consistono nella perdita di frammenti cromosomici più
piccoli e non sono evidenziabili attraverso un normale cariotipo. Esempi di sindromi da
microdelezione sono: la s. di Prader-Willi, la s. di Angelmann, la s. di Di George, la s. di Williams.
La perdita di materiale genetico è in genere nell’ordine di una o qualche decina di geni.
Le duplicazioni e microduplicazioni consistono nella presenza in due copie di uno stesso frammento
di cromosoma: è come se una o più parole di una frase fossero ripetute. Ad esempio, la malattia di
Charcot-Marie-Tooth 1A è causata da una microduplicazione che coinvolge un frammento posto sul
braccio corto del cromosoma 17 (11p).
Le inversioni consistono nel distacco di un frammento che successivamente si riposiziona sul
cromosoma, dopo una rotazione di 180°.
Le traslocazioni consistono nel trasferimento di materiale tra due o più cromosomi diversi.
Le traslocazioni bilanciate sono il caso più fortunato: consistono infatti nello “scambio alla pari” di
frammenti fra cromosomi diversi. Questo tipo di traslocazione non comporta perdita di materiale
genetico e perciò i portatori di una traslocazione bilanciata non manifestano in genere alcun segno
clinico.
Nel caso di una traslocazione non bilanciata, uno o più cromosomi in seguito alla traslocazione
hanno subito la perdita di materiale genetico, mentre altri ne hanno in sovrappiù.
Chi è portatore di una traslocazione bilanciata, pur non manifestando alcun sintomo, rischia di avere
figli portatori di traslocazioni patologiche (non bilanciate).
Le cause: Un feto o un bambino colpiti da un’anomalia cromosomica hanno quasi sempre genitori
perfettamente normali. La causa delle anomalie cromosomiche è in genere da ricercarsi in un errore
accidentale durante la formazione delle cellule-uovo o degli spermatozoi dei genitori. Durante la
formazione delle cellule riproduttive i cromosomi subiscono un complesso processo di divisione e
di “rimescolamento” ed è possibile, anche se relativamente raro, che insorgano alterazioni
cromosomiche. Un discorso a parte riguarda le alterazioni cromosomiche che insorgono durante la
vita adulta e che sono alla base di numerose forme di tumore. In genere, questo tipo di alterazioni
avviene in una singola cellula di un individuo adulto che diventa cancerogena ed origina una
popolazione (clone) di cellule tumorali. Un esempio molto noto è quello della leucemia mieloide
cronica che è causata da una traslocazione fra il cromosoma 9 ed il cromosoma 22. In moltissimi
altri tipi di cellule tumorali è possibile riscontrare anomalie cromosomiche che contribuiscono alla
18
trasformazione maligna. Il rapporto fra i tumori e le anomalie genetiche non è però fra gli argomenti
di cui si occupa Informagene e pertanto non verrà trattato in questa scheda.
La diagnosi: L’assetto cromosomico di un individuo, cioè il numero di cromosomi, il tipo di
cromosomi sessuali ed eventuali anomalie (numeriche o strutturali) è anche definito cariotipo. Per
esaminare il cariotipo di un individuo adulto si utilizzano generalmente i globuli bianchi ottenuti da
un semplice prelievo di sangue. In seguito ad opportune procedure e colorazioni, è possibile rendere
visibili al microscopio i cromosomi presenti nel nucleo di queste cellule. Si possono studiare i
cromosomi anche da cellule del midollo osseo, della placenta, del liquido amniotico e da alcuni
tessuti in cui sono presenti cellule in fase di crescita. Il cariotipo di un feto, ad esempio, può essere
analizzato da cellule fetali presenti nel liquido amniotico, nei villi coriali o nel sangue fetale (vedi la
scheda sulla diagnosi prenatale). Il settore della genetica che si occupa dello studio dei cromosomi è
detto citogenetica e quindi l’analisi cromosomica è spesso indicata come analisi citogenetica.
Ognuno di noi possiede 46 cromosomi, di cui:
· 2 cromosomi sessuali: il cromosoma X e il cromosoma Y. Le femmine possiedono 2 copie del
cromosoma X (XX), i maschi possiedono 1 cromosoma X e 1 cromosoma Y (XY).
· 44 cromosomi "non sessuali" (autosomi) uguali 2 a 2. In altre parole, 22 coppie di autosomi.
· ogni cellula dell'individuo possiede lo stesso corredo cromosomico di 46 cromosomi.
Il cariotipo di un maschio normale è quindi 46, XY. Di questi, X e Y sono i cromosomi sessuali: il
cromosoma X è ereditato dalla madre, il cromosoma Y dal padre.
Il cariotipo di una femmina normale è 46, XX. L’unica differenza rispetto al maschio risiede nei
cromosomi sessuali, che in questo caso sono rappresentati solo dal cromosoma X: uno è ereditato
dalla madre, l’altro dal padre.
E’ possibile distinguere i cromosomi in base alla loro dimensione ed alla loro forma. Inoltre, con
specifiche colorazioni è anche possibile evidenziare delle bande trasversali all’interno di ogni
cromosoma, che identificano precise regioni. I cromosomi sono numerati progressivamente in base
alle loro dimensioni: il cromosoma 1 è il più grande di tutti mentre il cromosoma 22 è il più piccolo.
In ogni cromosoma si distinguono un braccio corto, indicato come “p”, un braccio lungo, indicato
come “q” ed una costrizione centrale detta “centromero”.
L’analisi del cariotipo fetale permette di evidenziare anomalie numeriche e strutturali dei
cromosomi del feto. Mentre le anomalie numeriche sono evidenziabili facilmente, alcune anomalie
strutturali, come ad esempio le microdelezioni, possono essere di più difficile identificazione e
richiedono metodiche di analisi più sofisticate.
AUTISMO
Nome Inglese: Autism; Autistic Disorder (AD)
Frequenza: ~10/10.000 (autismo); 30-60/10.000 (insieme dei disturbi dello spettro autistico)
Che cos'è: L’autismo è un disturbo caratterizzato da gravi problemi nella comunicazione, nelle
interazioni sociali e nel comportamento, i cui sintomi si manifestano entro i primi tre anni di età.
Altre condizioni, come ad esempio la Sindrome di Asperger, presentano caratteristiche in comune
con l’autismo, tanto che l’insieme di queste patologie viene incluso nella definizione più generica di
Disturbi dello Spettro Autistico o Disturbi Pervasivi dello Sviluppo.
19
Come si manifesta: Lo Spettro Autistico comprende una vasta gamma di manifestazioni, dalle
forme più gravi di autismo, in cui gli individui possono essere privi di linguaggio, socialmente
isolati, gravati da comportamenti stereotipati e con profonda disabilità intellettuale, alle forme più
leggere in cui gli individui manifestano problemi nella comunicazione e interazione sociale,
mostrano scarsa flessibilità o interessi ristretti, ma hanno capacità intellettive e di linguaggio nella
norma.. In questo caso sono autosufficienti per quanto riguarda le attività pratiche della vita
quotidiana, ma il deficit dell’interazione sociale condiziona pesantemente l’inserimento nel lavoro,
nella famiglia e in qualsiasi tipo di attività sociale.
Le cause: Le cause specifiche dell’autismo sono generalmente sconosciute. Tuttavia, da una serie di
studi condotti negli ultimi decenni è emerso che i disturbi dello spettro autistico sono in gran parte
determinati da fattori genetici. Per esempio, studi su gemelli hanno indicato che nel caso di coppie
di gemelli monozigotici (che quindi hanno lo stesso patrimonio genetico), nel 60%-85% dei casi se
uno dei due è affetto, anche l’altro lo sarà, mentre è molto più raro che coppie di gemelli dizigotici
(che hanno il 50% dei geni in comune, come i normali fratelli) siano entrambi affetti. A parte il caso
di gemelli identici, è relativamente raro che una coppia abbia più di un figlio con autismo. La
probabilità che una coppia che ha già un figlio affetto ne abbia un secondo è circa il 2-6% : tuttavia
rispetto alla prevalenza dell’autismo nella popolazione generale, ciò corrisponde ad un rischio 1060 volte maggiore rispetto all’atteso. E’ chiaro quindi che alla base dell’autismo ci sono delle
importanti determinanti genetiche, anche se queste sono molto complesse. Fatta eccezione per una
minoranza di casi (< 10%) in cui l’autismo risulta associato ad anomalie cromosomiche o a malattie
a trasmissione mendeliana, quali la Sclerosi Tuberosa e la Sindrome dell’X Fragile, per la maggior
parte dei casi non è stata ancora individuata una specifica causa genetica. Si ritiene che l’autismo
sia una condizione “multifattoriale”, cioè che non sia dovuto all’effetto di un singolo gene, bensì
alla presenza di varianti in più geni che singolarmente non sono sufficienti a scatenare la patologia,
ma che se presenti contemporaneamente concorrono alla predisposizione al disturbo autistico. Non
esiste quindi il gene dell’autismo, ma probabilmente una serie di geni che predispongono alla
malattia. Alcuni dati suggeriscono anche che la piena espressione clinica del disordine dipenda da
complesse interazioni fra la predisposizione genetica ed altri fattori biologici (come ad esempio il
virus della rosolia) non ancora identificati
Esiste una terapia: Il trattamento dei bambini con autismo si basa essenzialmente su interventi
educativi, che siano per quanto possibile precoci ed intensivi. Questi sono basati su valutazioni
puntuali dei punti di forza e di debolezza di ogni singolo soggetto fatte da personale altamente
specializzato. Da queste valutazioni deve scaturire un programma personalizzato che deve essere
condiviso e praticato da tutti i naturali educatori del bambino: genitori e insegnanti in primo luogo. I
genitori devono essere informati sulle specificità del disturbo autistico e formati ad applicare quei
metodi psico-educativi che si sono mostrati utili all’acquisizione dell’autonomia nelle attività della
vita quotidiana e, in prospettiva, ad un inserimento lavorativo. Le migliori possibilità di riuscita
sono riconosciute essenzialmente ai metodi cognitivo-comportamentali, in particolare se applicati
nell’ambito di una strategia globale che coinvolge tutti gli ambienti di vita del soggetto, come per
esempio indicato nel TEACCH (Treatment and Education of Autistic Children and Communication
Handicapped). I percorsi educativi possono essere modellati in varia maniera, includendo ausilii di
tipo visivo, opportuni rinforzi comportamentali, potenziamento delle abilità meno compromesse del
soggetto autistico e sono articolati in maniera da prevedere la partecipazione attiva dei genitori e di
educatori opportunamente preparati. In considerazione della variabilità del quadro clinico, nessuno
dei provvedimenti sopra indicati presenta pari efficacia in tutti i casi di autismo. In casi specifici,
alcuni farmaci utilizzati per il trattamento di altri disturbi neurologici sono utilizzati per attenuare
parte dei sintomi associati all’autismo.
20
DEFICIT G6PD (FAVISMO)
Nome Inglese: glucose-6-phosphate dehydrogenase deficiency (G6PD
Frequenza: variabile nelle diverse popolazioni
Che cos'è: Il deficit di G6PD, o “favismo” è una condizione determinata dalla carenza dell’enzima
glucosio-6-fosfato-deidrogenasi (G6PD), importante in una via metabolica minore del glucosio.
Questa via metabolica è uno dei modi in cui l’organismo utilizza il glucosio disponibile, ed è
importante soprattutto nei globuli rossi maturi per proteggere la membrana cellulare dai danni
ossidativi causati da numerosi farmaci e sostanze.
Il deficit di G6PD è definito una condizione farmacogenetica: i sintomi della malattia si
manifestano, nella maggioranza delle persone affette, solo in seguito all’esposizione a fattori
scatenanti, quali ingestione di fave (da cui il nome favismo), ma anche digiuno, infezioni,
somministrazione di alcuni farmaci (ad esempio aspirina, antimalarici, sulfamidici). Un numero
ristretto di pazienti mostra costantemente i sintomi della malattia.
Come si manifesta: Il difetto di G6PD si manifesta con emolisi, cioè rottura della membrana dei
globuli rossi e conseguente rilascio di emoglobina, necessaria per il trasporto di ossigeno ai diversi
tessuti. Per questo motivo si può instaurare un’anemia (basso numero di globuli rossi) di tipo
emolitico (cioè dovuto alla rottura dei globuli rossi). Nella maggioranza delle persone affette
l’emolisi si manifesta solo in seguito ad esposizione ai fattori scatenanti. Nei pazienti che mostrano
costantemente emolisi, l’esposizione ai fattori scatenanti può aggravare il quadro clinico. Nelle
persone affette da deficit di G6PD, a causa dell’insufficiente attività dell’enzima G6PD, i globuli
rossi diventano estremamente sensibili allo stress ossidativo. Determinate sostanze sono in grado di
causare, in misura più o meno intensa, stress ossidativo: si tratta di un processo chimico che può
danneggiare, se non viene contrastato da appositi meccanismi naturali, diversi componenti della
cellula. Nelle persone non affette lo stress ossidativo è “assorbito” grazie anche a reazioni piuttosto
complesse cui partecipa l’enzima G6PD. I globuli rossi maturi, mancando di nucleo e ribosomi
(organelli importanti per la sintesi delle proteine), sono incapaci di produrre nuove proteine per
sostituire quelle degradate. Nelle persone affette dal deficit di G6PD lo stress ossidativo porta a lisi
selettiva dei globuli rossi più vecchi. I globuli rossi giovani, infatti, hanno livelli più alti di attività
di G6PD rispetto ai globuli rossi più vecchi e quindi sono più resistenti al danno ossidativo. In un
soggetto con deficit di G6PD ma per il resto normale, il midollo osseo risponde alla lisi dei globuli
rossi, causata dallo stress ossidativo, aumentandone la loro produzione; finché il midollo osseo è in
grado di aumentare la produzione di globuli rossi l'anemia emolitica (anemia derivante dalla lisi dei
globuli rossi) è auto-limitante.
Le cause: Le informazioni necessarie per la produzione deIl’enzima G6PD sono contenute in un
gene che si trova sul cromosoma X. Esistono numerose varianti di questo gene che portano alla
produzione di G6PD con diverso grado di attività. Le forme che causano manifestazioni patologiche
sono caratterizzate da una grave riduzione dell’attività enzimatica. Le varianti di G6PD vengono
distinte in 5 classi a seconda del livello di attività enzimatica e delle manifestazioni cliniche: la
classe 1 comprende le varianti con minore attività enzimatica e che presentano emolisi cronica (le
forme più gravi ma anche più rare). All’aumentare della classe aumenta il livello di attività di G6PD
e le manifestazioni cliniche sono meni gravi. I soggetti portatori di varianti di classe 2 o 3
manifestano l’emolisi solo in seguito ad esposizione a fattori scatenanti.
21
Come si trasmette: Il difetto si trasmette come carattere legato al cromosoma X, dato che il gene
interessato si trova sul cromosoma X. Il quadro clinico è più grave nei maschi: essi possiedono un
unico cromosoma X e se il gene è alterato presentano unicamente la copia alterata del gene. Nelle
femmine, che possiedono 2 cromosomi X, il difetto del gene alterato è parzialmente mascherato
dalla copia corretta del gene presente sul secondo cromosoma X ed il quadro clinico è generalmente
più lieve.
La diagnosi: Un difetto di G6PD deve essere preso in considerazione in ogni caso di emolisi
cronica e specialmente nei casi di emolisi acuta. I soggetti portatori del difetto possono essere
identificati sia mediante analisi biochimiche, che permettono di valutare l’attività dell'enzima
G6PD, sia con analisi diretta del gene interessato.
Esiste una terapia: Non esiste attualmente una terapia in grado di restituire funzionalità all'enzima
G6PD nelle persone affette; pertanto i portatori del difetto devono evitare accuratamente tutte le
sostanze che possono causare crisi emolitiche.
DIABETE GIOVANILE
Sinonimi: Diabete mellito insulinodipendente; diabete tipo 1
Nome Inglese: Diabetes Mellitus, Juvenile-Onset- insulin-dependent
Frequenza: 2-4/1.000
Che cos'è il Diabete Giovanile: Con il termine diabete si intende genericamente un aumento della
glicemia (la quantità di glucosio nel sangue) al di sopra dei valori normali.
Le diverse forme di Diabete: Il diabete si distingue in due tipi, tipo 1 e tipo 2. Si tratta di due
malattie a origine diversa anche se i danni che possono provocare sono simili perché dovuti
all’aumento della glicemia che persiste negli anni. La frequenza totale di persone diabetiche
(comprendendo quelle note e quelle non ancora diagnosticate o delle forme latenti) è stimato in
circa il 4% della popolazione generale. Questa percentuale aumenta molto se ci si concentra in una
popolazione anziana. Nel 85% dei casi si tratta di diabete di tipo 2, solo in una piccola percentuale
(15%) si tratta di diabete mellito di tipo 1.
Come si manifesta: Il diabete mellito di tipo 1 (detto anche diabete giovanile, diabete insulinodipendente, magro o chetoacidotico) si manifesta di solito a partire dall’infanzia e richiede la terapia
insulinica per la sopravvivenza. La terapia insulinica prevede iniezioni di insulina ad ogni pasto e
un’ulteriore iniezione prima di andare a letto. La dose di insulina deve essere scelta dal paziente
sulla base della misurazione della glicemia (su una goccia di sangue ottenuto pungendo il
polpastrello di un dito con un ago) da eseguire prima di ogni iniezione di insulina, della quantità e
qualità del pasto e dell’attività fisica. Lo scopo è mantenere la glicemia il più possibile vicino ai
valori normali per evitare le complicanze (danni vascolari alla retina dell’occhio, ai reni, al sistema
nervoso periferico e centrale, alle arterie degli arti inferiori, coronariche, ecc.) senza però incorrere
22
nell'ipoglicemia, che può essere causata da un eccesso di insulina e che può essere anche molto
pericolosa Si tratta quindi di una navigazione a vista, quotidiana, che richiede molta pazienza
perché dura tutta la vita. Esistono oggi speciali apparecchi (pompe a insulina) che permettono una
somministrazione programmata di insulina, evitando di ricorrere alle continue iniezioni. Un
apparecchio che permette la misura del glucosio senza ricorrere al prelievo di sangue, di recente
sperimentazione, è stato da poco autorizzato per la commercializzazione negli Stati Uniti.
Le cause: Il diabete mellito di tipo 1 è di origine autoimmune. Per ragioni ancora ignote, a un certo
punto della vita, nel bambino o nel giovane, il sistema immunitario si mette ad aggredire le cellule
del pancreas che producono insulina e le distrugge. Quando le cause di questo processo anomalo
saranno chiarite, si potrà forse prevenire il diabete di tipo 1. Mentre la ricerca deve andare avanti, è
fondamentale che i pazienti con il diabete mellito di tipo 1 siano ben curati mantenendo la glicemia
il più possibile vicino alla norma per evitare le complicanze. Le basi genetiche del diabete giovanile
sono estremamente complesse e tuttora oggetto di studio.
DISTROFIA MUSCOLARE DI DUCHENNE
Nome Inglese: Duchenne muscular dystrophy (DMD)
Frequenza: 1,5/10000
Che cos'è la Distrofia Muscolare di Duchenne: E’ una forma di distrofia muscolare trasmessa
come carattere legato all’X che determina degenerazione progressiva delle fibre muscolari. E’
dovuta all’assenza di una proteina detta Distrofina. L’assenza di questa proteina determina una serie
di eventi che portano a degenerazione del tessuto muscolare, che viene sostituito da tessuto fibroso
e adiposo. La conseguenza clinica è una progressiva perdita di forza muscolare con conseguente
progressiva perdita delle abilità motorie.
Come si manifesta: Non si sa quando la malattia realmente inizi, ma i sintomi cominciano a
vedersi più o meno intorno ai tre anni di vita. I genitori notano che il bambino ha difficoltà nel
correre, salire le scale, alzarsi da terra, non riesce a saltare. Questi problemi sono dovuti al
prevalente interessamento dei muscoli del cingolo pelvico e in particolare dei muscoli glutei.
Naturalmente, sebbene vi sia un interessamento prevalente dei distretti muscolari prossimali (cioè
vicini al tronco), la malattia è fin dall’inizio generalizzata. Alla visita si può notare molto
precocemente il peculiare aspetto “pseudoipertrofico” dei polpacci: sono voluminosi e alla
palpazione risultano di consistenza aumentata, perché il tessuto muscolare viene sostituito dal
tessuto fibroadiposo. A volte raccogliendo attentamente le notizie relative alle prime fasi dello
sviluppo di questi bambini si trova un lieve ritardo nell’acquisizione delle tappe motorie e in
particolare della deambulazione e con discreta frequenza si riscontra un ritardo nell’acquisizione del
linguaggio. In alcuni casi i problemi relativi alla sfera linguistica e cognitiva possono prevalenti
rispetto a quelli motori nei primi anni di vita, ritardando l’inquadramento diagnostico. Con il
progredire dell’età le difficoltà motorie diventano evidenti e al momento dell’ingresso nella scuola
elementare il quadro clinico è chiaro. I bambini hanno un’evidente pseudoipertrofia dei polpacci e a
volte anche del quadricipite femorale, accentuazione della fisiologica curvatura della regione
lombare della colonna vertebrale (iperlordosi lombare), scapole alate, andatura anserina, si alzano
da terra con una caratteristica manovra di arrampicamento (manovra di Gowers), corrono con fatica
e con una caratteristica andatura “da maratoneta”, salgono le scale con difficoltà, tenendosi al
corrimano. La malattia progredisce ulteriormente causando la perdita della deambulazione
23
autonoma entro i 12 anni di età e, sia pure più tardivamente, la progressiva perdita di funzione degli
arti superiori. Anche i muscoli respiratori e il cuore sono coinvolti: i soggetti sviluppano
invariabilmente una sindrome disventilatoria restrittiva e in un arco di tempo variabile da soggetto a
soggetto si renderà necessaria una ventilazione meccanica dapprima notturna e poi anche diurna.
Più variabile per età e gravità è il coinvolgimento cardiaco, che consiste nell’insorgere di una
cardiomiopatia dilatativa. In alcuni casi insorge in tempi relativamente precoci e acquista
un’importanza dominante nell’evoluzione clinica. L’aspettativa di vita dei soggetti affetti è ridotta
proprio a causa delle complicanze cardiache e respiratorie. Altri problemi clinici rilevanti sono la
scoliosi e le retrazioni articolari. Sebbene non condizionino direttamente l’aspettativa di vita dei
soggetti questi aspetti hanno importanza nel definire l’andamento clinico della DMD. La scoliosi
infatti, quando diventa particolarmente severa, oltre a creare problemi posturali può contribuire a
complicare la situazione respiratoria. Le retrazioni articolari possono contribuire e accelerare la
perdita della funzionalità motoria rendendo difficile per esempio il mantenimento della stazione
eretta. Nei casi (circa un 30%) che presentano un deficit cognitivo – di varia entità – questo resta
stabile nel tempo . Anche i soggetti con normale dotazione intellettiva possono avere lievi difficoltà
legate all’apprendimento della letto-scrittura o comunque nella processazione verbale. La Distrofina
è normalmente presente – e assente nei soggetti affetti da DMD -anche in alcune aree del Sistema
Nervoso Centrale: questo è probabilmente alla base del possibile coinvolgimento cognitivo, ma
molte cose non sono ancora chiare in quest’ambito.
Le cause: E’ una malattia genetica, legata ad un gene presente sul cromosoma X che codifica per la
proteina detta Distrofina. Solo i soggetti di sesso maschile presentano i sintomi della malattia ,
mentre le femmine portano l’alterazione genica senza manifestazioni cliniche, tranne rari casi nei
quali il fenotipo è comunque lieve. Nelle femmine infatti abbiamo due cromosomi X e la copia
“sana” del gene può compensare l’altra. Nei soggetti di sesso femminile si possono riscontrare:
aumento del livello di Creatin Kinasi (CK) nel siero, a volte polpacci voluminosi e lievi deficit di
forza; nel corso degli anni le femmine portatrici possono sviluppare problemi cardiaci. Il gene della
Distrofina è molto grande e le alterazioni responsabili della malattia possono essere delezioni (cioè
perdita di alcuni frammenti), mutazioni puntiformi (cioè sostituzioni nucleotidiche) o anche
duplicazioni. L’effetto di queste alterazioni è la mancata produzione della proteina.
La diagnosi: Nei bambini più piccoli (primo-secondo anno di vita) è più probabile dell’iter
diagnostico venga avviato a partire dal riscontro casuale di un aumento del livello di CK nel sangue,
nei bambini più grandi abitualmente è il riscontro di difficoltà motorie da parte dei genitori a
suggerire l’opportunità di una valutazione. All’esame obiettivo si riscontreranno i segni descritti
sopra (pseudoipertrofia dei polpacci, iperlordosi lombare, manovra di Gowers, difficoltà nel salire
le scale e nel salto…) . La diagnosi riposa poi sul riscontro dell’assenza della distrofina
documentato su un frammento di muscolo prelevato mediante biopsia muscolare e sull’analisi
genetica. Si può partire dall’analisi genetica, meno invasiva perché si effettua su un prelievo di
sangue, ma va detto che in circa il 30% dei casi di soggetti affetti le indagini genetiche routinarie
non consento di dimostrare alterazioni nel gene della Distrofina. Sarà pertanto necessario procedere
ad una biopsia per verificare l’assenza di distrofina nel muscolo e distinguere quindi il quadro da
altre forme di distrofia muscolare. La diagnosi prenatale è possibile mediante villocentesi e
amniocentesi . La ricerca di alterazioni del gene della Distrofina non fa parte delle indagini prenatali
di routine, ma viene effettuata in situazioni a rischio (presenza di soggetti affetti nel nucleo
familiare). Circa un terzo dei casi di DMD nasce da madri non portatrici, per nuove mutazioni (cioè
eventi accidentali). E’ in ogni caso essenziale una consulenza genetica per il nucleo familiare nel
quale sia stata fatta diagnosi di DMD.
24
Esiste una terapia: Al momento non esiste una terapia risolutiva per la malattia. E’ molto
importante una presa in carico globale, plurispecialistica, da parte di un centro specializzato che sia
in grado di gestire i molteplici aspetti della malattia in relazione all’evoluzione clinica e
comprensiva di un attento supporto emotivo per tutto il nucleo familiare. Gli interventi varieranno
secondo le specifiche necessità cliniche, in relazione all’età ma anche al peculiare andamento che
ogni bambino può presentare pur con la stessa diagnosi. Esistono comunque alcuni elementi comuni
fondamentali, quali la valutazione della funzionalità respiratoria in sonno e veglia e della
funzionalità cardiaca. Nelle fasi più avanzate della malattia sarà necessaria una ventilazione
meccanica assistita. Attualmente l’insufficienza respiratoria è ben controllata dalla ventilazione non
invasiva e la tracheotomia viene riservata ai casi –rari- nei quali non sia possibile controllare
altrimenti la situazione. L’impiego della ventilazione meccanica ha significativamente migliorato
sia la qualità sia la durata della vita dei soggetti affetti da DMD: oggi la sopravvivenza fino e in
alcuni casi oltre la terza decade è possibile. I problemi cardiaci possono essere contenuti , almeno
nelle prime fasi, con una terapia farmacologica. Tuttavia l’evoluzione della patologia a carico della
cellula miocardica rende inefficace la terapia e le condizioni generali non consentono di ipotizzare
un trapianto. Per quanto riguarda la fisiocinesiterapia, pur non esistendo un consenso univoco e
dimostrato scientificamente circa la sua utilità, il corretto momento di inizio del trattamento, la
frequenza ideale ecc, sono considerati importanti l’attenzione al controllo delle posture, allo
sviluppo di retrazioni e di scoliosi. Nei casi di scoliosi evolutiva che abbiano una discreta
funzionalità cardiaca e respiratoria si può valutare l’intervento di correzione chirurgica della
scoliosi. Non ci sono studi conclusivi sull’efficacia né sull’effetto dell’esercizio fisico sul muscolo
distrofico e la maggior parte dei dati è inferita dagli esperimenti sul modello animale (murino) che
tuttavia non è del tutto sovrapponibile a quello umano. Sembra tuttavia che esercizi che stimolino la
contrazione eccentrica del muscolo (per esempio scendere le scale, correre in discesa…) siano
dannosi, mentre un blando esercizio aerobico possa anche essere utile. Per i bambini in ogni caso
l’attività fisica costituisce un elemento estremamente importante nella vita emotiva e relazionale e
pertanto ci si limita di solito a consigliare di rispettare il limite della sensazione di fatica e a
sconsigliare sforzi eccessivi. Tentativi terapeutici Da anni è ormai invalso l’uso di steroidi nei
soggetti affetti da DMD. Vari studi, con diversi farmaci e diversa posologia hanno dimostrato una
discreta efficacia degli steroidi con riduzione della sensazione soggettiva di fatica e discreto
miglioramento nelle performance motorie. Rispetto alla storia naturale della malattia i soggetti
trattati deambulano per un tempo più lungo, sebbene la risposta alla terapia possa variare da
soggetto a soggetto. Non si hanno invece ancora dati certi sull’eventuale efficacia della terapia
steroidea sull’insorgenza dell’insufficienza respiratoria e sulla cardiomiopatia dilatativa. La
somministrazione di steroidi rende naturalmente necessari controlli clinici, ematochimici e
strumentali periodici per controllare l’eventuale comparsa di effetti collaterali.
EMOFILIA
Sinonimi: (Emofilia tipo A e B)
Nome Inglese: Hemophilia
Frequenza: 1/10 000 maschi (emofilia A); 1/50 000 maschi (emofilia B)
Che cos'è l'Emofilia: L'emofilia è una malattia ereditaria dovuta ad un difetto della coagulazione
del sangue. La coagulazione è il processo con cui, in caso di fuoriuscita dai vasi sanguigni, il sangue
forma un "tappo" composto da piastrine, cellule del sangue e fibrina, un componente del plasma.
25
La coagulazione è un processo complesso, che comporta l'attivazione di numerose proteine del
plasma in una specie di reazione a catena. Due di queste proteine, il fattore VIII ed il fattore IX -che
vengono prodotte dal fegato- sono assenti o difettose nelle persone affette da emofilia.
Le diverse forme di Emofilia: Esistono due forme diverse di emofilia:
- emofilia A, causata da deficienza di fattore VIII
- emofilia B, causata da deficienza del fattore IX.
I sintomi delle due malattie sono praticamente identici e solo tramite gli esami di laboratorio, o
conoscendo la storia familiare, il medico può differenziare questi due tipi di emofilia. Questa
differenza è importantissima ai fini della terapia, perché determinerà quale dei fattori bisognerà
eventualmente somministrare alla persona affetta.
Esiste un'altra malattia simile all'emofilia (la malattia di von Willebrand) che colpisce sia i maschi
che le femmine.
Si tratta di un difetto in un altro fattore della coagulazione (il fattore di von Willebrand) e di solito
non provoca sintomi molto gravi.
Come si manifesta: Entrambe le emofilie colpiscono solo i maschi, mentre le femmine possono
essere portatrici sane. Solo in rarissimi casi le femmine possono presentare i sintomi della malattia.
Le persone affette subiscono facilmente emorragie esterne ed interne più o meno gravi. L'emofilia si
manifesta essenzialmente in 2 forme:
Forma grave, in cui l'attività coagulativa è inferiore all'1% del normale. Le persone affette dalla
forma grave rischiano di avere gravi emorragie in seguito ad estrazioni dentarie, operazioni
chirurgiche o ferite. Un pericolo serio è la possibilità di emorragie interne apparentemente
spontanee, anche dopo traumi talmente lievi da passare quasi inosservati. Microtraumi possono
causare ripetute emorragie nelle articolazioni (chiamate emartri), causando dolori e rigidità
articolare. Altri sintomi più rari sono la presenza di sangue nelle urine (ematuria) o emorragie
intracraniche, che sono estremamente pericolose. La forma grave colpisce circa il 60-70 per cento
delle persone affette da emofilia ed i primi sintomi si verificano in genere quando il bambino
comincia a camminare.
Forma moderata o lieve, in cui le emorragie spontanee sono molto meno frequenti, così come i
problemi articolari. Alcune persone hanno una forma talmente lieve di emofilia che può passare
inosservata ed essere diagnosticata per caso in età adulta.
Le cause: I due tipi di emofilia A e B sono causati dall'alterazione di due geni diversi, situati
entrambi sul cromosoma X. Si conoscono diverse alterazioni in questi geni, ma tutte portano alla
produzione di fattore VIII o IX difettosi, oppure ne impediscono del tutto la produzione.
Come si trasmette: La trasmissione della malattia è legata al sesso: colpisce solo i maschi, mentre
le femmine sono portatrici sane. Una madre portatrice sana avrà ad ogni gravidanza 1 probabilità su
2 di concepire un figlio maschio malato, e 1 su 2 di avere una figlia portatrice. Non esistono maschi
portatori sani. I figli (maschi) di uomini malati sono sani (se la madre non è portatrice) mentre le
figlie saranno tutte portatrici. Nelle famiglie in cui siano presenti casi di emofilia è possibile
sottoporre le femmine all'analisi del DNA, che si effettua a partire da un normale prelievo di
sangue, per stabilire se siano portatrici. E' anche possibile effettuare la diagnosi prenatale nelle
gravidanze a rischio. Alcune donne portatrici hanno un'attività coagulativa più bassa del normale e
possono presentare alcuni lievi sintomi, come ad esempio la tendenza a perdere molto sangue
26
durante le mestruazioni. In circa 1 caso su 3 di emofilia A, possono nascere figli emofilici da
genitori sani. In questi casi l'alterazione genica si è verificata al momento della formazione degli
spermatozoi o degli ovuli. Se gli esami indicano chiaramente che nessuno dei genitori è portatore, le
possibilità di avere un altro figlio ammalato è bassa. Le coppie che temono di poter trasmettere
l'emofilia ai propri figli possono rivolgersi ad un centro di consulenza genetica, dove nel corso di un
colloquio potranno essere informati in modo preciso sulle possibilità di dare alla luce figli malati o
portatori, dopo aver eventualmente eseguito gli esami ritenuti opportuni.
La diagnosi: Il test di laboratorio più utilizzato è chiamato tempo di tromboplastina parziale (PTT).
Nelle persone affette da emofilia il tempo di tromboplastina parziale risulta più lungo del normale.
Altri valori, come il tempo di emorragia, il tempo di protrombina e la conta delle piastrine, sono
normali. La conferma e la tipizzazione dell’emofilia (se di tipo A o B, se lieve, moderata o severa)
viene poi avvalorata dal dosaggio delle proteine plasmatiche carenti (il fattore VIII o il fattore IX),
metodica ora abbastanza diffusa nei laboratori analisi di molti ospedali del territorio nazionale.
Esiste una terapia: Il trattamento per l'emofilia consiste nella terapia sostitutiva, cioè nella
somministrazione del fattore mancante (fattore VIII nell'emofilia A, fattore IX nella B). Fino a
pochi anni fa questa era una pratica necessaria ma rischiosa, perché l'unico modo per ottenere questi
fattori era quello di concentrarli partendo dal sangue di molti donatori, con un elevato rischio di
contrarre virus come l'HIV o l'HCV (responsabile di epatite). In anni passati, molti emofiliaci sono
stati contagiati da questi virus presenti nel sangue dei donatori; oggi questa possibilità è
improbabile, grazie ai maggiori controlli ed al trattamento del sangue dei donatori. Inoltre, oggi le
tecniche di ingegneria genetica permettono di ottenere gli stessi fattori in grande quantità, senza la
necessità di ricorrere a donatori, evitando così ogni pericolo di infezione: una parte sempre
maggiore di questi fattori sostitutivi viene prodotta tramite ingegneria genetica. La complicazione
principale della terapia sostitutiva è la comparsa, nel sangue dei riceventi, di anticorpi diretti contro
il fattore VIII o IX, che ne neutralizzano l'effetto, e che possono rendere difficile la terapia. Tutti i
farmaci, come l'aspirina, che hanno un effetto negativo sulla coagulazione, devono essere sempre
evitati. La frequenza della terapia sostitutiva va decisa dal medico in funzione del caso specifico. In
genere, le persone affette da forma grave necessitano di una terapia continua, mentre nelle forme
lievi la terapia sostitutiva si effettua generalmente in seguito a traumi, o in previsione di eventi
come operazioni chirurgiche, estrazioni dentarie etc... Molti centri hanno organizzato programmi
domiciliari che consentono ai pazienti di ricevere l'infusione ai primi sintomi. Nelle forme lievi di
emofilia A, per episodi emorragici minori si può usare la desmopressina, un farmaco capace di
determinare un aumento del 25-30 per cento del fattore VIII nel plasma.
EPILESSIE
Nome Inglese: MYOCLONUS EPILEPSY, EPILEPSY, GENERALIZED, IDIOPATHIC; EGI,
EPILEPSY, PARTIAL; EPT
Frequenza: circa 1 persona su 100; l’epilessia è molto diffusa, nei paesi industrializzati e colpisce
circa l’1% della popolazione: ciò significa, secondo le stime, oltre 500.000 cittadini e circa 24.000
nuovi casi all’anno solo in Italia. Sulla base dei rilievi di prevalenza (6-8% nei paesi sviluppati, fino
al doppio nei paesi in via di sviluppo) si calcola che 50 milioni di persone nel mondo soffrano di
epilessia
27
Che cos'è l'epilessia: Per la medicina moderna l’epilessia e’ una condizione caratterizzata dalla
presenza di episodi accessuali (le crisi) che si ripetono in modo apparentemente spontaneo nel
tempo. La base fisiologica e’ rappresentata dalla presenza di una eccessiva eccitabilita’ della cellula
nervosa (neurone) che determina la occasionale generazione di scariche epilettiche. Una sola crisi
non indica necessariamente che ci si trovi di fronte ad un caso di epilessia: infatti il 5% della
popolazione ha avuto una sola crisi in tutta la vita.
Le diverse forme di Epilessia: Nell’ambito dell’epilessia si distinguono forme cliniche diverse per
eziologia, presentazione clinica e prognosi. Le crisi si definiscono parziali quando la scarica
epilettogena inizia e si mantiene localizzata ad una popolazione ristretta di neuroni; se la scarica
inizia localmente ma si diffonde a vaste aree corticali vi puo’ essere una generalizzazione
secondaria. Le crisi primitivamente generalizzate sono invece sostenute d una scarica epilettica che
fin dal suo esordio interessa contemporaneamente ampie aree corticali di entrambi gli emisferi. Le
crisi epilettiche sono classificate come elaborato dalla commissione della International League
Against Epilepsy:
Crisi Parziali (semplici e complesse) e Crisi Generalizzate (toniche, cloniche, miocloniche,
atoniche, tonico-cloniche, convulsioni infantili, assenze).
Le sindromi epilettiche vengono cosi’ classificate: epilessie idiopatiche (con crisi parziali o
generalizzate) sono caratterizzate da esordio legato all’eta’, normale sviluppo psicomotorio e
assenza di danno cerebrale. Le epilessie idiopatiche sono caratterizzate da un meccanismo di
ereditarietà complesso (multifattoriale) in cui intervengono probabilmente più geni. Studi
epidemiologici hanno rivelato l'importanza del ruolo dei fattori genetici nella predisposizione alla
malattia, ma la trasmissione ereditaria non avviene con modalità prevedibili.
Le epilessie sintomatiche/criptogenetiche (con crisi parziali o generalizzate) rappresentano la
maggioranza delle epilessie, possono insorgere a qualsiasi eta’ e comprendono forme con danno
cerebrale individuato o ipotizzabile. Nelle epilessie sintomatiche, le crisi possono essere secondarie
a lesioni cerebrali, encefalopatie, malformazioni vascolari, tumori cerebrali, traumi postatali oppure
essere associate a malattie metaboliche o difetti congeniti (microcefalia, lissencefalia) per cui le
cause genetiche possono essere preponderanti. Ad esempio, le epilessie miocloniche progressive
sono malattie genetiche ad eredità autosomica recessiva (ad eccezione della MERRF, caratterizzata
da trasmissione materna mitocondriale).
Esistono infine condizioni associate ad epilessia che comprendono ad esempio le convulsioni
febbrili, in cui gli attacchi epilettici sono associati ad episodi febbrili. A seconda del tipo e della
durata della crisi si distinguono le convulsioni febbrili semplici e le convulsioni febbrili complesse.
Anche per le convulsioni febbrili è stata identificata una predisposizione familiare.
Come si manifesta: Il cervello è costituito da cellule nervose chiamate neuroni. La proprietà
fondamentale del tessuto nervoso è di emettere degli impulsi nervosi. Questi sono costituiti da un
passaggio di corrente elettrica che si genera nella cellula nervosa e si propaga ad altri neuroni con
cui essa prende contatto. Ogni funzione cerebrale (il movimento, il linguaggio, la vista, dipende da
una perfetta e complicatissima regolazione della trasmissione degli impulsi nervosi. Durante una
crisi epilettica avviene una improvvisa, abnorme e sincronizzata scarica di impulsi nervosi da parte
di un gruppo più o meno esteso di cellule nervose. Questo è il meccanismo comune ad ogni tipo di
crisi epilettica; ciò che può cambiare sono le manifestazioni cliniche, cioè i segni visibili delle crisi
Esiste una terapia: Terapia farmacologica. La terapia delle epilessie è in prima istanza di tipo
farmacologico (assunzione di uno o più farmaci). Tuttavia, il trattamento farmacologico può
28
diminuire o far cessare le crisi, ma non ne elimina le cause. Un soddisfacente controllo delle crisi
con minima incidenza di effetti collaterali si ottiene nel 70% dei casi, il restante 30% dei pazienti
risulta refrattario alla terapia farmacologica.
Trattamento chirurgico. In caso di fallimento della terapia farmacologica e in presenza di forme
debilitanti particolarmente gravi, si prende in esame la possibilità di intervenire chirurgicamente, a
condizione che la zona epilettogena sia ben individuata e circoscritta ed in un’area cerebrale la cui
aspertazione non causi deficits neurologici significativi. L’intervento di emisferectomia puo’ essere
preso in considerazione in alcuni casi di epilessia infantile associati a deficits neurologici gravi.
Altri trattamenti medici. ACTH e cortisonici vengono utlizzati nella sindrome di West ed in alcune
forme di epilessia infantile grave farmacoresistente. La vitamina B6 viene utilizzata per il
trattamento delle epilessie piridossino-dipendenti ad insorgenza infantile. La dieta chetogenica e’
basata sulla somministrazione di una dieta ricca di grassi e povera di carboidrati e proteine e risulta
efficace in pazienti con gravi epilessie farmacoresistenti in particolare in eta’ infantile. La
plasmaferesi e’ stata adottata in pazienti affetti da epilessia associata a encefalite di Rasmussen. Un
recente metodo ancora in fase di sperimentazione consiste nella stimolazione del Nervo Vago
utilizzando uno speciale "stimolatore" avente la funzione di rilasciare debolissimi impulsi elettrici
con lo scopo di contrastare le "scariche" anomali, causa prima delle crisi epilettiche. Si può guarire
dall’epilessia, tuttavia è più corretto parlare di "remissione" delle crisi perché è possibile che ci
siano delle ricadute anche a distanza di molti anni. Per guarigione o remissione totale delle crisi si
intende il completo controllo delle crisi indipendentemente dall’assunzione di farmaci oppure
l’assenza di crisi da almeno 4-6 anni, con EEG normale. Nel 60-70% dei casi è possibile ottenere
una "remissione totale" dopo 3-10 anni dall’inizio di una terapia farmacologica appropriata. In
alcuni casi (epilessia a Punte Rolandiche e Piccolo Male non associato a crisi di Grande Male) si
può parlare di "guarigione" perché le crisi scompaiono verso i 15 anni di età. Lo stesso vale per
molti casi di pazienti sottoposti ad interventi chirurgici positivamente conclusi.
FENILCHETONURIA
Nome Inglese: Phenylketonuria
Frequenza: 1/10000 nati indipendentemente dal sesso
Che cos'è la Fenilchetonuria: La fenilchetonuria (PKU) è una malattia metabolica ereditaria
potenzialmente grave. Quando il trattamento non viene instaurato tempestivamente. Subito dopo la
nascita, è caratterizzata dalla presenza di ritardo mentale irreversibile di grado medio - grave. Esiste
anche una forma benigna detta non-PKU HPA. La fenilchetonuria è una malattia ben conosciuta, e
grazie alla diagnosi precoce e ad un opportuna dieta è possibile prevenire completamente il
manifestarsi di questi gravi sintomi.
Come si manifesta: La manifestazione principale della fenilchetonuria è il ritardo mentale. Tuttavia
il ritardo mentale si può prevenire con un’alimentazione corretta, limitando l’assunzione di
fenilalanina; in questo modo è possibile prevenire i danni provocati, in particolare sul sistema
nervoso centrale, dall'accumulo dell’amminoacido. Poiché la fenilalanina è presente in molti
alimenti, la dieta risulta in pratica costituita da minime quantità di proteine di origine animale, e’
necessaria l’assunzione di integratori dietetici per garantire un adeguato apporto calorico e degli
altri amminoacidi, essenziali per una crescita corretta. La forma benigna non-PKU HPA non
richiede trattamento ed è compatibile con un’alimentazione normale. Un tempo si riteneva che fosse
sufficiente osservare il regime alimentare particolare fino alla pubertà, oggi molti esperti ritengono
che sarebbe meglio continuare la dieta per tutta la vita.
29
Le cause: La causa è rappresentata da alterazioni genetiche che provocano la carenza dell'enzima
fenilalanina idrossilasi. Questo enzima è responsabile del metabolismo della fenilalanina, un
amminoacido presente nelle cellule di tutti gli esseri viventi. Quando l’enzima non funziona in
maniera corretta, la fenilalanina non viene trasformata in tirosina e si accumula nei tessuti,
provocando danni all’organismo. Le conseguenze più gravi si hanno sullo sviluppo del sistema
nervoso centrale: al ritardo mentale si associano spesso manifestazioni di tipo neurologico
(ipercinesia, epilessia). A livello cutaneo è presente una caratteristica pigmentazione chiara (capelli
biondi ed occhi celesti).
Come si trasmette: La PKU si trasmette con modalità autosomico-recessiva Questo significa che
negli individui malati entrambe le copie del gene che codifica per la fenilalanina idrosillasi sono
alterate. Gli individui che possiedono una copia alterata del gene e una normale sono invece privi di
ogni sintomo, ma sono portatori sani. Potranno nascere bambini affetti da fenilchetonuria solo se
entrambi i genitori sono portatori sani. Due genitori portatori sani avranno una probabilità del 25 %
di avere figli affetti; dalla stessa unione i figli avranno una probabilità su due di nascere portatori
sani, come i genitori. Il gene che se mutato provoca la fenilchetonuria è stato isolato ed è localizzato
sul braccio lungo del cromosoma 12. Dal momento che le mutazioni che possono causare la
malattia sono oltre 400, l’analisi molecolare non è usata di routine nella diagnosi, che si avvale
invece del più semplice ed economico test di Guthrie.
La diagnosi: Su tutti i neonati viene eseguito uno screening di massa mediante il dosaggio
biochimico della fenilalanina (test di Guthrie) per l'individuazione tempestiva dei soggetti affetti da
fenilchetonuria: e’ un esempio classico di efficace intervento di medicina preventiva, che permette
di instaurare molto precocemente il trattamento idoneo e per questo e’ estremamente difficile, al
giorno d’oggi, riscontrare quello che in passato era il quadro clinico tipico della malattia. Occorre
tuttavia ricordare che questi programmi di screening sono ancora carenti o del tutto inesistenti nei
Paesi in via di sviluppo. Lo screening di massa si effettua nei primi giorni di vita dosando la
fenilalanina su una piccolissima quantità di sangue prelevata dal tallone del neonato (test di
Guthrie). Se viene riscontrato un aumento di fenilalanina nel sangue, si procede ad un
approfondimento della diagnosi presso un centro di riferimento. L’approfondimento diagnostico
permette di individuare con esattezza la specifica forma di PKU presente nel paziente in modo da
predisporre il trattamento più idoneo. In ogni regione italiana esiste almeno un centro di riferimento
per la diagnosi e il trattamento della fenilchetonuria. La diagnosi prenatale nelle gravidanze a
rischio è oggi possibile con un approccio di tipo molecolare. In Italia la sua applicazione ha trovato
un impiego limitato dato che comunque tutti i neonati nel nostro paese vengono sottoposti al test
neonatale di Guthrie e, in caso di positività, è possibile intervenire con una dieta per evitare le
conseguenze della malattia. La diagnosi prenatale rimane comunque un’opzione possibile per le
coppie a rischio (con uno o più figli fenilchetonurici).
Esiste una terapia: Grazie alla diagnosi precoce e ad un opportuna dieta è possibile prevenire
completamente il manifestarsi dei gravi sintomi della fenilchetonuria. Tuttavia, la dieta, per essere
efficace, deve essere adottata con estremo rigore e i suoi risultati devono essere controllati da
regolari valutazioni dei livelli plasmatici di fenilalanina. Per le donne fenilchetonuriche che
decidono di intraprendere una gravidanza, è indispensabile osservare uno strettissimo regime
dietetico che mantenga la concentrazione della fenilalanina nei limiti indicati. Le madri
fenilchetonuriche, che non hanno iniziato una dieta prima del concepimento e non l’hanno osservata
accuratamente per tutto il periodo della gravidanza, hanno un rischio molto elevato di avere figli
30
con ritardo mentale e malformazioni congenite (fetopatia da fenilchetonuria materna). Queste
indicazioni valgono non solo per le madri che presentano una forma grave di PKU, ma anche per le
donne che presentano la forma benigna, non-PKU HPA.
FIBROSI CISTICA
Sinonimi: Mucoviscidosi (vecchia denominazione; in Francia “mucoviscidose”, in Germania
“mucoviszidose”)
Nome Inglese: Cystic Fibrosis (CF)
Frequenza: Frequenza stimata nella popolazione di origine caucasica in Europa e Nord-America
circa 1:2.000-1:6.000 nati
Che cos'è la Fibrosi Cistica: La fibrosi cistica, nota anche col nome di mucoviscidosi, è una
malattia genetica.
Paradossalmente, è poco conosciuta, eppure si tratta della più comune fra le malattie genetiche
mortali nelle popolazioni di origine caucasica.
Nelle popolazioni occidentali, una persona su ventisette è portatrice della mutazione del gene che
provoca la malattia, senza avere alcun sintomo e un bambino ogni 2000-6000 nati è colpito dalla
malattia. In Italia vi sono circa 3500 pazienti seguiti nei centri regionali. Ogni anno dovrebbero
nascere circa 200 nuovi bambini colpiti dalla malattia.
Nella sua forma più grave, la fibrosi cistica colpisce diversi organi, principalmente il pancreas (da
cui il nome fibrosi cistica del pancreas), i polmoni, il fegato, l’intestino.
Il danno al pancreas è precocissimo e provoca difficoltà nella digestione e nell’assimiliazione dei
grassi. Un tempo, i bambini morivano di malnutrizione. Da molto tempo, questo aspetto della
malattia è correggibile.
Il danno polmonare compare più o meno tardi con infezioni ripetute fino all’infezione cronica che
danneggia, in maniera progressiva e irreversibile, il tessuto polmonare. L’insufficienza respiratoria
è la causa principale di morte.
Oltre a queste principali manifestazioni la fibrosi cistica provoca diabete (15% dei pazienti giovani
adulti), malattia epatica grave (3% dei pazienti giovani), pancreatiti ricorrenti, sterilità maschile
(quasi sempre), sterilità femminile (alcuni casi), sinusite e poliposi nasale, occlusioni intestinali.
Le diverse forme di Fibrosi Cistica: Esistono forme classiche di fibrosi cistica, quelle in cui sono
presenti i principali sintomi e che, storicamente, hanno condotto alla descrizione della malattia
(insufficienza pancreatica, infezioni respiratorie), ma non solo le sole. Circa il 20% dei pazienti non
presenta le manifestazioni intestinali (il pancreas è sufficiente) e quindi nei primi mesi di vita
crescono bene senza bisogno di supplementazioni. Vi sono poi forme a decorso lieve che si
manifestano tardivamente, forme dette atipiche, di cui ci si può accorgere da adulti e, infine, forme
che si limitano alla sterilità maschile e non si associano ad alcun altro sintomo della malattia
classica.
Le stesse mutazioni del gene CFTR si ritrovano in pazienti con diversa espressione della malattia.
Quindi, la genetica non aiuta a prevederne l’andamento. Fratelli che condividono le stesse
mutazioni nel gene possono presentare condizioni cliniche molto diverse. Invece, la malattia ha lo
stesso andamento in gemelli monoovulari.
31
Come si manifesta: In circa il 15% dei casi la malattia può esordire alla nascita con una grave
forma di occlusione intestinale (ileo da meconio) ch espesso deve essere risolta chirurgicamente.
Nella maggior parte dei casi, i sintomi si manifestano nelle prime settimane o nei primi mesi di vita
con ritardo di crescita dovuto alla scarsa assimilazione dei grassi per insufficienza pancreatica. Le
feci sono untuose e il peso del bambino non aumenta. In altri casi le prime manifestazioni sono
quelle di infezioni ripetute delle vie aeree. Queste comunque tendono a comparire nel corso della
storia naturale della malattia, con sintomi più o meno gravi.
Le cause: La malattia è determinata dal funzionamento anomalo di una proteina detta CFTR (
acronimo di cystic fibrosis transmembrane regulator) che regola il passaggio del cloro attraverso la
membrana di cellule epiteliali. Questa proteina viene codificata da un gene (CFTR) le cui mutazioni
ne provocano difetti di sintesi o addirittura ne impediscono la formazione. Il difetto della CFTR
comporta diverse conseguenze, difficili da ricondurre a un’interpretazione unitaria. Vi sono
alterazioni di alcune secrezioni, per esempio il sudore, ricco di sale, oppure delle secrezioni delle
vie respiratorie, che sono più dense perché povere di acqua, alterazioni della bile, che è spessa. Ma
altre anomalie, precipue, legate al malfunzionamento della proteina CFTR, ma meno
comprensibilmente legate alla sua funzione di canale del cloro, sono la propensione a risposte
infiammatorie esagerate delle vie respiratorie, anche a fronte a stimoli assai banali, la facilità
all’infezione cronica dei bronchi, da parti di particolari germi come la Pseudomonas aeruginosa o lo
stafilococco. Questi batteri aderiscono facilmente alla mucosa delle vie aeree dei pazienti, che non
se ne sanno liberare, e provocano un’infiammazione e un’infezione cronica.
Come si trasmette: Dato che tratta di una malattia recessiva i portatori non presentano alcuna
manifestazione della malattia. Per avere la fibrosi cistica bisogna ereditare i geni mutati da entrambi
i genitori.
La diagnosi: Diagnosi per screening neonatale - La fibrosi cistica si può diagnosticare alla nascita
con un’analisi sul sangue del neonato. In Italia, alcune regioni hanno messo in atto programmi di
screening alla nascita e, vengono eseguiti esami per ricercare la fibrosi cistica e altre malattie
congenite. Se i primi esami sono positivi il neonato viene sottoposto a prove più specifiche (il test
del sudore) che permettono di diagnosticare in maniera specifica la fibrosi cistica. In seguito, si
eseguono indagini genetiche per sapere quali siano le mutazioni presenti (vengono identificate circa
nell’85% dei casi). Questo permette di fare poi indagini sulla famiglia per riconoscere i portatori.
Per definizione, la diagnosi per screening precede l’insorgenza di sintomi.
Diagnosi per sintomi. Come abbiamo detto, una certa percentuale di casi si manifesta nei primi
giorni di vita, prima che possano essere eseguiti i test di screening, con ileo da meconio. Laddove lo
screening non venga eseguito la diagnosi viene fatta, a partire dai sintomi che la rendono sospetta,
eseguendo il test del sudore, a cui si fanno seguire le indagini genetiche.
Diagnosi per familiarità. In alcuni casi, la fibrosi cistica si manifesta in maniera molto lieve e viene
scoperta quasi per caso, a partire da un caso più grave verificatosi in un parente stretto.
Test del sudore . Questo test, per quanto diffuso, deve essere eseguito in ambienti specializzati
perché soggetto a elevato rischio di errore E’ l’esame che viene eseguito su una goccia di sudore per
determinare la quantità di cloro in esso contenuta. I pazienti con fibrosi cistica hanno una
concentrazione di cloro nel sudore elevata. (Una nonna ci ha detto: “quando baciavo la bambina mi
restava un sapore salato sulle labbra, lo dicevo ai dottori, mi prendevano in giro”. Aveva ragione.)
Il test del sudore permette di stabilire la diagnosi nella gran maggioranza dei casi. In alcuni casi il
suo significato resta dubbio e l’esame deve essere ripetuto anche più volte. Esistono esami più
sofisticati, eseguiti in pochi centri che permettono di arrivare alla diagnosi in casi che restano dubbi
malgrado le indagini genetiche e malgrado il test del sudore. Uno di questi esami consiste nella
32
misurazione dei potenziali nasali. Attraverso un elettrodo appoggiato sulla mucosa nasale viene
direttamente valutato il funzionamento del canale CFTR nelle cellule delle vie respiratorie.
Le mutazioni del gene colpito nella fibrosi cistica sono più di mille e non è possibile ricercarle tutte
per identificare con certezza un portatore. Quando però in una famiglia vi sia una persona affetta
dalla malattia e si conoscano le sue mutazioni, queste possono essere ricercate nei parenti più stretti
con una elevata probabilità di individuare i portatori sani. In casi particolari si possono eseguire
indagini sofisticate che permettono di trovare mutazioni anche senza partire da un familiare affetto,
ma queste tecniche genetiche non sono applicabili alla popolazione generale. E ad esse si deve
ricorrere solo in casi ben definiti dopo consulenza genetica. Conoscendo le mutazioni di cui i
genitori sono portatori, queste possono essere ricercate sul feto con prelievo dei villi coriali.
Esiste una terapia: Non vi è una terapia risolutiva né si può parlare, oggi, di possibilità di
guarigione dalla malattia. Vi sono cure croniche (enzimi pancreatici, fisioterapia) e cure frequenti o
subcontinue (terapia antibiotica, aerosol per dilatare le vie respiratorie e migliorarne il drenaggio).
Se compaiono complicazioni come il danno epatico o il diabete, vanno affrontate in maniera
specifica. Circa il 3% dei pazienti può arrivare alla necessità di un trapianto di fegato (mediamente
in età giovanile). Più numerosi sono i pazienti in cui si rende necessario un trapianto di polmone. La
malattia non si riproduce nel fegato e nel polmone trapiantati. In alcuni casi di sterilità maschile
possono essere usate tecniche di fecondazioni assistita.
I pazienti affetti da fibrosi cistica devono essere presi in carico molto presto da centri specialistici.
In Italia, in ogni regione, esiste un centro fibrosi cistica e possono esservi servizi di supporto. Dato
che la malattia tende a dare segni precoci nella sua forma classica, le prime cure sono indirizzate a
normalizzare la digestione e a prevenire il danno respiratorio. Per il primo aspetto si somministrano
enzimi pancreatici che devono essere assunti cronicamente, mentre per affrontare o prevenire i
sintomi respiratori si inizia quanto prima un programma di fisioterapia per permettere
l’espettorazione del muco denso che tende ad accumularsi nelle basse vie aeree e a infettarsi
L’aspetto digestivo è quasi sempre facilmente controllabile, ma il bambino con fibrosi cistica può
finire per presentare infezioni respiratorie (broncopolmoniti) ricorrenti. Alcuni batteri tendono a
colonizzare le vie aeree in maniera cronica e a causare un processo infiammatorio persistente che si
manifesta con un’infezione cronica che, più o meno spesso, si riacutizza.
Un tempo la fibrosi cistica era considerata una malattia mortale nell’infanzia. Oggi il 50% dei
pazienti supera il 37-40 anni. Questo dato dipende da diversi fattori come la diagnosi precoce, il
miglioramento delle cure, la diagnosi sempre più frequente di forme lievi che un tempo non
venivano considerate fibrosi cistiche. Il trapianto di polmone, diventato più frequente solo negli
ultimi 10 anni, si sta rivelando un fattore decisivo per il prolungamento ulteriore dell’aspettativa di
vita nelle forme classiche gravi.
MORBO DI ALZHEIMER
Sinonimi: Malattia di Alzheimer
Nome Inglese: Alzheimer Disease (AD)
Frequenza: 500 000 persone colpite in Italia; 6-10% oltre i 65 anni, 20% oltre gli 80 anni.
Che cos'è il Morbo di Alzheimer: La malattia di Alzheimer prende il nome da Alois Alzheimer
(1864-1915), il neurologo tedesco che per primo la descrisse intorno al 1910. Si tratta di una
malattia degenerativa delle cellule cerebrali che provoca demenza, cioè un declino progressivo delle
funzioni intellettive e della memoria, con alterazioni della personalità e del comportamento. Le
33
persone malate perdono progressivamente la loro autonomia, fino a diventare totalmente dipendenti
dagli altri per le necessità più elementari come lavarsi, vestirsi, mangiare.
Le diverse forme del morbo di Alzheimer: Si può fare una prima importante distinzione fra le forme
di Alzheimer sporadiche e quelle familiari.
Le forme sporadiche sono la maggioranza (circa il 75% dei casi): sporadico significa che la malattia
colpisce un solo membro di una famiglia. Tutti casi di Alzheimer che non presentano familiarità
vengono considerati come sporadici.
Nelle forme familiari (il restante 25% dei casi) più persone sono invece colpite nella stessa famiglia.
Le forme familiari si possono a loro volta suddividere in:
Forma tardiva familiare (AD2): si diagnostica questa forma nelle famiglie con più casi di malattia
che si manifestano dopo i 65 anni.
Forme precoci familiari (AD1, AD3, AD4): si diagnosticano queste forme nelle famiglie con più
casi della malattia che si manifestano prima dei 65 anni. I sottotipi (AD, AD2, AD3) si possono
distinguere solo con un test genetico (vedi più avanti).
Come si manifesta: La malattia si manifesta prevalentemente dopo i 60 anni, anche se esistono casi
molto più rari di esordio fra i 30 e 50 anni. Costituisce un vero problema sociale: recenti statistiche
indicano che in Italia i malati sono più di 500mila e che nella maggior parte di casi la loro cura pesa
totalmente sui familiari; in oltre la metà dei casi i familiari di persone affette dalla malattia si
occupano a tempo pieno della cura del malato. I primi sintomi della malattia sono in genere difficili
da riconoscere. Una delle prime alterazioni è la difficoltà a ricordare gli eventi recenti. Col tempo il
deficit della memoria, che all’inizio può essere sfumato, tende a peggiorare diventando evidente e
può accompagnarsi ad alterazioni del comportamento e dell'orientamento spazio-temporale.
Possono essere presenti anche disturbi cognitivi, problemi di linguaggio (afasia), incapacità a
riconoscere persone, cose e luoghi (agnosia), incapacità a compiere gli atti quotidiani della vita lavarsi, vestirsi, mangiare (aprassia)- deliri e/o allucinazioni. Man mano che la malattia progredisce,
risultano evidenti anche sintomi di tipo motorio: rigidità muscolare, difficoltà nel camminare,
tremori simili a quelli che si osservano nel morbo di Parkinson, incontinenza. La malattia di
Alzheimer e la demenza senile non sono la stessa cosa. Anche se la malattia di Alzheimer è la causa
più frequente di demenza (il 50-70% di coloro che soffrono di demenza hanno la malattia di
Alzheimer) la demenza può essere dovuta anche ad altre patologie, come la Malattia di Parkinson,
la M. di Huntington, la Demenza multi-infartuale (MID) causata da ictus multipli, la Malattia di
Creutzfeldt-Jacob (CJD) e la Malattia di Pick. Tutte queste patologie possono presentare sintomi
simili, ma uno specialista è in grado di effettuare una diagnosi differenziale.
Le cause: Le conoscenze sui meccanismi che causano la degenerazione e la morte dei neuroni nella
malattia di Alzheimer sono tutt’ora lacunose e molte ricerche sono in corso. E’ noto che nelle
cellule nervose delle persone malate si può riscontrare un accumulo anomalo di sostanze, solo in
parte identificate, che provocano la formazione di placche e fibrille all’interno delle cellule. Una di
queste sostanze è la proteina amiloide, che a sua volta deriva da una proteina normalmente presente
nelle cellule cerebrali, chiamata APP (precursore della proteina amiloide). I meccanismi che
portano alla formazione di questi accumuli sono ancora poco conosciuti, anche se numerose e
recenti ricerche stanno facendo luce sulle altre proteine e sugli enzimi coinvolti in questo processo.
34
Informazioni importanti sono anche arrivate dallo studio delle forme familiari di Alzheimer, per le
quali sono state identificati alcuni geni che, se mutati, possono causare la malattia:
Il gene della proteina amiloide (APP), localizzato sul cromosoma 21 risulta alterato nella forma
AD1. Le mutazioni dell’APP sono rare (solo circa 43 famiglie finora identificate nel mondo) e
causano una malattia ad esordio precoce (35-50 anni).
Il gene della presenilina 1 (PS1) localizzato sul cromosoma 14, risulta alterato nella forma AD3. In
particolare oltre 125 diverse mutazioni di questo gene sono state finora identificate in pazienti con
forme familiari ad esordio precoce appartenenti a 254 famiglie, in tutto il mondo. Queste mutazioni
rapppresentano la causa più comune delle forme di Alzheimer familiare ad esordio precoce (28-60
anni). (le preseniline sono proteine che hanno la funzione di tagliare la proteina amiloide, per questo
un'ipotesi è che il loro alterato funzionamento potrebbe portare all’accumulo di proteina amiloide).
Il gene della presenilina 2 (PS2) localizzato sul cromosoma 1, risulta alterato nella forma AD4. Fino
ad oggi solo 6 mutazioni sono state identificate in pazienti appartenenti a famiglie americane
originarie dell’Europa dell'Est ed in 2 famiglie italiane. In queste famiglie l’età di esordio può
essere precoce (30 anni) ma anche molto tardiva (oltre 80).
Come si trasmette: Dallo studio delle famiglie affette è stato possibile individuare le modalità di
trasmissione ereditaria delle diverse forme: Le forme AD1, AD3 e AD4 (da mutazioni dei geni
APP, PS1 e PS2) si ereditano con modalità autosomica dominante. Per la forma AD2 non si è
ancora potuto stabilire con certezza quale sia la modalità di trasmissione ereditaria, ma si ipotizza
una trasmissione di tipo autosomico dominante.
La diagnosi: Non esiste per ora alcun esame specifico per la malattia di Alzheimer. La diagnosi si
basa essenzialmente sull’attento esame clinico del paziente, dei sintomi e sulla storia familiare, nel
caso di forme ereditarie. Altri esami, tra cui la diagnostica per immagini (TAC, RMN), non hanno
valore decisivo per la diagnosi, ma possono servire ad escludere altre cause di demenza. Per le
forme è possibile confermare la diagnosi tramite l’analisi del DNA. Di recente, sia per le forme
familiari che per quelle sporadiche, accanto all’esame clinico (che resta fondamentale) è stato
introdotto anche un esame genetico per un particolare allele – l’allele 4 - del gene della
Apolipoproteina E (APOE4). L’APOE è una proteina che si lega alla proteina amiloide e diversi
studi hanno mostrato che l’allele 4 è più frequente nelle persone affette da malattia di Alzheimer
rispetto a quelle sane. Si tratta comunque di una dato indicativo e che non basta da solo a definire la
diagnosi: infatti, quasi la metà delle persone affette non possiede questo allele, che d’altra parte può
essere presente anche in una percentuale di persone sane. Pertanto, l’esame genetico ApoE non è
utilizzabile per predire il rischio di sviluppare la malattia di Alzheimer.
Esiste una terapia: Non esiste al momento una terapia risolutiva per questa malattia, che per ora
rimane inesorabilmente progressiva. Un parziale miglioramento si ottiene con l’uso di una classe di
farmaci chiamati "inibitori della colinesterasi". Si tratta di farmaci che hanno l’effetto di mantenere
attivi più a lungo i segnali che vanno da un neurone all’altro. Questi farmaci hanno mostrato di
poter rallentare anche per diversi mesi la progressione dei sintomi, in una percentuale di pazienti
che va dal 20 al 40%.
MORBO DI PARKINSON
Sinonimi: Malattia di Parkinson
Nome Inglese: Parkinson's Disease
35
Frequenza: 100.000 persone colpite in Italia; 1-4% intorno a 55 anni - 3,4% oltre i 75 anni.
Che cos'è il Morbo di Parkinson: E’ la più frequente malattia neurodegenerativa dopo la malattia
di Alzheimer. E' una malattia degenerativa del cervello, lentamente progressiva, che colpisce le
cellule cerebrali che producono la dopamina, una sostanza chimica importante per un controllo
preciso dei movimenti. La dopamina è un neurotrasmettitore, cioè una sostanza che i neuroni
utilizzano per comunicare fra loro.
La malattia colpisce generalmente dopo i 50 anni, con un picco fra i 59 e i 62 anni, ma esistono casi
in cui la malattia si manifesta in età più giovane (principalmente nella terza-quarta decade),
soprattutto per quanto riguarda le forme di tipo familiare.
La malattia di Parkinson (o Morbo di Parkinson) colpisce in eguale misura uomini e donne
Come si manifesta: Nella malattia di Parkinson, per ragioni ancora in gran parte sconosciute, i
neuroni che producono dopamina degenerano, causando una carenza di questo neurotrasmettitore.
Come risultato, le persone affette presentano progressivamente i sintomi tipici della malattia:
tremore a riposo, lentezza ed impaccio nei movimenti, rigidità muscolare, instabilità posturale.
Esistono numerosi farmaci, tra cui la levodopa e gli agonisti della dopamina, per il trattamento
sintomatico della malattia di Parkinson. Tuttavia questi farmaci non “curano” la malattia, né
influenzano in alcun modo la progressione del quadro clinico. Da alcuni anni è disponibile anche un
trattamento chirurgico di alcune forme di malattia di Parkinson, basato sull’impianto di elettrodi
cerebrali che permettono di stimolare ad alta frequenza alcune zone del cervello. Questo approccio
terapeutico ha portato risultati estremamente soddisfacenti, e al momento rappresenta una valida
alternativa alla terapia farmacologica, soprattutto in quei pazienti in cui i farmaci non riescono a
controllare le manifestazioni della malattia e comportano gravi effetti collaterali. Nella maggior
parte dei casi la malattia di Parkinson, soprattutto quando esordisce nella sesta-settima decade, è
sporadica, cioè non è ereditaria. Esistono però alcune forme ereditarie più rare (forme di tipo
familiare). Le forme ereditarie possono essere trasmesse sia con modalità autosomica dominante,
che autosomica recessiva. Le forme ad esordio giovanile tendono ad essere trasmesse in forma
recessiva (da due genitori sani), e sono forme a progressione più lenta, andamento solitamente
benigno e buona risposta alla terapia. I geni responsabili di alcune forme familiari, sia dominanti
che recessive, sono stati individuati di recente. Lo studio della funzione di questi geni sta
permettendo di comprendere i meccanismi patogenetici che verosimilmente intervengono anche
nelle forme di malattia di Parkinson idiopatica.
Le cause: Sino ad ora sono stati identificati due geni responsabili di malattia di Parkinson a
trasmissione dominante (alfa-sinucleina e ubiquitin-cicloidrolasi-L1), e due geni responsabili di
malattia di Parkinson a trasmissione recessiva (parkina e DJ-1). L’identificazione di questi geni ha
permesso di poter studiare la loro funzione fisiologica e il meccanismo per il quale mutazioni in
questi geni determinano la degenerazione dei neuroni dopaminergici cerebrali e quindi la malattia di
Parkinson. Al momento, due principali meccanismi cellulari sono stati coinvolti nella malattia di
Parkinson: 1) lo stress ossidativo e l’alterazione della funzione mitocondriale; 2) l’accumulo
intracellulare di aggregati proteici e l’alterazione della via ubiquitina-proteosoma. I mitocondri sono
degli organelli presenti in tutte le nostre cellule e svolgono un ruolo fondamentale per la
sopravvivenza cellulare, in quanto rappresentano la sorgente di energia della cellula. Se i
mitocondri non funzionano in modo efficiente, la cellula non ha energia sufficiente per espletare
tutte le sue funzioni vitali e va quindi incontro a morte. Alcune condizioni, come lo stress ossidativo
36
ed i radicali liberi, danneggiano la funzionalità mitocondriale. Questo avviene soprattutto nelle
cellule dopaminergiche del sistema nervoso, in quanto il metabolismo della dopamina di per sé è
una fonte di radicali liberi. Le cellule normalmente mettono in atto efficienti sistemi di difesa,
attivando alcuni geni che svolgono un ruolo protettivo contro lo stress ossidativo. Ad esempio, DJ-1
sembra essere coinvolto nei meccanismi di difesa contro lo stress ossidativo; mutazioni in questo
gene ne alterano la funzione e determinano l’insorgenza della malattia di Parkinson. Un secondo
meccanismo coinvolto nella patogenesi della malattia di Parkinson è l’accumulo di aggregati
proteici nelle cellule dopaminergiche. Ad esempio, alfa-sinucleina è una proteina che tende a
formare aggregati proteici. Mutazioni dell’alfa-sinucleina aumentano la tendenza di questa proteina
ad acquisire una conformazione anomala e formare aggregati proteici dannosi per le cellule
dopaminergiche, e portano alla malattia di Parkinson. Le cellule normalmente possiedono efficienti
meccanismi di difesa per contrastare la formazione di aggregati proteici. Il più importante è il
sistema ubiquitina-proteosoma, un complesso sistema specializzato nel riconoscere e degradare le
proteine anomale. La proteina parkina gioca un ruolo importante nella via ubiquitina-proteosoma.
Mutazioni nel gene che codifica per questa proteina comportano un alterato funzionamento di
questo sistema di difesa nelle cellule dopaminergiche cerebrali, e quindi malattia di Parkinson. La
comprensione dei meccanismi patogenetici cellulari alla base della malattia di Parkinson è
fondamentale per poter individuare nuovi approcci terapeutici e neuroprotettivi mirati, ad esempio
per ridurre lo stress ossidativo o la formazione di aggregati proteici.
SINDROME DI DOWN
Sinonimi: Trisomia 21
Nome Inglese: Down Syndrome (DS); Trisomy 21
Frequenza: 1/700 nati vivi
Che cos'è la sindrome di Down: La Sindrome di Down (SD) è la più frequente causa di ritardo
mentale. Nota fin dal XVI° secolo ha avuto il suo inquadramento nosologico solo nel 1866 ad opera
di John Longdong Down, l’illustre medico inglese da cui prende il nome, che ha dedicato tutta la
sua vita allo studio e alla cura dei bambini con anomalie psichiche, e che per primo ha descritto le
caratteristiche di un gruppo di bambini con ritardo mentale e tratti orientaleggianti del viso,
definendoli come affetti da “idiozia mongoloide”.
Nel 1959 J.Lejeune e al. hanno dimostrato che la SD dipende dalla presenza di un cromosoma in
più nella coppia 21, e da allora viene anche definita “Trisomia 21”.
Data la casualità della sua comparsa è una anomalia cromosomica congenita non ereditaria, ed è
anche la più nota e diffusa, perché la lunga sopravvivenza delle persone che ne sono portatrici ha
determinato nella società la consapevolezza della sua presenza.
Come si manifesta: Alla nascita, le caratteristiche fisionomiche dei bambini con SD alla nascita
sono principalmente le seguenti:
Viso rotondo con sella nasale larga e appiattita
Occhi con taglio delle palpebre di tipo orientale
Piega cutanea all’angolo interno degli occhi (epicanto)
Orecchie piccole
Collo tozzo con plica nucale abbondante e lassa
Mignoli inclinati verso l’interno della mano (bradiclinodattilia)
Solco palmare unico in entrambe le mani
37
Marcata ipotonia muscolare
Articolazioni molto flessibili per l’eccessiva lassità dei legamenti
Ovviamente non è evidente alla nascita il ritardo mentale, che è ben noto a tutti come intrinseco ai
trisomici 21 e che rappresenta la caratteristica che più preoccupa in questa sindrome. Poiché questi
tratti fisionomici possono essere presenti, in modo più o meno evidente, anche in neonati non
trisomici, la diagnosi di certezza di SD si ottiene solo dallo studio del cariotipo, che si evidenzia
eseguendo la mappa cromosomica. L’indagine, indicata anche con il termine di analisi citogenetica,
è la sola che autorizza la diagnosi di Trisomia 21. Consiste nell'analizzare e fotografare al
microscopio, con particolari tecniche, i cromosomi di alcune cellule del sangue (in genere linfociti),
prelevate dal bambino e bloccate in mitosi, e rende possibile il riscontro di una trisomia primaria o
da traslocazione. Pertanto deve essere eseguita subito alla nascita ogni volta che si avanza il
sospetto di Trisomia 21 su base clinica, al fine di avere una certezza diagnostica incontrovertibile.
Le persone con SD non vanno a priori considerate delle persone malate, tuttavia alcune patologie si
possono manifestare con maggior frequenza rispetto a coloro che non hanno la SD. La tabella di
Allen Crocker qui riportata, evidenzia le situazioni che meritano maggior attenzione. Un tempo, le
persone affette da SD avevano una prospettiva di vita molto inferiore, in qualità e durata, rispetto
alla media della popolazione, e la mortalità prima dell’adolescenza era la regola, mentre la
sopravvivenza in età adulta una eccezione. Oggi la situazione è notevolmente migliorata: gli
interventi per correggere i difetti cardiaci congeniti, il trattamento delle infezioni e in generale le
cure migliori che oggi sono disponibili, permettono alle persone Down di vivere sempre più a
lungo, anche se l'aspettativa di vita è ancora statisticamente di 10-15 anni inferiore alla media. Oggi
la vita media delle persone con SD è di 45-46 anni, con una sopravvivenza del 13% nella fascia di
età fra i 45 e i 65 anni. Si calcola che in Italia vi siano 48.000 persone con SD, di cui circa 10.500
nella fascia di età fra 0-14 anni, 32.000 fra i 15-44 e 5000 oltre i 44 anni. Il dato che emerge da
queste cifre è l’odierna superiorità numerica delle persone adulte rispetto ai bambini, e la necessità
che ne consegue è quella del loro inserimento nella società. Non siamo quindi più di fronte solo a
piccoli bambini diversi ma felici, con una prospettiva di vita relativamente breve, ma sempre di più
il maggior numero dei trisomici 21 è proiettato verso la vita adulta con tutto ciò che questo implica.
E’importante quindi che le persone Down, siano correttamente seguite fin dai primi mesi di vita,
perché possano sviluppare al meglio le loro capacità, essere autonome, lavorare ed avere un vita di
relazione soddisfacente. Nonostante il deficit cognitivo e i problemi che ne conseguono, i bambini
che nascono oggi con SD hanno davanti a loro la possibilità di un'esistenza serena anche da adulti.
Le cause: Per comprendere le cause che determinano la sindrome di Down è necessario innanzitutto
sapere come si dividono le cellule del nostro organismo. In generale, tutte le cellule si moltiplicano
per mitosi e danno origine a cellule con lo stesso patrimonio cromosomico diploide (2n), cioè
duplice. In questo processo due cromosomi omologhi, cioè portatori dei geni che controllano gli
stessi caratteri, si accoppiano e si duplicano nella stessa cellula, poi la membrana nucleare
scompare, i cromosomi si separano e vanno a collocarsi in due cellule distinte determinando la
formazione di cellule identiche alla cellula madre originaria. Ricordiamo che l’uomo nel nucleo
delle sue cellule ha un patrimonio genetico diploide, costituito da 46 cromosomi, 44 autosomici + 2
eterocromosomi (XX nella femmina e XY nel maschio). Nell’uomo pertanto vi sono 23 coppie di
cromosomi omologhi. Metà del patrimonio genetico proviene dalla cellula germinale paterna
(spermatozoo) e l’altra metà dalla cellula germinale materna (ovocito).
La cellula della linea germinale maschile (spermatogonio) e quella femminile (ovogonio) giungono
invece a maturazione mediante la meiosi dando origine a spermatozoi e ovociti che hanno un
patrimonio genetico dimezzato, aploide (n) a differenze di tutte le altre cellule dell’organismo.
Durante la prima divisione meiotica, si ha l’accoppiamento dei cromosomi omologhi, lo scambio di
materiale genetico fra i due cromosomi (crossing-over) e la disgiunzione dei due cromosomi
omologhi che vanno a collocarsi in cellule distinte. Con la seconda divisione meiotica, che in
38
pratica è una mitosi, il processo di maturazione si completa. La meiosi è il meccanismo attraverso il
quale viene assicurata la variabilità genetica. Al momento del concepimento, con la fusione delle
cellule germinali maschile e femminile, si ripristina il numero usuale di 46 cromosomi, in una
combinazione unica e irripetibile per ogni zigote, se non nei gemelli uniovulari. Nella meiosi i
passaggi in cui si possono determinare errori biologici sono: l’appaiamento dei cromosomi
omologhi, la ricombinazione, la disgiunzione, la segregazione. Facendo riferimento agli errori più
rilevanti nell’eziologia delle varie trisomie, e della 21 in particolare, li possiamo identificare nella
non-disgiunzione o mancata separazione e nell’alterata segregazione o mancata trasmissione di un
intero cromosoma alla cellula in maturazione. Nella maggior parte dei casi è quindi durante la
meiosi, che occasionalmente si verifica l’errore biologico che determina poi l’alterazione
cromosomica. Più raramente gli errori si verificano dopo il concepimento, cioè nel normale
processo di moltiplicazione cellulare che è la mitosi. La meiosi maschile avviene durante la
spermatogenesi con ciclo continuo dalla pubertà all’età avanzata. Nella donna, invece, la prima
divisione meiotica avviene nel corso della sua embriogenesi, mentre la seconda divisione meiotica
si verifica molti anni dopo, al momento dell’ovulazione, quando la cellula germinale, che era stata
per lungo tempo bloccata allo stadio di meiosi I, completa in poche ore la sua maturazione. E’ stato
ben documentato che, nei casi di trisomia, tutto dipende da quanto avviene nel momento del
crossing-over, cioè nella prima divisione meiotica, e i due momenti della meiosi sono collegati,
anche se avvengono a distanza di diversi anni l’uno dall’altro. Sostanzialmente oggi si ritiene che i
cromosomi siano in qualche modo predisposti alla non-disgiunzione se non riescono a effettuare
una normale ricombinazione durante la prima divisione meiotica, e che questa loro fragilità diventa
sempre più manifesta nella donna con l’avanzare dell’età. L’età sarebbe responsabile nel rendere
meno efficaci sia i meccanismi che cercano di contrastare la non-disgiunzione dei cromatidi malricombinati, sia le difese biologiche deputate a distruggere gli spermatozoi, le uova e gli zigoti
anormali. Nei soggetti con corredo cromosomico normale, l’errore meiotico si ritiene comunque un
evento occasionale e non ereditario, se non in casi eccezionali.
La Sindrome di Down ha una prevalenza di circa 1 su 700-1000 gravidanze, e di 1:2000 nella
popolazione generale e le sue cause,nel 92% dei casi, sono legate ad un fenomeno di nondisgiunzione, cioè mancata separazione dei cromosomi della coppia 21 durante la meiosi, per cui
uno dei genitori nella sua cellula riproduttiva, uovo o spermatozoo, è portatore di due cromosomi 21
invece di uno. Di conseguenza la combinazione con l’uovo o lo spermatozoo normale determina la
formazione di uno zigote con tre cromosomi 21, uno ereditato da un genitore e due dall’altro. Tale
condizione, definita Trisomia 21 “libera” o “primaria”, si verifica spontaneamente e in modo
imprevedibile, anche se è noto il dato statistico di una maggiore frequenza legata alla più elevata età
materna, dopo il 36° anno di età. E’ ben documentato che nel 75% dei casi la trisomia origina nel
corso della meiosi materna, mentre nel 25% l’errore avviene nella maturazione meiotica della
cellula germinale paterna. Per chi ha già un figlio con SD le probabilità di avere un altro figlio
Down, calcolate su base statistica, dipendono dalle cause della trisomia e dall'età materna e possono
essere definite dal genetista in base al cariotipo del bambino con la sindrome. Ad esempio, nel caso
di trisomia 21 libera completa, l’eventualità di ricorrenza è statisticamente pari al rischio legato
all’età materna al momento del concepimento più un 1% aggiuntivo. Questo 1% in più si “diluisce”
però nel rischio dell’età materna sopra i 30 anni e diventa irrilevante. Per cui una donna con più di
30 anni che ha avuto una precedente gravidanza con SD non ha un rischio aggiuntivo significativo
di avere una nuova gravidanza con SD. Nel 4,8% dei casi la trisomia è la conseguenza di una
traslocazione o trasferimento di un cromosoma 21 su un altro cromosoma, in genere il 14, ma anche
il 13 e lo stesso 21, e si definisce Trisomia 21 “secondaria”. Un certo numero di persone è portatore
inconsapevole, nel proprio patrimonio genetico, di una traslocazione. In questi individui il numero e
la qualità dei cromosomi sono normali, e di conseguenza anche il loro assetto biologico, fisico e
psichico, che nel complesso definiamo fenotipo è del tutto normale. Questo tipo di traslocazione si
definisce “bilanciata” o Robertsoniana. In questo caso, anche se non sempre, durante la meiosi
l’individuo con traslocazione può produrre cellule germinali con due cromosomi 21. Di
conseguenza l’unione di questo gamete anormale con uno normale determina la formazione di uno
39
zigote con Trisomia 21. In questa circostanza, per l’elevato rischio di ricorrenza in successive
gravidanze, lo studio del cariotipo dei genitori e la consulenza genetica sono di fondamentale
importanza.
Nel 3% dei casi, per una non-disgiunzione verificatasi solo in alcune delle cellule derivate dallo
zigote nella prima o nelle successive divisioni o, per la perdita dell’extracromosoma 21, cioè del
cromosoma in eccesso, nella prima o nelle successive divisioni di uno zigote trisomico, si possono
avere nello stesso individuo cellule a 46 cromosomi e cellule a 47 cromosomi, in proporzione
diversa a seconda del momento in cui è intervenuto l’evento sopra indicato. In questo caso si parla
di mosaicismo. Dal punto di vista clinico, poichè in pratica possiamo esaminare solo cellule del
sangue e del tessuto connettivo, e poco sappiamo dell’interazione dei geni fra loro e quindi sulla
loro espressività, è difficile fare previsioni sulla minore o maggiore importanza delle manifestazioni
cliniche che ne conseguono rispetto alla Trisomia “libera”, in cui le cellule sono trisomiche nella
loro totalità.
Solo nello 0,2% dei casi si riscontrano trisomie parziali. E’ questa una circostanza che consegue a
situazioni molto particolari, sia familiari che di nuova insorgenza, in cui la parte cromosomica in
eccesso è solo una frazione del cromosoma 21 (DCR1), tuttavia in grado di determinare le
alterazioni caratteristiche della SD. Dal “Progetto genoma”, iniziato 15 anni fa, grazie al lavoro di
numerosi gruppi di ricerca, sono stati identificati 86 geni localizzati sul cromosoma 21, la
maggioranza dei quali è stata ormai mappata. Inoltre con uno studio dettagliato della regione q22,
che è il tratto terminale del braccio lungo del cromosoma 21, si è potuto stabilire che alcune zone
sono correlate a specifiche manifestazioni cliniche della SD. In questa regione critica si trova ad es.
la spiegazione della cardiopatia congenita e della stenosi duodenale, e anche delle principali
caratteristiche fisiche della SD, quali tratti del volto, statura, ipotonia, alterazioni delle mani.
Tuttavia non tutti i bambini con SD presentano cardiopatia congenita o l’ancora meno frequente
stenosi duodenale e, malgrado i progressi conseguiti nelle conoscenze, molti aspetti patogenetici
sono tuttora oscuri. A spiegazione di questo fatto si sostiene oggi l’ipotesi che sia l’intero
patrimonio genetico a costituire il fattore principale delle diverse manifestazioni individuali. In
questi ultimi anni sono comparsi nella letteratura scientifica importanti contributi relativi alla
conoscenza e all’espressione dei geni localizzati sul cromosoma 21. Vi è l’evidenza che la trisomia
e gli altri caratteri genetici familiari si influenzano reciprocamente, per cui si hanno profonde
differenze individuali nelle caratteristiche psichiche, biologiche e fisiche dell’individuo, anche se
fondamentalmente il responsabile primo della SD è l’extracromosoma 21. In altre parole, finora si è
dato molto peso alla presenza in eccesso di questo cromosoma in sé, mentre oggi si ritiene più
probabile che i geni in triplice presenza abbiano un effetto integrato sull’intero genoma e che, con la
loro espressione, condizionino il funzionamento di moltissimi altri geni, attivandoli o inibendoli a
seconda della costituzione genetica individuale. Sarebbe questa la base teorica che permetterebbe di
comprendere la diversità individuale e la non prevedibilità a priori degli effetti dell’extracromosoma
21, sia per quanto riguarda l’aspetto fenotipico in senso lato, sia per quanto riguarda il manifestarsi
o meno delle varie situazioni patologiche.
La diagnosi: La SD si può diagnosticare in gravidanza con certezza con metodi quali la villocentesi
e l’amniocentesi (diagnosi prenatale), oppure con esami non invasivi del sangue ed ecografici
combinati, ma con un certo margine di errore. Tuttavia, la SD non si può prevenire in quanto non
sono note le modalità con cui si forma lo zigote e non siamo in grado oggi determinare la
formazione di zigoti senza difetti o di favorire l’eliminazione spontanea di quelli che ne sono
portatori, come già in gran parte avviene naturalmente. Infatti i neonati con anomalie cromosomiche
che vedono la luce sono la punta di un iceberg, in quanto la grande maggioranza va incontro ad
abortività spontanea.
40
Esiste una terapia: Attualmente, non esiste alcun trattamento in grado di risolvere radicalmente la
SD. I due fattori che permettono di ottenere uno sviluppo armonico e un buon inserimento
scolastico, sociale e lavorativo sono i regolari controlli medici ormai codificati, sia per i bambini
che per gli adulti con SD e la terapia riabilitativa fisica e mentale. La terapia riabilitativa deve
essere iniziata fin dai primi mesi di vita e può dare risultati estremamente positivi. I primi tre anni,
infatti, sono molto significativi per quanto concerne la successiva organizzazione delle abilità
cognitive e di socializzazione delle persone Down, come dimostrato da risultati, statisticamente
significativi. Le capacità cognitive, anche degli individui meno dotati, sono modificabili in ogni
condizione di vita e Feurestein lo ha dimostrato applicando il suo metodo che si basa appunto sulla
teoria della modificabilità cognitiva strutturale.. Infatti è dimostrato che il bambino con SD, purché
non trascurato, ma incoraggiato, stimolato e guidato con affetto, sensibilità e comprensione, con la
mediazione di genitori ed educatori, è in grado di incrementare significativamente le sue capacità
intellettive. Sempre in primo piano vi deve essere la vigilanza del sistema neurosensoriale. In
particolare vista e udito esigono un controllo costante. Infatti, i difetti neurosensoriali possono
essere interpretati come decadimento delle capacità intellettive e cognitive, così come un
decadimento di queste facoltà può essere misconosciuto e ritenuto solo un difetto di vista o di udito.
Sono queste le situazioni che vanno ricercate e corrette perché per comportamenti analoghi, le cause
ed i possibili interventi sono diversi. La correzione di un difetto di vista o di udito può infatti
permettere alla persona che ne è affetta, di tornare ad inserirsi rapidamente nel suo ambiente
sociale, il deterioramento delle capacità cognitive con organi sensoriali integri, richiederà invece
strategie diverse e più complesse.
SINDROME DI KLINEFELTER
Nome Inglese: Klinefelter syndrome.
Frequenza: 1 su 1000 neonati maschi.
Che cos'è la sindrome di Klinefelter: La sindrome di Klinefelter appartiene al gruppo delle
anomalie cromosomiche patologie determinate da alterazioni del numero o della struttura dei
cromosomi.
Si stima che la sindrome di Klinefelter presenti una frequenza alla nascita di 1 su 1000 neonati
maschi.
Come si manifesta: Caratteristiche generali sono: ipogonadismo (testicoli di dimensioni ridotte),
bassi livelli di testosterone, mancata produzione di spermatozoi (azoospermia) e quindi sterilità;
possono essere presenti una sproporzione tra lunghezza degli arti e lunghezza del tronco e statura
superiore alla media. Spesso la diagnosi viene posta solo in età adulta, nel corso di analisi eseguite
per infertilità di coppia: è stato evidenziato che il 10% dei maschi azoospermici (con liquido
seminale privo di spermatozoi) presenta sindrome di Klinefelter.
Le cause: I soggetti affetti da questa sindrome hanno 47 cromosomi, con un cromosoma X
sovrannumerario (cariotipo 47, XXY). La sindrome di Klinefelter può presentarsi anche in mosaico:
in questo caso i pazienti presentano sia cellule con cariotipo 46, XY sia cellule con cariotipo 47,
XXY; in questi pazienti le caratteristiche cliniche della sindrome sono attenuate.
41
La diagnosi: La diagnosi oltre che sulle caratteristiche cliniche della sindrome si basa anche
sull’analisi dei cromosomi, che permette di evidenziare l’alterazione del numero dei cromosomi (v.
anomalie cromosomiche), confermando così la diagnosi. L’esame del liquido amniotico, dei villi
coriali e del sangue fetale permettono di analizzare i cromosomi del feto e quindi di evidenziare la
presenza di eventuali anomalie cromosomiche, compresa la sindrome di Klinefelter .
SINDROME DI TURNER
Nome Inglese: Turner’s syndrome.
Frequenza: 1 neonato femmina su 4000 - 1 su 8000.
Che cos'è la sindrome di Turner: La sindrome di Turner appartiene al gruppo delle anomalie
cromosomiche, patologie determinate da alterazioni del numero o della struttura dei cromosomi.
Si stima che la sindrome di Turner presenti una frequenza alla nascita di circa 1 neonato femmina
su 4000 - 1 su 8000.
Come si manifesta: Caratteristiche principali della sindrome di Turner sono: linfedema periferico
(mani e piedi gonfi a causa di stasi linfatica), pterigio del collo (collo corto “a tenda”), bassa statura,
amenorrea primaria (mancata comparsa delle mestruazioni). Talvolta sono presenti anche
cardiopatia, ipertensione e anomalie renali. Sia l’intelligenza sia l’attesa di vita sono normali.
Le cause: Nella maggior parte dei casi (circa il 50%) la s. di Turner è causata dalla mancanza di un
cromosoma X ("monosomia X"); il cariotipo è quindi indicato con la formula 45, XO. Circa il 25%
circa dei casi è determinato da alterazioni nella struttura di un cromosoma X. Più raramente la
patologia è causata da alterazioni di numero o di struttura del cromosoma X presenti in mosaico
(cioè non in tutte le cellule dell'organismo ma solo in alcune di queste); in questi casi si riscontra
un’attenuazione delle caratteristiche cliniche della sindrome.
La diagnosi: In alcuni casi la sindrome di Turner è evidente già alla nascita. Le principali
caratteristiche neonatali sono: peso e lunghezza ridotti, linfedema delle mani e dei piedi, presenza di
pliche della cute sulla nuca. In alcune pazienti la sindrome di Turner non comporta particolari
alterazioni e viene diagnosticata solo alla pubertà a causa di amenorrea primaria (mancata comparsa
delle mestruazioni) e bassa statura. In tutti i casi, la diagnosi oltre che sulle manifestazioni cliniche
si basa anche sull’analisi dei cromosomi, che permette di evidenziare sia anomalie di numero sia
anomalie di struttura (v. anomalie cromosomiche). L’esame del liquido amniotico, dei villi coriali e
del sangue fetale permettono di analizzare i cromosomi del feto e quindi di evidenziare la presenza
di eventuali anomalie cromosomiche, compresa la sindrome di Turner.
42