Neoplasie della mammella
8
Michele De Laurentiis, Fabio Puglisi
con la collaborazione di
Marta Bonotto, Francesca Di Rella, Giovanni Iodice e Carla Di Loreto
EPIDEMIOLOGIA
Il carcinoma della mammella è, dopo i tumori del polmone, la neoplasia maligna più frequente, costituendo, con
quasi 1.400.000 nuovi casi l’anno, circa il 10,9% di tutti i
tumori maligni che insorgono nel mondo. Nel sesso femminile è, in assoluto, il principale problema oncologico,
costituendo circa un quarto (23%) di tutti i tumori maligni
diagnosticati e rappresentando la più frequente causa di
morte per tumore nelle donne (Globocan, 2008).
INCIDENZA
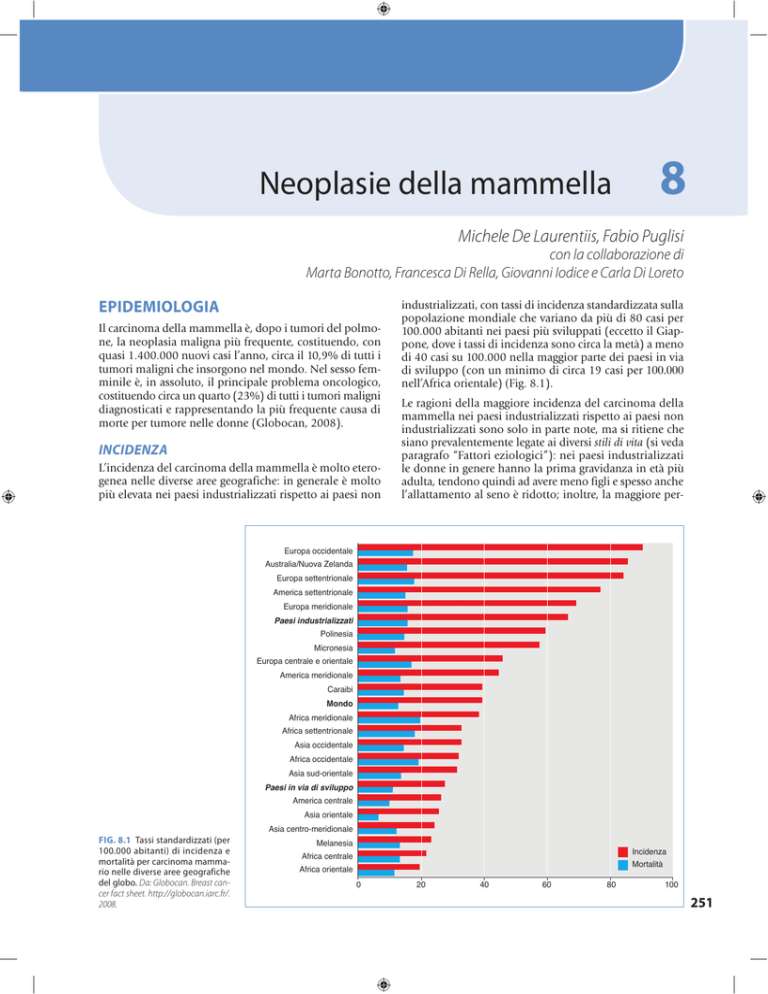
L’incidenza del carcinoma della mammella è molto eterogenea nelle diverse aree geografiche: in generale è molto
più elevata nei paesi industrializzati rispetto ai paesi non
industrializzati, con tassi di incidenza standardizzata sulla
popolazione mondiale che variano da più di 80 casi per
100.000 abitanti nei paesi più sviluppati (eccetto il Giappone, dove i tassi di incidenza sono circa la metà) a meno
di 40 casi su 100.000 nella maggior parte dei paesi in via
di sviluppo (con un minimo di circa 19 casi per
nell’Africa orientale) Fig. 8.1).
Le ragioni della maggiore incidenza del carcinoma della
mammella nei paesi industrializzati rispetto ai paesi non
industrializzati sono solo in parte note, ma si ritiene che
siano prevalentemente legate ai diversi stili di vita (si veda
paragrafo “Fattori eziologici”): nei paesi industrializzati
le donne in genere hanno la prima gravidanza in età più
adulta, tendono quindi ad avere meno figli e spesso anche
l’allattamento al seno è ridotto; inoltre, la maggiore per-
Europa occidentale
Australia/Nuova Zelanda
Europa settentrionale
America settentrionale
Europa meridionale
Paesi industrializzati
Polinesia
Micronesia
Europa centrale e orientale
America meridionale
Caraibi
Mondo
Africa meridionale
Africa settentrionale
Asia occidentale
Africa occidentale
Asia sud-orientale
Paesi in via di sviluppo
America centrale
Asia orientale
Asia centro-meridionale
FIG. 8.1 Tassi standardizzati (per
100.000 abitanti) di incidenza e
mortalità per carcinoma mammario nelle diverse aree geografiche
del globo. Da: Globocan. Breast cancer fact sheet. http://globocan.iarc.fr/.
2008.
Melanesia
Incidenza
Africa centrale
Mortalità
Africa orientale
0
20
40
60
80
100
251
252
Capitolo 8
Neo p la sie d ella m a m m ella
perti negli anni successivi. Tuttavia, un reale incremento di
incidenza è plausibile in considerazione del fatto che, in
questi paesi, è in atto un profondo cambiamento socioeconomico che sta determinando chiare modifiche dello stile di
vita, rendendolo più simile a quello del mondo occidentale.
centuale di donne obese, un maggior consumo di alcol,
un consumo di contraccettivi orali e di terapia ormonale
sostitutiva, nonché una ridotta attività fisica sono ulteriori
fattori di rischio che affliggono le popolazioni più sviluppate. A conferma dell’ipotesi sugli stili di vita, numerosi
studi hanno dimostrato come l’incidenza di cancro mammario aumenti nel giro di alcune generazioni nelle donne
di famiglie emigrate da zone a bassa incidenza verso i paesi
industrializzati.
Negli Stati Uniti, invece, i tassi di incidenza hanno subito
un chiaro declino tra il 1999 e il 2003 per poi stabilizzarsi
negli ultimi anni. Si ritiene che la causa di questo declino
sia rappresentata dalla drastica riduzione dell’impiego di
terapia ormonale sostitutiva (TOS) per il controllo dei
sintomi menopausali, che ha fatto seguito, proprio in
questo periodo, alla divulgazione dei risultati dello studio
Women’s Health Initiative (WHI).
In Italia, con circa 47.000 nuovi casi annui, il carcinoma
mammario è la seconda più frequente neoplasia (dopo i
tumori del colon-retto) e la prima in assoluto nel sesso
femminile, dove rappresenta circa il 29% di tutti i tumori
maligni. La prevalenza stimata di persone con pregressa
diagnosi di carcinoma mammario in Italia è superiore al
mezzo milione (http://www.tumori.net). In confronto con
le altre aree geografiche del globo, l’Italia si attesta tra i
paesi ad alta incidenza, con un tasso standardizzato sulla
popolazione mondiale di circa 86,3/100.000 abitanti (pari
a un tasso standardizzato sulla popolazione europea di
circa 118/100.000). L’incidenza non è comunque uniforme
sul territorio nazionale, con un chiaro trend crescente da
Sud a Nord (Fig. 8.2).
In Italia, così come nella maggior parte dei paesi europei,
l’incidenza è aumentata lentamente, ma progressivamente,
fino all’inizio del secolo, per poi cominciare un lento e
lieve declino (Fig. 8.3). Quest’ultimo potrebbe anche essere
legato alla riduzione di prescrizioni di TOS. Il fenomeno
appare, tuttavia, meno drammatico, a causa della più bassa
penetrazione che la TOS ha avuto, negli anni scorsi, nel
nostro Paese rispetto agli USA.
MORTALITÀ
In termini di trend temporale, l’incidenza del carcinoma
mammario, negli ultimi tre decenni, è aumentata nella
maggior parte del mondo, a eccezione di numerosi paesi
dell’Africa e di alcune parti dell’America centro-meridionale e dell’Asia meridionale.
Il carcinoma della mammella rappresenta a oggi la causa
più frequente di morte per tumore nella donna, con un
numero stimato di decessi annui pari a quasi mezzo milione nel mondo e un tasso di mortalità standardizzato sulla
popolazione mondiale pari a 12,4/100.000. Al pari dell’incidenza, i tassi di mortalità sono più alti nelle regioni sviluppate, rispetto a quelle meno sviluppate, ma la differenza
rilevata è molto meno marcata rispetto alle differenze di
incidenza (si veda Fig. 8.1), grazie alla sopravvivenza molto più alta che si registra nei paesi industrializzati. Negli
USA, i tassi di mortalità per tumore della mammella sono
nettamente inferiori a quelli del tumore del polmone nella
Particolarmente evidente è stato l’incremento relativo del
tasso di incidenza osservato, anche in donne giovani, in
Giappone e Hong Kong e in molti Paesi asiatici tradizionalmente ritenuti a bassa incidenza (Singapore, Taiwan,
Repubblica Coreana). Questo incremento è, in parte, fittizio e legato al fatto che in tali paesi è stato recentemente
introdotto lo screening mammografico, con conseguente
anticipazione diagnostica di tumori che sarebbero stati sco-
INCIDENZA
Trentino
Alto Adige
Valle
d’Aosta
MORTALITÀ
Trentino
Alto Adige
Friuli
Venezia Giulia
Valle
d’Aosta
Veneto
Lombardia
Piemonte
Emilia Romagna
Friuli
Venezia Giulia
Veneto
Lombardia
Piemonte
Emilia Romagna
Liguria
Liguria
Toscana
Toscana
Marche
Umbria
Lazio
Sardegna
Marche
Umbria
Abruzzo
Lazio
Abruzzo
Molise
Molise
Campania
Campania
Puglia
Sardegna
Basilicata
Calabria
FIG. 8.2 Distribuzione geografica
dei tassi standardizzati (per 100.000
abitanti) di incidenza e mortalità
del carcinoma mammario in Italia.
Da: http://www.tumori.net.
Calabria
Sicilia
<93
93-110
>110
Puglia
Basilicata
Sicilia
<17,7
17,7-18,3
>18,3
Ca pito l o 8
donna, mentre nel resto del mondo occidentale i due tassi
sostanzialmente si equivalgono (Globocan, 2008).
In Italia, con circa 7.600 decessi per anno e un tasso di
mortalità standardizzato sulla popolazione mondiale che
si attesta a circa 11,3/100.000 (pari a circa 12,6/100.000
con standardizzazione sulla popolazione europea), il carcinoma della mammella rappresenta, di gran lunga, la
principale causa di decesso per neoplasia nella donna
(http://www.tumori.net). La distribuzione geografica dei
tassi di mortalità non è uniforme sul territorio nazionale,
ma non è direttamente correlata a quella dei tassi di incidenza e non si osserva alcun chiaro trend da Nord a Sud
(si veda Fig. 8.2).
In termini di trend temporale, la mortalità per carcinoma
mammario, negli ultimi tre decenni, è aumentata nella
maggior parte del mondo, a eccezione dei paesi occidentali, dove, a partire dagli anni Novanta, si è registrata una
brusca inversione di tendenza. Infatti, nella maggior parte
dei paesi sviluppati, inclusa l’Italia (si veda Fig. 8.3), i tassi
di mortalità si sono quasi dimezzati rispetto a quelli di due
decenni fa. La riduzione di mortalità appare, perlopiù, dissociata dalla riduzione di incidenza che si sta osservando
nelle stesse aree: è, infatti, nettamente più marcata e più
precoce. Questa dissociazione incidenza/mortalità è considerata la prova epidemiologica dei progressi diagnosticoterapeutici ottenuti e della loro applicazione su scala di
popolazione.
FATTORI EZIOLOGICI
Il carcinoma della mammella, al pari della maggior parte
dei tumori solidi, è una malattia multifattoriale e non è,
pertanto, possibile parlare di fattori eziologici in senso
stretto, quanto di fattori di rischio. Gli studi di epidemiologia descrittiva evidenziano come vi siano grandi differenze
di incidenza tra diverse aree geografiche. Inoltre, nelle famiglie che migrano da zone a bassa incidenza verso zone
ad alta incidenza, il rischio di sviluppare il tumore diventa,
nel giro di poche generazioni, sovrapponibile a quello
della popolazione dell’area di residenza. Questi dati suggeriscono l’esistenza di fattori eziologici legati all’ambiente
e alle abitudini di vita, e quindi, come tali, potenzialmente
modificabili. Comunque, al momento, nessuno dei fattori
di rischio ambientali e comportamentali noti è sufficiente-
N e o p lasi e della mammella
mente forte da spiegare le differenze di incidenza in diverse
parti del mondo. È presumibile, pertanto, che più che di
veri e propri fattori causali si tratti di indicatori di rischio
a essi correlati. Gli studi epidemiologici hanno individuato
molteplici indicatori di rischio per carcinoma della mammella e la complessità delle loro interazioni ha condotto
allo sviluppo di modelli matematici atti a calcolare il rischio soggettivo di sviluppare un carcinoma mammario. I
più noti sono il modello di Gail (reperibile anche online
all’indirizzo http://www.cancer.gov/bcrisktool/), il modello di Claus e il modello di Cuzick-Tyrer. Questi modelli,
insieme al modello BRCAPRO che stima la probabilità
di mutazioni dei geni BRCA (si veda oltre), sono spesso
utilizzati nell’ambito della stima del rischio familiare per
individuare i soggetti che necessitano di particolari strategie di sorveglianza e/o prevenzione. I principali fattori di
rischio noti per carcinoma mammario sono riportati nella
tabella 8.1 e sono discussi sinteticamente di seguito.
Età
A oggi, l’età sembra essere il più forte fattore di rischio per
carcinoma mammario. La probabilità di sviluppare un
cancro al seno aumenta, infatti, esponenzialmente con
l’aumentare dell’età (Tab. 8.2).
Come si evince dalla tabella 8.2 si passa da una percentuale
dello 0,44% delle donne con un’età di 30 anni (1/227) al
2,38% a 50 anni (1/42) e al 3,82% per le donne di 70 anni
(1/26). Le ragioni di questa correlazione con l’età sono
varie e facilmente intuibili. Per esempio, potrebbe giocare
un ruolo il progressivo e continuo stimolo proliferativo
TABELLA 8.1 Principali fattori di rischio per lo sviluppo
di carcinoma mammario
t
t
t
t
t
t
t
Età
Familiarità ed ereditarietà
Radiazioni ionizzanti
Fattori riproduttivi
Fattori ormonali
Fattori dietetici
Fattori antropometrici e metabolici
120
100
80
60
40
20
2008
2007
2006
2005
2004
2003
2002
2001
2000
1999
1998
1997
1996
1995
1994
1993
1992
1991
1990
1989
1988
1987
0
1986
FIG. 8.3 Trend temporale di incidenza (linea azzurra) e mortalità (linea nera) per carcinoma mammario
in Italia. Da: AIRTUM-AIOM. I numeri
del cancro in Italia. Intermedia Editore,
Brescia, 2008.
Tasso standardizzato ! 100.000
140
253
254
Capitolo 8
Neo p la sie d ella m a m m ella
TABELLA 8.2 Probabilità di sviluppare un carcinoma
mammario nelle diverse fasce di età
Età
%
Assoluto
30
0,44
1/227
40
1,47
1/68
50
2,38
1/42
60
3,56
1/28
70
3,82
1/26
www.cancer.gov/cancertopics/factsheet/Detection/probability-breast-cancer
endocrino che l’epitelio mammario subisce nel corso del
tempo. Inoltre, il danneggiamento progressivo del DNA
che si verifica con l’età e l’accumularsi progressivo di alterazioni epigenetiche potrebbero alterare l’equilibrio di
espressione tra oncogeni e geni soppressori, conducendo
all’espressione patologica di geni legati al ciclo cellulare e
alla perdita dei controlli regolatori a livello dei fattori di
crescita e ai loro recettori.
Familiarità ed ereditarietà
L’importanza della familiarità e dell’ereditarietà come fattore
di rischio è, nell’immaginario collettivo, esagerata. Infatti,
solo circa il 5-7% dei nuovi casi insorge in soggetti con anamnesi familiare positiva per carcinoma mammario, mentre
il rimanente 93-95% rientra nei cosiddetti “casi sporadici”.
Il rischio di ammalarsi di cancro della mammella è, comunque, circa il doppio nei parenti di primo grado di una
paziente con tumore mammario, rispetto alla popolazione
senza familiarità specifica. Al momento, solo circa il 30%
dei casi familiari riconosce una chiara trasmissione genetica dovuta alla presenza di mutazioni in loci genetici “ad
alta suscettibilità” (Fig. 8.4).
In questi casi, si tende a osservare una chiara presenza
di “cluster” familiari di carcinoma mammario, con più
di un parente di primo grado che sviluppa la malattia,
in particolare in età relativamente giovane (<50 anni).
Altri criteri che suggeriscono una chiara ereditarietà sono
rappresentati dal carcinoma bilaterale e dalla presenza di
parenti maschi con carcinoma della mammella o di parenti con tumori ovarici. I due geni più importanti ai fini
A
della predisposizione ereditaria sono il BRCA1 e BRCA2,
che sono stati identificati con analisi di linkage nella metà
degli anni Novanta e svolgono un ruolo nel meccanismo
di riparo del DNA nota come “ricombinazione omologa”
(Wooster e Weber, 2003). Più recentemente, molti altri
loci genici legati allo sviluppo di carcinoma mammario
sono stati identificati. Alcuni di questi sono coinvolti in
rare sindromi genetiche caratterizzate, tra l’altro, da un’elevata suscettibilità allo sviluppo di carcinoma mammario
(per esempio, le mutazioni di TP53 tipiche della sindrome di Li-Fraumeni). In caso di mutazione di loci ad alta
suscettibilità, la probabilità di sviluppare un carcinoma
mammario nel corso della vita è particolarmente elevata e
varia tra il 40% e il 65%. In questi casi, quindi, il rischio è
così alto che i soggetti portatori dovrebbero essere inseriti
in specifici programmi di prevenzione e/o sorveglianza.
È oramai chiaro, comunque, che la maggior parte dei casi
familiari possa essere dovuto a multiple alterazioni geniche
che riguardano alleli a bassa penetranza che si combinano
dando luogo ad alterazioni multigeniche a penetranza più
o meno alta. Questi alleli, indicati normalmente come
BRCAX, sono, per la maggior parte, ancora da identificare
(si veda Fig. 8.4) (Melchor e Benitez, 2013).
Fattori riproduttivi
È noto da tempo che esiste una correlazione inversa tra
l’età della prima gravidanza e il rischio di carcinoma
mammario e si ipotizza che, in parte, questo sia dovuto al
potente stimolo differenziativo che ciascuna gravidanza,
in particolare la prima, esercita sull’epitelio ghiandolare
mammario, riducendone la suscettibilità alla trasformazione. Anche il numero di gravidanze a termine, per gli
stessi motivi, sembrerebbe correlare con un ridotto rischio
di carcinoma mammario. Meno chiaro è, invece, il ruolo
delle interruzioni di gravidanza, che potrebbero, invece,
correlare con un aumento del rischio, per il prevalere sulla
ghiandola dello stimolo proliferativo della prima parte della gravidanza su quello differenziativo tipico della
parte conclusiva della gestazione. L’allattamento sarebbe
anch’esso associato a un rischio ridotto, ma questa associazione potrebbe solo essere dipendente dall’azione protettiva della gravidanza associata. Fattori di rischio acclarati
sono, infine, rappresentati da un menarca precoce e da
una menopausa tardiva, probabilmente perché indicatori
di una più lunga esposizione dell’epitelio ghiandolare agli
stimoli proliferativi degli estrogeni ovarici.
Tutti i pazienti con tumori mammari
B
Pazienti con cancro mammario familiare
BRCAX familiari
Altri geni
a bassa
suscettibilità
ancora da
identificare
51%
Geni a bassa
suscettibilità 67 geni
identificati finora
14%
FIG. 8.4 Distribuzione dei carcinomi mammari in base alla presenza di familiarità. A. I cancri mammari “familiari” rappresentano una
minoranza di tutti i tumori mammari. B. Distribuzione dei casi familiari sulla base dei loci genici mutati.
Modificato da: Melchor e Benitez. Human Genetics 2013.
Cancri mammari
sporadici
93-95%
Cancri mammari
familiari
5-7%
Geni a moderata
suscettibilità
ATM, BRIP1,
CHEK2, NBS1,
RAD50, RAD51B,
RAD51C, RAD51D,
PALB2 e XRCC2
5%
Geni ad alta
suscettibilità
BRCA1 e BRCA2
25%
Geni relativi a
sindromi ad alta
suscettibilità
CDH1, PTEN,
STK11 e TP53
5%
Ca pito l o 8
Fattori dietetici
I fattori dietetici sono stati oggetto di numerosi e approfonditi studi ma, contrariamente a quanto comunemente
ritenuto, sono ancora oggi argomento di grande controversia. La grande variabilità nella distribuzione geografica
della malattia, con un’incidenza nettamente più alta nei
paesi industrializzati, ha fatto a lungo ipotizzare che una
dieta di tipo “occidentale” fosse correlata al rischio di insorgenza del tumore. In realtà, nonostante i numerosi studi
analitici volti a suffragare questa ipotesi, i risultati ottenuti
sono stati contrastanti. Al momento attuale, sebbene sia
impossibile trarre conclusioni certe, il rischio di carcinoma della mammella sembrerebbe essere direttamente
associato al consumo di grassi animali e inversamente
correlato a quello di fibre vegetali. Anche il consumo
di alcol comporterebbe un aumento del rischio, mentre
il contenuto di folati della dieta eserciterebbe un ruolo
protettivo, soprattutto nei soggetti bevitori. In ogni caso,
l’entità del rischio correlato a questi specifici aspetti dietetici sembrerebbe, nella migliore delle ipotesi, piuttosto limitata. Stanno, invece, assumendo via via più importanza,
le aberrazioni dietetiche che conducono all’insorgenza di
obesità e sindrome metabolica (si veda paragrafo “Fattori
antropometrici e metabolici”).
N e o p lasi e della mammella
Con tale termine ci si riferisce alla combinazione di
almeno tre dei seguenti problemi: obesità addominale,
alterato metabolismo glicidico (diabete o prediabete),
lipidi elevati (colesterolo e/o trigliceridi) e ipertensione
arteriosa. È noto che la sindrome metabolica aumenti
il rischio di patologie cardiovascolari, ma dati recenti
suggeriscono che anche il rischio per carcinoma della
mammella sia circa doppio nei soggetti che sviluppano
la sindrome.
Il meccanismo patogenetico che lega la sindrome metabolica al rischio di carcinoma mammario non è noto
con certezza, ma si suppone sia legato alla resistenza
all’insulina che si sviluppa nei soggetti affetti dalla sindrome e a cui l’organismo reagisce aumentando i livelli
insulinemici. L’insulina, agendo sul recettore di membrana per il fattore di crescita insulino-simile-1 (IGF1R),
è potenzialmente in grado di stimolare la crescita del
carcinoma della mammella. Il IGF1R, a sua volta, attiva vie di trasduzione intracellulare del segnale (quali
RAS-RAF-MAPK e PI3K-AKT-mTOR) fondamentali per la
crescita neoplastica e in grado di attivare in cross-talk il
pathway di crescita fondamentale delle cellule mammarie, cioè quello dei recettori per gli estrogeni (Fig. 8.5).
Lo sviluppo della sindrome metabolica poggia su una
chiara predisposizione genetica. Tuttavia, al suo sviluppo
contribuiscono in maniera determinante uno stile di vita
sedentario e una dieta ricca in calorie, grassi e carboidrati
semplici. Ne deriva che uno stile di vita sano, con attività fisica regolare e dieta povera in grassi e carboidrati
semplici e ricca in vegetali e frutta, possa indirettamente
contribuire a ridurre il rischio di cancro della mammella,
almeno nei soggetti geneticamente predisposti alla sindrome metabolica.
Fattori antropometrici e metabolici
L’obesità è un acclarato fattore di rischio per il carcinoma
mammario, probabilmente perché un eccesso di tessuto
adiposo, che nella donna in postmenopausa rappresenta
la principale fonte di estrogeni circolanti, si traduce in un
eccessivo stimolo ormonale sulla ghiandola mammaria.
Particolare attenzione ha ricevuto recentemente la cosiddetta sindrome metabolica.
I GF1R
Grb2
Cbl
P85
Sos
Ras
P110
Raf
Soppressione
dell’apoptosi
PI3K
MAPKK
AKT
MAPK
m TOR
pp90rsk
Ciclina D1, c.myc
Scr
118
P
Scr
167
P
Scr P E
104/106
R
FIG. 8.5 Rappresentazione schematica delle vie di trasduzione del
segnale attivate da IGF1R potenzialmente rilevanti nel carcinoma
mammario. IGF1R: recettore per il
fattore di crescita insulino-simile 1; ER:
recettore degli estrogeni.
P
CoE attivatori
R
P
CBP
Complesso di
trascrizione
ERE
Geni sotto il controllo estrogenico
Proliferazione
e.fos
AP-1
c.jun
255
256
Capitolo 8
Neo p la sie d ella m a m m ella
Fattori ormonali
Gli ormoni sessuali giocano un ruolo fondamentale nello
sviluppo e nella progressione del carcinoma mammario.
Vari studi hanno, pertanto, cercato di identificare un
particolare profilo ormonale che fosse associato a un
incremento del rischio e rendesse conto delle differenze
di incidenza nelle diverse popolazioni. Nel complesso,
i vari studi attribuiscono un ruolo causale ai livelli e alla
durata di esposizione agli estrogeni. L’ipotesi estrogenica
ha il pregio di stabilire un legame comune tra i vari fattori di rischio individuati dagli epidemiologi. La maggior
parte di essi configura, infatti, situazioni di aumentata
esposizione dell’epitelio ghiandolare mammario a tali
ormoni. Controverso è invece il ruolo dei progestinici,
fino a poco tempo fa ritenuti protettivi come per il carcinoma dell’endometrio. I dati sperimentali più recenti
sembrano sovvertire completamente tale visione, individuando in essi un ulteriore fattore di rischio. Sulla base
delle evidenze sperimentali di un’eziologia ormonale del
carcinoma mammario, l’attenzione degli epidemiologi
si è rivolta a stabilire il rapporto tra assunzione di ormoni esogeni e il rischio di sviluppo di malattia. Alcuni
studi hanno evidenziato, per esempio, un incremento
del rischio nelle pazienti che assumono una terapia
sostitutiva ormonale per prevenire i tipici disturbi della postmenopausa. Il rischio relativo legato a questa
terapia sarebbe comunque intorno a 1,5, ma solo per
assunzioni prolungate (almeno 8-10 anni). Abbastanza
ridimensionato, invece, il ruolo dei contraccettivi orali,
che con le moderne associazioni estro-progestiniche a
basso dosaggio sembrerebbero legati a un aumento limitato del rischio, soprattutto per assunzioni prolungate
con inizio in età molto giovane.
In aggiunta agli ormoni sessuali, un ruolo spetterebbe
anche al fattore di crescita insulino-simile (IGF) i cui
livelli circolanti correlerebbero con il rischio di carcinoma
mammario nelle donne in premenopausa (Hankinson et
al., 1998) e alla prolattina, i cui livelli correlerebbero con
il rischio sia in pre- che in post-menopausa (Tworoger
et al., 2007).
ANATOMIA PATOLOGICA
CLASSIFICAZIONE ISTOLOGICA
La ghiandola mammaria è composta da tessuto epiteliale
ghiandolare immerso in un denso stroma fibro-adiposo.
Nella donna adulta la ghiandola mammaria comprende
circa 27 unità funzionali definite lobi.
Ciascun lobo è drenato da un dotto galattoforo che sbocca nel capezzolo e si dirama verso il parenchima in dotti
segmentari fino all’unità funzionale, secernente, definita
unità terminale duttulo-lobulare (TDLU) (Wellings e Jensen, 1973) (Fig. 8.6).
L’unità duttulo-lobulare è rivestita da due strati di cellule:
●
●
interno: cellule epiteliali (luminali) che rivestono il
lume ghiandolare. Le cellule luminali hanno forma
cilindrica o cubica ed esprimono citocheratine 8, 18
e 19, -lactoalbumina e antigene epiteliale di membrana;
esterno: cellule mioepiteliali (basali) che poggiano sulla
membrana basale. Le cellule basali hanno forma allungata e contengono sia filamenti tipici delle cellule
epiteliali (citocheratine 5, 6) sia filamenti contrattili
tipici delle cellule muscolari lisce (actina muscolo liscio, calponina, caldesmone, miosina a catene pesanti).
4"''")8-.-''"9"+"
!"#"
6&#+*)*.-3'&57*
4"''")3*5+*'"+&"
2*..0.*
#-3-.&
$%&'()'*+,&%-.*
/0''0."1.0#0.-+*
FIG. 8.6 Struttura della ghiandola
mammaria: dal lobo all’unità terminale duttulo-lobulare.
2*..0.*
.0,&%-.&
40''0."
!"#0."
2-+5&%",-)!"#$!%&
2-+5&%",-)&%9&.'+-%'*
Ca pito l o 8
I dotti escretori sono circondati da uno strato di fibre
elastiche, che si interrompe a livello delle diramazioni
di minor calibro ed è assente intorno all’unità duttulolobulare che è invece circondata da un stroma connettivale
lasso contenente piccoli vasi capillari e linfatici (Mariuzzi,
2007). Il 95% delle lesioni neoplastiche della mammella, indipendentemente dal fatto che si sviluppino come
forme duttali o lobulari, deriva dalle cellule della TDLU
N e o p lasi e della mammella
(Wellings e Jensen, 1973). La classificazione istopatologica
di riferimento per i tumori mammari è quella della WHO
(Tab. 8.3) (Lakhani et al., 2012).
Carcinoma in situ
Per carcinoma in situ si intende una neoplasia maligna che rimane localizzata nella struttura nella quale
insorge.
TABELLA 8.3 Classificazione dei tumori della ghiandola mammaria secondo WHO 2012
Tumori epiteliali
Carcinoma microinvasivo
Carcinoma mammario infiltrante
Carcinoma infiltrante di tipo non specifico (NAS)
Carcinoma lobulare infiltrante
Carcinoma tubulare
Carcinoma cribriforme
Carcinoma mucinoso
Carcinoma con caratteristiche midollari
Carcinoma con differenziazione apocrina
Carcinoma infiltrante micropapillare
Carcinoma apocrino
Carcinoma con differenziazione ad anello con sigillo
Carcinoma metaplastico di tipo non speciale
Tipi rari
Carcinoma con caratteristiche neuroendocrine
Carcinoma secretorio
Carcinoma papillare invasivo
Carcinoma a cellule aciniche
Carcinoma mucoepidermoidale
Carcinoma polimorfo
Carcinoma oncocitico
Carcinoma ricco in lipidi
Carcinoma a cellule chiare ricche di glicogeno
Carcinoma sebaceo
Tumori tipo ghiandole salivari/annessi cutanei
Tumori epiteliali-mioepiteliali
Adenoma pleomorfo
Adeno-mioepitelioma
Carcinoma adenoidocistico
Precursori
Carcinoma duttale in situ
Neoplasia lobulare
Lesioni proliferative intraduttali
Iperplasia duttale usuale
Lesioni con cellule a colonna comprendenti
l’atipia epiteliale piatta
Iperplasia duttale atipica
Tumori mesenchimali
Fascite nodulare
Miofibroblastoma
Fibromatosi di tipo desmoide
Tumore infiammatorio miofibroblastico
Lesioni vascolari benigne
Iperplasia stromale pseudoangiomatosa
Tumore a cellule granulari
Tumore benigno delle guaine dei nervi periferici
Lipoma
Liposarcoma
Angiosarcoma
Rabdomiosarcoma
Osteosarcoma
Leiomioma
Leiomiosarcoma
Tumori fibroepiteliali
Fibroadenoma
Tumore filloide
Amartoma
Tumori del capezzolo
Adenoma del capezzolo
Tumore siringomatoso
Malattia di Paget del capezzolo
Linfomi maligni
Linfoma diffuso a grandi cellule di tipo B
Linfoma di Burkitt
Linfoma a cellule T
Linfoma extranodale di tipo marginale a cellule B o tipo MALT
Linfoma follicolare
Tumori metastatici
Tumori della mammella maschile
Ginecomastia
Carcinoma invasivo
Carcinoma in situ
Lesioni papillari
Papilloma intraduttale
Carcinoma papillare intraduttale
Carcinoma papillare incapsulato
Carcinoma papillare solido
Proliferazioni epiteliali benigne
Adenosi sclerosante
Adenosi apocrina
Adenosi microghiandolare
Radial scare/lesione sclerosante complessa
Adenomi
Modificata da: Lakhani S, Ellis IO, Schnitt SJ et al. WHO classification of tumour of the breast. 4th ed. IARC, Lyon, 2012.
257
258
Capitolo 8
Neo p la sie d ella m a m m ella
Pertanto, un carcinoma in situ non ha la possibilità di metastatizzare, non venendo in contatto con i vasi.
In epoca premammografica, la forma in situ costituiva il
5% dei carcinomi mammari; dopo l’introduzione dello
screening mammografico, la sua incidenza è salita a circa
il 20%.
Vengono identificati tre sottotipi di carcinoma non invasivo:
carcinoma duttale in situ (DCIS; neoplasia intraepiteliale
duttale [DIN] e carcinoma intraduttale ne sono sinonimi),
carcinoma lobulare in situ (LCIS o neoplasia intraepiteliale
lobulare [LIN]) e malattia di Paget del capezzolo. DCIS e
LCIS, a loro volta, sono classificati prevalentemente in base
ai caratteri citologici. Il carcinoma duttale in situ (Fig. 8.7)
è diviso, in base ai caratteri nucleari, in grado 1, 2 e 3, il
carcinoma lobulare si distingue in tipo usuale e pleomorfo.
Pur mancando di potenziale di metastatizzazione, il DCIS
può recidivare o evolvere verso il carcinoma invasivo. Il
27% dei DCIS a basso grado recidiva a 10 anni, di questi
il 41% presenterà componente invasiva. Tra i DCIS ad alto
grado il 56% (44% in forma invasiva) recidiva a 10 anni.
Per quanto riguarda il carcinoma lobulare in situ, la sua
evoluzione verso una forma invasiva è dubbia e, verosimilmente, limitata all’istotipo pleomorfo. Pertanto, il
carcinoma lobulare in situ è da intendersi più come un
fattore di rischio che come una lesione preinvasiva.
nodulo palpabile e in ecografia/mammografia si evidenzia come un nodulo a margini mal definiti o spiculati
associato o no a microcalcificazioni. Microscopicamente
si osserva presenza di cellule atipiche disposte in cordoni
solidi, gruppi, trabecole e talvolta in strutture ghiandolari
irregolari che permeano e infiltrano lo stroma.
L’istotipo lobulare (Fig. 8.9), costituisce il 5-15% dei tumori mammari. Nel 20% dei casi si presenta come multicentrico o bilaterale. Le cellule che lo costituiscono sono
piccole, poco coese, spesso con disposizione a “filiera”.
Tra le varianti alla forma classica di carcinoma lobulare,
l’istotipo pleomorfo è degno di nota per comportamento
aggressivo e prognosi peggiore (Eusebi et al., 1992).
Per essere classificato come duttale o lobulare, un carcinoma mammario deve mostrare un pattern istologico
non specifico in almeno il 50% della sua componente.
Negli altri casi, le caratteristiche patologiche permettono
l’attribuzione del tipo a forme speciali. Gli istotipi specifici
si distinguono, oltre che per gli aspetti morfologici, per il
peculiare comportamento clinico. Per ogni istotipo esistono varianti e forme miste.
La malattia di Paget è clinicamente caratterizzata da un
essudato o eczema del capezzolo e dell’areola causata dalla
presenza di cellule epiteliali ghiandolari maligne nello
spessore dell’epitelio squamoso dell’epidermide del capezzolo e dell’areola. Solo nell’1,4-13% dei casi la malattia
di Paget non è associata a carcinoma infiltrante o in situ
sottostante (Edge et al., 2010).
Carcinoma invasivo
Il carcinoma invasivo è tale quando si estende oltre la
membrana basale, infiltrando lo stroma sottostante.
Il carcinoma duttale invasivo o infiltrante (Fig. 8.8) rappresenta il tipo istologico più comune e comprende fino
all’80% di tutti i casi. Esso si manifesta solitamente come
FIG. 8.7 Carcinoma duttale in situ.
FIG. 8.8 Carcinoma duttale infiltrante.
FIG. 8.9 Carcinoma lobulare infiltrante.
Ca pito l o 8
Il carcinoma tubulare si caratterizza per presenza di tubuli a
profilo angolato con lume beante e desmoplasia stromale.
Rispetto al duttale NAS, compare in età più avanzata, ha
un diametro inferiore e meno frequentemente si accompagna a metastasi linfonodali. La prognosi, soprattutto per
l’istotipo puro, è molto favorevole.
TABELLA 8.4 Criteri di attribuzione dei punteggi
alle tre variabili secondo il Nottingham Breast Cancer
Grading System
L’istotipo papillare si distingue per architettura papillare
all’interno di dotti o cisti, con presenza di invasione stromale. Prevale in postmenopausa e rappresenta meno del
2% dei carcinomi mammari. La prognosi è buona.
Cellule aggregate in laghi di muco e talora a differenziazione neuroendocrina configurano il carcinoma mucinoso.
L’età media di presentazione supera i 60 anni (Capella
et al., 1980). Il potenziale di malignità è basso.
Il carcinoma midollare non forma né ghiandole né tubuli,
oltre il 75% della lesione è ad architettura sinciziale. Si
caratterizza per cospicuo infiltrato linfoide intralesionale, atipia marcata, numerose mitosi e margini espansivi.
Rappresenta il 5% dei tipi invasivi e si associa spesso alla
mutazione BRCA1. Nei casi di recidiva entro 5 anni dal
trattamento, è stata descritta evoluzione rapida e infausta.
Tutti carcinomi mammari (a eccezione del carcinoma midollare) devono, inoltre, essere studiati relativamente al loro grado istologico. Il sistema di riferimento è l’Elston-Ellis
Modification of Scarff-Bloom-Richardson Grading System. Esso
assegna un punteggio al tumore sulla base di tre variabili:
la formazione di strutture ghiandolari da parte delle cellule
tumorali, il pleomorfismo nucleare e il numero di mitosi
per campo microscopico ad alto ingrandimento (HPF).
Per ciascuna di queste variabili, il punteggio (score) può
variare da 1 a 3 (Tab. 8.4). La somma dei punteggi delle
singole variabili determina il grado istologico del tumore
(Tab. 8.5) (Elston e Ellis, 1991; Fitzgibbons et al., 2000).
Classificazione molecolare e immunofenotipica
La recente introduzione della valutazione genomica di DNA
e mRNA ha portato a una nuova classificazione del carcinoma mammario, insieme al concetto che esso comprende
entità patologiche distinte. Le nuove tecnologie del microarray permettono di studiare e quantificare, nei diversi tumori,
l’espressione di una grande quantità di geni contemporaneamente (Cotran et al., 2000).
La classificazione del carcinoma mammario secondo la
espressione genica è un prezioso strumento per predire
Percentuale
formante
ghiandole
Pleomorfismo
nucleare
Indice
mitotico
Score 1
>75%
Nuclei piccoli
e uniformi
Score 2
10-75%
Aumento
di grandezza
dei nuclei e
variabilità moderata
Dipendenza
dall’area
di campo
del microscopio
Score 3
<10%
Marcata variabilità
TABELLA 8.5 Correlazione tra punteggio totale, grado
istologico e prognosi
Punteggio
totale
L’adenoidocistico può essere classificato fra gli istotipi a buona prognosi, anche se la scarsa frequenza (<0,1%) rende
difficile affermarlo con certezza.
Il carcinoma infiammatorio deriva dall’interessamento dei
vasi linfatici che, invasi dalle cellule tumorali, determinano
una modificazione che simula il processo infiammatorio in
mammella e cute. La diagnosi di carcinoma infiammatorio
è in primo luogo clinica. La lesione eritematosa della cute,
che presenta aspetti a “buccia di arancia”, occupa solitamente oltre un terzo della superficie mammaria e si associa
a linfedema. Il carcinoma infiammatorio, fra tutti, ha la
prognosi peggiore e si osserva nell’1-6% dei casi di tumore
mammario (Wellings e Jensen, 1973; Mariuzzi, 2007).
N e o p lasi e della mammella
Grado istologico
Prognosi
GX – non determinabile
3-5
G1 – ben differenziato
Buona
6-7
G2 – moderatamente differenziato
Intermedia
8-9
G3 – scarsamente differenziato
Sfavorevole
il rischio di recidiva e il beneficio da endocrinoterapia o
chemioterapia nel singolo paziente. La sua applicazione si
inserisce ad hoc nell’obiettivo di individualizzazione della
gestione del paziente oncologico (tailored approach).
I sottotipi definiti da criteri immunofenotipici sono simili
ma non identici ai sottotipi intrinseci (classificazione genomica), rappresentandone comunque una conveniente
approssimazione (Tab. 8.6).
I profili genetici e i corrispettivi immunofenotipi di riferimento sono:
●
●
●
●
luminal A: tumori che esprimono i recettori ormonali
(estrogeni [ER] positivi e/o progesterone [PgR] positivi)
con indice di proliferazione (Ki67) 14%;
luminal B:
● HER2 negativi: tumori che esprimono i recettori
ormonali (ER positivi e/o PgR positivi) con indice
di proliferazione (Ki67) >14%;
● HER2 positivi: tumori che esprimono i recettori
ormonali (ER positivi e/o PgR positivi) e che presentano l’iperespressione della proteina HER2 o
l’amplificazione del gene HER2/neu;
HER2 enriched: tumori HER2 positivi, ma non esprimono i recettori ormonali;
triple negative (TN):
● basal like: tumori che non esprimono né i recettori
ormonali né presentano positività per HER2, ma
259
260
Capitolo 8
Neo p la sie d ella m a m m ella
TABELLA 8.6 Criteri immunoistochimici di definizione dei sottotipi di carcinoma mammario
ER e/o PgR
HER2
CK5/6
EGFR
Ki67
+
!
Qualsiasi
Qualsiasi
!
HER2 negativo
+
!
Qualsiasi
Qualsiasi
+
HER2 positivo
+
+
Qualsiasi
Qualsiasi
Qualsiasi
!/!
+
Qualsiasi
Qualsiasi
Basal-like
!/!
!
+ o l’uno o l’altro
Non basal
!/!
!
!
Luminal A
Luminal B
HER enriched
Triple negative
●
esprimono alcune proteine peculiari quali EGFR o
alcune citocheratine (5, 6);
non basal: tumori che non esprimono né i recettori
ormonali (ER e PgR negativi) né presentano positività per HER2, EGFR e citocheratine 5, 6.
I tumori luminal A hanno andamento indolente, si caratterizzano per la sensibilità all’ormonoterapia con antiestrogeni e per la scarsa responsività agli agenti citotossici. La
loro prognosi è, tra tutti, la migliore.
Per quanto riguarda i luminal B, la sensibilità all’ormonoterapia è incompleta e il trattamento chemioterapico è da
prendersi in considerazione. La presenza fra i luminal di
forme HER2 positive offre la possibilità di affiancare con
successo una terapia anti-HER2.
Il TN è un fenotipo aggressivo. Dato il suo profilo di espressione recettoriale, l’unica opzione terapeutica rimane quella
citotossica, alla quale dimostra buona sensibilità. La prognosi
rimane comunque cattiva. Il fatto che l’espressione di BRCA1
sia coinvolta nella differenziazione delle cellule progenitrici in
cellule luminali ER-positive è in linea con l’elevata incidenza
di mutazione BRCA1 nei fenotipi TN e con la sovrapposizione
di questi con i tumori basal like (80% dei casi).
Le differenze tra fenotipi si osservano anche nei pattern di
metastatizzazione e nelle tempistiche di recidiva. I tumori
ER-negativi sono associati a maggior rischio di recidiva
precoce, che nella maggior parte dei casi si verifica entro i
5 anni, a differenza degli ER-positivi per i quali il rischio
è inferiore ma persiste oltre i 5 anni. Per i luminal A il
rischio di recidiva, pur basso, si può concretizzare anche
oltre i 15 anni.
Qualsiasi
Qualsiasi
!
Qualsiasi
L’osso è il sito prevalente di recidiva per i luminal A e B. Il
sottotipo HER2 enriched ha il più alto tasso di metastasi
encefaliche e si associa più frequentemente a metastasi
a fegato, polmoni ed encefalo. I basal like hanno una
maggiore incidenza di metastasi a polmoni, encefalo
e linfonodi. L’alta frequenza di metastasi encefaliche
tra i pazienti con malattia HER2 positiva e TN supporta
l’utilità di una più attenta valutazione specifica neurologica, clinica e radiologica, per queste categorie (Sotiriou
e Pusztai, 2009; Voduc et al., 2010; Kennecke, et al., 2010;
Goldhirsch et al., 2011).
SCREENING
Lo screening, come tale, si attua in donne che non presentano alcun segno o sintomo di tumore mammario così
che la malattia possa essere intercettata in fase preclinica e
con maggiori opportunità di trarre vantaggio dalle terapie.
La mammografia bilaterale è il test di screening per il
carcinoma mammario. Studi clinici randomizzati hanno
dimostrato, infatti, che la sua applicazione diminuisce
la mortalità per carcinoma mammario (Nattinger, 2010;
Nelson et al., 2009; Tabar et al., 2003). In particolare, in
accordo ai risultati di una metanalisi di 7 studi, è emerso
un chiaro vantaggio nella fascia di età compresa tra i 50 e i
69 anni (Tab. 8.7). È inoltre evidente come il beneficio in
termini di riduzione di mortalità vari in funzione dell’età
(da circa il 15% per le donne tra i 40 e i 59 anni al 32%
per le donne tra i 60 e i 69 anni). La prevalenza (probabilità pre-test) del carcinoma mammario e l’accuratezza
della mammografia sono altri parametri che possono
TABELLA8.7 Effetti dello screening mammografico sulla mortalità per carcinoma mammario in funzione dell’età
Fascia di età
Trial inclusi (N)
Mortalità per carcinoma mammario,
riduzione del rischio (%) (IC 95%)
Numero di soggetti da invitare per prevenire
una morte da carcinoma mammario (N) (IC 95%)
39-49
8
0,85 (0,75-0,96)
1.904 (929-6.378)
50-59
6
0,86 (0,75-0,99)
1.339 (322-7.455)
60-69
2
0,68 (0,54-0,87)
377 (230-1.050)
70-74
1
1,12 (0,73-1,72)
Non valutabile
Modificata da: US Preventive Services Task Force. Ann Int Med 2009.
Ca pito l o 8
N e o p lasi e della mammella
La gestione dell’esame di screening si basa sull’età e sul
grado di rischio per carcinoma mammario della donna
(Fig. 8.10). Nella donna con un rischio normale per carcinoma mammario l’evidenza che supporta lo screening è
maggiore se ha età compresa tra i 50 e i 69 anni. La cadenza
raccomandata è biennale (White et al., 2004). Rimane
dibattuto l’approccio alle donne di età inferiore ai 50 anni
o superiore ai 70 anni. Tra i 40 e i 49 anni, dal momento
essere influenzati dall’età dei soggetti screenati e che, a
loro volta, possono incidere sull’efficacia dello screening
mammografico (Tab. 8.8).
D’altro canto, non esiste alcuna evidenza scientifica di
efficacia quali test di screening per l’autoesame, l’esame clinico della mammella e l’ecografia mammaria (Hackshaw
e Paul, 2003; Miller et al., 2000; Baines et al., 1989; Teh e
Wilson, 1998).
TABELLA 8.8 Effetti dello screening mammografico in base alla fascia di età
Fascia di età
40-49
50-59
60-69
70-79
80-89
Falsi positivi della mammografia
97,8
86,6
79,0
68,8
59,4
Carcinomi invasivi identificati dallo screening
1,8
3,4
5,0
6,5
7,0
Carcinomi in situ diagnosticati dallo screening
0,8
1,3
1,5
1,4
1,5
Numero di mammografie per soggetto screenato
al fine di diagnosticare un caso di carcinoma invasivo
556
294
200
154
143
Numero di soggetti sottoposti a biopsia
al fine di diagnosticare un caso di carcinoma invasivo
5
3
2
2
1.5
Effetti dello screening ogni 1.000 donne screenate (N)
Effetti dello screening per ogni screening round (N)
Modificata da: US Preventive Services Task Force. Ann Int Med 2009.
40 anni
<50
Rischio normale
50 anni
<70
anni
In relazione a familiarità
e fattori di rischio
Esame clinico
mammella / 1 anno
Mammografia / 2 anni
Autoesame
In relazione a comorbilità
Asintomatica,
esame
obiettivo
negativo
Precedente
radioterapia toracica
Rischio aumentato
Sintomatica
o esame
obiettivo
positivo
Esame clinico mammella
Mammografia/Ecografia mammaria
Autoesame
Forte familiarità
o predisposizione
genetica
Altre cause di
rischio aumentato
Procedere con diagnosi
clinico-radiologica
FIG. 8.10 Gestione del test di screening. RM: risonanza magnetica; RT: radioterapia.
Esame clinico mammella
Mammografia
Autoesame
Mammografia annuale
(iniziare 8-10 anni dopo la RT o ai 25 anni)
Considerare RM annuale
Autoesame
Mammografia annuale
(iniziare ai 25 anni o 5-10 anni prima del caso
più giovane in famiglia)
Autoesame
Valutare RM annuale
Consulenza genetica
Mammografia annuale
Esame clinico ogni 6-12 mesi
Autoesame
261
262
Capitolo 8
Neo p la sie d ella m a m m ella
che il beneficio assoluto dello screening è inferiore (Moss
et al., 2006; Berg, 2010), la decisione va condivisa con la
donna e la cadenza va personalizzata sui fattori di rischio
quali storia familiare e densità del tessuto mammario.
Per le donne di età superiore ai 70 anni i controlli mammografici biennali possono essere considerati quando,
in relazione alle comorbilità, non pesano sulla qualità di
vita del soggetto.
Nelle donne portatrici del gene BRCA1 l’aggiunta della
RM alla mammografia è vantaggiosa in termini di costo/
efficacia rispetto al solo screening mammografico (Plevritis
et al., 2006). I controlli dovrebbero essere iniziati all’età di
25 anni o 10 anni prima dell’età di insorgenza del tumore
nel familiare più giovane.
I soggetti con un test di screening positivo devono essere
sottoposti alle procedure diagnostiche (indagini di secondo livello) atte ad accertare la presenza della malattia.
Recentemente, l’esame mammografico è stato messo in
discussione per il danno da overdiagnosis che, come per tutti
i test di screening, si accompagna alla sua applicazione. Il
danno da overdiagnosis si manifesta in termini di tossicità
a breve e lungo termine dei trattamenti, peggioramento
della qualità di vita e costi ingiustificati. Tra le diagnosi
di DCIS e carcinoma mammario invasivo, la frequenza di
overdiagnosis è del 31% (frequenza stimata per l’invasivo:
20%). Tale porzione di donne sarà sottoposta a intervento
chirurgico, terapia radiante, trattamento ormonale e/o
chemioterapico per un’anomalia che non avrebbe determinato, nel corso della vita, sintomi.
Inoltre, va osservato che può essere improprio attribuire
la riduzione in mortalità per tumore della mammella,
riscontrata negli ultimi anni, esclusivamente all’aumento
delle diagnosi precoci. Tale vantaggio in sopravvivenza è
infatti attribuibile, in gran parte, al miglioramento delle
opzioni terapeutiche (Bleyer e Welch, 2012).
●
●
linfoadenopatia ascellare;
dolore (Casciato e Barry, 2000).
La visita clinica è una parte indispensabile della gestione
della paziente in fase sia diagnostica sia terapeutica. L’esame senologico richiede scrupolosità accompagnata a
delicatezza e discrezione, in considerazione del naturale
imbarazzo che lo accompagna.
Nella valutazione della donna operata per carcinoma
mammario è doverosa l’analisi minuziosa della cicatrice
chirurgica (nell’esclusione della recidiva locale). Il carcinoma mammario tende a diffondere precocemente per via
linfatica. L’esame obiettivo della mammella deve quindi
essere sempre accompagnato dall’accurata valutazione
dei linfonodi ascellari, sovraclaveari e laterocervicali. L’esame toracico permette la ricerca di eventuale versamento
pleurico. La semeiotica addominale deve comprendere la
valutazione epatica. La digitopressione ossea è importante
per lo studio delle localizzazioni secondarie.
Semeiotica radiologica
La mammografia non ha valenza solo in termini di test
di screening, essa è da considerarsi l’esame cardine della
diagnostica senologica.
In presenza di noduli palpabili, la sua accuratezza diagnostica è superiore al 90%. La sensibilità della mammografia
è pari all’85-90% se la mammella è ricca di strutture adipose, ma scende al di sotto del 70% se la componente adiposa
è poco rappresentata. Ciò accade più frequentemente in
mammelle di donne giovani, dove è bene integrarla con
l’esame ecografico (Fig. 8.11) (i cui reperti vengono valutati
secondo 6 categorie similari a quelle mammografiche).
DIAGNOSI
Semeiotica clinica
Circa la metà dei tumori mammari origina nel quadrante
supero-esterno della mammella, il 15% in quello superointerno, il 10% in quello infero-esterno e il 5% in quello
infero-interno. Nel 17% dei casi l’interessamento della
mammella è sottoareolare e nel 3% diffuso.
La cosiddetta caratteristica “dominante” del carcinoma
mammario è il ritrovamento di un nodulo in sede mammaria, tipicamente solitario, unilaterale, solido, duro, irregolare, fisso e non dolente. Il 90% dei carcinomi mammari
ha questa presentazione clinica.
Altri segni e sintomi sono:
●
●
secrezione spontanea dal capezzolo: è il secondo segno
più comune. La probabilità di un’origine maligna è
maggiore se la donna supera i 50 anni di età, la secrezione è sieroematica, ematica o sierosa;
alterazioni cutanee: eczema del capezzolo (tipico della
malattia di Paget), eritema cutaneo, edema o indurimento sottostante in assenza di infezioni (depone per
carcinoma infiammatorio);
FIG. 8.11 Ecografia mammaria destra. Al quadrante supero-esterno si
evidenzia area ipoecogena, a morfologia irregolare, con assorbimento del
segnale acustico posteriore, riccamente vascolarizzata all’esame color Doppler, di 29 " 20 mm. Diagnosi istologica: carcinoma infiltrante NAS, grado 2
(per gentile concessione del Prof. Massimo Bazzocchi, Istituto di Radiologia,
AOU di Udine).
Ca pito l o 8
I risultati della valutazione mammografica vengono classificati in una delle seguenti categorie BI-RADS (Breast Imaging Reporting and Data System) (National Comprehensive
Cancer Network, 2012).
1. Incompleta: richiede un addizionale esame e/o una
mammografia precedente da comparare. Categoria
più spesso usata nell’ambito degli esami di screening. La richiesta di un esame addizionale può
includere compressione, ingrandimento, proiezioni
speciali e ultrasuoni.
2. Negativa: mammella simmetrica, no masse, no distorsioni del parenchima mammario o calcificazioni
sospette.
3. Reperti benigni: gli scenari tipici sono le calcificazioni apparentemente benigne come un fibroadenoma benigno, una oil cyst o un lipoma. Chi legge
le immagini può scegliere di descrivere i linfonodi
inframammari, le calcificazioni vascolari, protesi
o distorsioni chiaramente legate a un precedente
intervento chirurgico. In ogni caso si conclude per
l’assenza di reperti di malignità.
4. Reperti probabilmente benigni: questo è un mammogramma di solito benigno. È però consigliato un
nuovo esame a breve termine per testarne la stabilità. Il rischio di lesione maligna è stimato sotto il
2%.
5. Anomalie sospette: queste lesioni cadono tra quelle ad
alto rischio di malignità ma non sono sicuramente
maligne. Il rischio di malignità è molto variabile,
comunque compreso tra il rischio della categoria
3 e quello della 5. Da considerare l’esecuzione di
esame bioptico.
6. Altamente suggestivo di malignità: queste lesioni
hanno un rischio alto di essere carcinomi ( 95%).
Sono incluse le masse spiculate o le calcificazioni
pleomorfe ecc. Necessario procedere con adeguati
provvedimenti;
7. Biopsia nota: malignità provata.
L’iter diagnostico e terapeutico è deciso in base al grado
BI-RADS (Fig. 8.12).
Aspetti mammografici caratteristici delle lesioni tumorali
maligne sono: nodulo radiopaco a contorni irregolari, microcalcificazioni (piccole e numerose calcificazioni di diametro massimo inferiore al millimetro con distribuzione
anarchica) e infiltrazione del parenchima circostante con
distorsione dell’architettura della ghiandola (Fig. 8.13).
La RM (Fig. 8.14) trova spazio in caso di: mammelle con
protesi, stadiazione prechirurgica (multifocalità/centricità,
bilateralità), mammella operata (per distinguere cicatrice
da recidiva), valutazione terapie neoadiuvanti, cup syndrome, screening in donne ad alto rischio (genetico/familiare).
La RM ha una sensibilità maggiore rispetto alla mammografia, ma una specificità ridotta così che numerosi sono i
falsi positivi (Lord et al., 2007; Mann et al., 2008; Schnall
e Orel, 2006).
BI-RADS® 0
Comparare con mammografie precedenti,
valutazione ecografica
BI-RADS® 1-2
Continuare secondo il programma di screening
BI-RADS® 3
BI-RADS® 4-5
Ripetere MX a 6 mesi
(dopo ogni 6-12 mesi
per 1-2 anni)
Biopsia
N e o p lasi e della mammella
Quadro stabile
o risolto
Procedere come
BI-RADS® 1-2
Sospetto
aumentato
Procedere come
BI-RADS® 4-5
Benigno
Mammografia
a 6-12 mesi
ogni 1-2 anni
Iperplasia atipica, LCIS,
altri ritrovamenti patologici
Maligno
Escissione
chirurgica
Trattamento del carcinoma
FIG. 8.12 Percorso diagnostico-terapeutico indicato per categorie di valutazione mammografica. BI-RADS: Breast Imaging Reporting and Data System; LCIS:
carcinoma lobulare in situ; MX: mammografia.
263
264
Capitolo 8
Neo p la sie d ella m a m m ella
FIG. 8.13 Mammografia sinistra. Al quadrante supero-esterno si evidenziano microcalcificazioni granulari pleomorfe a distribuzione segmentale
estese per 27 mm. Diagnosi istologica: carcinoma infiltrante NAS, grado
2, associato a componente intraduttale (per gentile concessione del Prof.
Massimo Bazzocchi, Istituto di Radiologia, AOU di Udine).
FIG. 8.14 Risonanza magnetica mammaria. In corrispondenza del quadrante
supero-esterno di sinistra si evidenzia area di enhancement intenso, disomogeneo, di tipo mass-like; a morfologia irregolare e margini spiculati, di 38
mm. Diagnosi istologica: carcinoma infiltrante NAS, grado 2 (per gentile concessione del Prof. Massimo Bazzocchi, Istituto di Radiologia, AOU di Udine).
I siti più comuni di metastasi da carcinoma mammario
sono scheletro, polmone, fegato ed encefalo. Esistono
varie metodiche radiologiche utili a identificare eventuali
localizzazioni a distanza.
La comparsa di metastasi epatiche si associa a cattiva prognosi. Quando le lesioni epatiche hanno diametro 2 cm
sono ben visualizzabili in ecografia. Su guida ecografica è
possibile inoltre effettuare un prelievo citologico o bioptico a scopo diagnostico. TC, RM e tomografia a emissione
di positroni (PET/TC) permettono di individuare e caratterizzare con maggiore precisione le lesioni epatiche. La loro
applicazione routinaria in pazienti asintomatici, tuttavia,
non è raccomandata.
Per quanto riguarda le metastasi ossee, la scintigrafia ossea
è l’esame di scelta, preferibile alla radiografia standard per
la superiore sensibilità e la possibilità di mappare tutto
l’apparato scheletrico in un unico esame. Le radiografie
mirate sono indicate per la sintomatologia focale o per
la correlazione con l’esame scintigrafico (O’Mara, 1974).
L’esame scintigrafico non è indicato nella stadiazione basale di tumori in stadio precoce (stadio I, II) (Puglisi et
al., 2007; Puglisi et al., 2005a). La probabilità di risultati
positivi è, in tali casi, bassa; inoltre, non è stato dimostrato
un aumento della sopravvivenza associato all’identificazione di metastasi ossee nelle donne asintomatiche (Rosselli
Del Turco et al., 1994; Coleman et al., 1988; McNeil et
al., 1978). La scintigrafia è utile per valutare la risposta al
trattamento tenendo in debita considerazione la possibilità
di falsi positivi (fenomeno flare) quando eseguita subito
dopo la terapia sistemica.
Le metastasi polmonari sono individuabili grazie a radiografia standard del torace o tomografia computerizzata
(TC). La radiografia standard è utile, inoltre, nell’identificazione del versamento pleurico anche di lieve entità.
Essa, pur essendo di facile e poco costosa applicazione,
non ha però dimostrato un miglioramento di outcome se
eseguita ordinariamente in pazienti asintomatici (Huynh
et al., 2012). La TC trova spazio essenzialmente nell’approfondimento dei casi positivi. L’ecografia toracica può
rivelarsi utile nel confermare la presenza di versamento
pleurico, caratterizzarlo, identificare metastasi pleuriche
e guidare la toracentesi.
È raro che pazienti con diagnosi di tumore in stadio precoce presentino metastasi encefaliche. All’esame TC, esse si
presentano, usualmente, con forma nodulare o ad anello,
possono essere singole o multiple, si associano a edema
delle strutture circostanti e presentano buon enhancement
del mezzo di contrasto. La RM con gadolinio ha ormai ampiamente rimpiazzato la TC nella caratterizzazione delle
lesioni encefaliche, per la maggiore sensibilità.
Il riscontro di un nodulo mammario palpabile e di un’immagine radiologica sospetta deve accompagnarsi ad approfondimento diagnostico mediante biopsia.
La diagnosi definitiva di carcinoma mammario, infatti,
si basa sull’esame anatomopatologico. Esso si può eseguire su:
●
●
●
biopsia escissionale: fornisce informazioni su dimensioni
tumorali e diagnosi istologica;
biopsia percutanea (core biopsy): diagnosi istologica;
agoaspirato: diagnosi citologica. Non rende possibile la
distinzione tra forma in situ e forma invasiva. Il campione è spesso poco rappresentativo e la quota di falsi
negativi non è trascurabile (Pisano et al., 2001).
Ca pito l o 8
Se è previsto trattamento chemioterapico neoadiuvante, al
momento dell’esecuzione della biopsia, vengono posizionate clip chirurgiche per facilitare la successiva resezione
chirurgica.
Sul campione bioptico, di norma, oltre alla diagnosi, si
esegue la determinazione dell’espressione recettoriale di
estrogeni (ER) e progesterone (PgR) e dello stato di HER2.
La valutazione dell’indice proliferativo MIB1/Ki67 può
fornire informazioni addizionali utili. In caso di risultati
dubbi, la determinazione viene ripetuta sul campione operatorio. La scelta del percorso curativo non può prescindere
dalla conoscenza di questi dati (Aebi et al., 2011).
STADIAZIONE
Un’accurata determinazione dello stadio della patologia
è considerata di cruciale importanza per la scelta del percorso clinico da intraprendere nel singolo paziente dal
momento che l’estensione di malattia è strettamente legata
alla prognosi (Tavassoli e Devilee, 2003; Edge et al., 2010).
N e o p lasi e della mammella
Il sistema di stadiazione standard del carcinoma mammario è quello TNM. Esso si basa sulla valutazione di tre
elementi: estensione del tumore primitivo (T), assenza o
presenza ed estensione di metastasi ai linfonodi regionali
(N), assenza o presenza di metastasi a distanza (M). La
stadiazione clinica (cTNM) si basa sulle informazioni ottenute attraverso esame obiettivo, indagini radiologiche
e agoaspirato/biopsia, oltre che su eventuali esami per
l’identificazione di metastasi a distanza (Tab. 8.9). La stadiazione patologica (pTNM) deriva dall’esame istologico
del tumore primitivo e dei linfonodi asportati chirurgicamente (Tab. 8.10).
I prefissi “yc” e “yp” indicano la classificazione dopo terapia neoadiuvante. Nel caso di risposta completa patologica
lo stadio è definito come ypT0 N0 cM0. Il tumore è detto
multifocale se si presenta in foci multipli all’interno di
uno stesso lobo, multicentrico se i foci si localizzano in
lobi diversi, pT(m).
Il T dipende dalla misura della parte invasiva all’esame del
campione operatorio (pT). La malattia di Paget del capezzolo
TABELLA 8.9 Classificazione clinica secondo TNM (VII ed.)
Tumore primitivo (T)
Tx
Tumore primitivo non valutabile
T0
Non evidenza del tumore primitivo
Tis
Carcinoma in situ:
t Tis (DCIS): carcinoma duttale in situ
t Tis (LCIS): carcinoma lobulare in situ
t Tis (Paget): malattia di Paget del capezzolo non associata
con carcinoma invasivo e/o in situ nel parenchima mammario
sottostante
N2
Metastasi nei linfonodi ascellari omolaterali (livello I-II)
che sono clinicamente fissi o fissi tra di loro; o in linfonodi
mammari interni omolaterali clinicamente rilevabili
in assenza di metastasi clinicamente evidenti nei linfonodi
ascellari
N2a
Metastasi nei linfonodi ascellari omolaterali (livello I-II) fissi
tra di loro o ad altre strutture
N2b
Metastasi solamente nei linfonodi mammari interni
omolaterali, clinicamente rilevabili, e in assenza di metastasi
clinicamente evidenti nei linfonodi ascellari (livello I-II)
N3
Metastasi in uno o più linfonodi sottoclaveari omolaterali
(livello III ascellare) con o senza coinvolgimento di linfonodi
ascellari del livello I-II; o nei linfonodi mammari interni
omolaterali clinicamente rilevabili in presenza di metastasi
nei linfonodi ascellari livello I-II clinicamente evidenti;
o metastasi in uno o più linfonodi sovraclaveari omolaterali
con o senza coinvolgimento dei linfonodi ascellari
o mammari interni
T1
Tumore della dimensione massima fino a 2 cm
T1mi: microinvasione della dimensione massima di 0,1 cm
T1a: tumore dalla dimensione compresa tra 0,1 cm e 0,5 cm
T1b: tumore dalla dimensione compresa tra 0,5 cm e 1,0 cm
T1c: tumore dalla dimensione compresa tra 1,0 cm e 2,0 cm
T2
Tumore superiore a 2 cm ma non superiore a 5 cm
nella dimensione massima
T3
Tumore superiore a 5 cm nella dimensione massima
T4
Tumore di qualsiasi dimensione con estensione diretta alla
parete toracica e/o alla cute (ulcerazione o noduli cutanei)
N3a
Metastasi nei linfonodi sottoclaveari omolaterali
N3b
Metastasi nei linfonodi mammari interni e ascellari
T4a
Estensione alla parete toracica (esclusa la sola aderenza/
invasione del muscolo pettorale)
N3c
Metastasi nei linfonodi sovraclaveari
T4b
Ulcerazione della cute e/o noduli cutanei satelliti ipsilaterali
e/o edema della cute (inclusa cute a buccia d’arancia) che
non presenta i criteri per definire il carcinoma infiammatorio
Mx
Metastasi a distanza non accertabili
M0
non evidenza clinica o radiologica di metastasi a distanza
T4c
Presenza contemporanea delle caratteristiche di T4a e T4b
T4d
Carcinoma infiammatorio
Metastasi a distanza (M)
Nx:
Linfonodi regionali non valutabili (per esempio, se
precedentemente asportati)
cM0(i+) non evidenza clinica o radiologica di metastasi a distanza,
ma depositi di cellule tumorali evidenziati mediante
biologia molecolare o microscopicamente nel sangue,
midollo osseo o in altri tessuti diversi dai linfonodi regionali,
di dimensioni non superiori a 0,2 mm in una paziente senza
segni o sintomi di metastasi
N0
Linfonodi regionali liberi da metastasi
M1
N1
Metastasi nei linfonodi ascellari omolaterali mobili (livello I-II)
Linfonodi regionali (N)
Metastasi a distanza, evidenziate mediante i classici esami
clinici e radiologici e/o istologicamente dimostrate, di
dimensioni superiori a 0,2 mm
Modificata da: American Joint Committee on Cancer. AJCC Cancer Staging Manual. 7th ed. New York, NY, Springer-Verlag, 2010.
265
266
Capitolo 8
Neo p la sie d ella m a m m ella
TABELLA 8.10 Classificazione patologica secondo TNM
(VII ed.)
Linfonodi regionali (pN)
pNx
I linfonodi regionali non possono essere definiti (per
esempio, non sono stati prelevati o sono stati rimossi in
precedenza)
pN0
Non metastasi nei linfonodi regionali identificate
istologicamente (aggiungere (sn) se la classificazione è
basata sul linfonodo sentinella senza la dissezione ascellare)
pN0
(i-)
Non metastasi nei linfonodi regionali all’istologia (con
colorazione standard ematossilina-eosina), negativo il
metodo immunoistochimico
pN0
(i+)
Presenza di cellule maligne (ITC) nei linfonodi regionali non
superiori a 0,2 mm (evidenziate con ematossilina-eosina o
con l’immunoistochimica)
pN0
Non metastasi nei linfonodi regionali istologicamente
(mol!) accertate, RT-PCR negativa
Nota: si definiscono cellule tumorali isolate piccoli aggregati di cellule
non più grandi di 0,2 mm o singole cellule tumorali o un piccolo
raggruppamento di cellule con meno di 200 cellule in una singola
sezione istologica. Le cellule tumorali isolate possono essere evidenziate
con i metodi istologici tradizionali o con metodi immunoistochimici. I
linfonodi contenenti solo cellule tumorali isolate sono esclusi dalla conta
totale dei linfonodi positivi ai fini della classificazione N, ma dovrebbero
essere inclusi nel numero totale dei linfonodi esaminati.
pN1
Micrometastasi; o metastasi in 1-3 linfonodi ascellari
omolaterali; e/o metastasi nei linfonodi mammari interni
omolaterali rilevate con biopsia del linfonodo sentinella ma
non clinicamente rilevabili
pN1mi Micrometastasi (di dimensioni superiori a 0,2 mm e/o più di
200 cellule, ma non più grandi di 2 mm)
pN1a
Metastasi in 1-3 linfonodi ascellari, includendo almeno una
metastasi delle dimensioni massime superiori a 2 mm
pN1b
Metastasi nei linfonodi mammari interni con metastasi
microscopiche o macroscopiche rilevate con la biopsia del
linfonodo sentinella ma non clinicamente rilevabili
pN1c
Metastasi in 1-3 linfonodi ascellari e nei linfonodi mammari
interni con metastasi microscopiche o macroscopiche
rilevate con la biopsia del linfonodo sentinella ma non
clinicamente rilevabili
pN2:
Come descritto di seguito:
pN2a
Metastasi in 4-9 linfonodi ascellari, includendo almeno una
localizzazione tumorale delle dimensioni massime superiori
a 2 mm
pN2b
Metastasi clinicamente rilevabili nei linfonodi mammari
interni in assenza di metastasi nei linfonodi ascellari
pN3
Come descritto di seguito:
pN3a
Metastasi in 10 o più linfonodi ascellari omolaterali (almeno
uno delle dimensioni massime superiori a 2 mm); o metastasi
nei linfonodi sottoclavicolari (linfonodi ascellari III livello)
pN3b
Metastasi clinicamente rilevabili nei linfonodi mammari
interni omolaterali in presenza di metastasi in uno o
più linfonodi ascellari positivi; o metastasi in più di tre
linfonodi ascellari e nei linfonodi mammari interni con
metastasi microscopiche o macroscopiche rilevate
attraverso biopsia del linfonodo sentinella ma non
clinicamente rilevabili
pN3c
Metastasi nei linfonodi sovraclaveari omolaterali
ITC: cellule tumorali isolate; RT-PCR: real time-polymerase chain reaction.
Modificata da: American Joint Committee on Cancer. AJCC Cancer Staging Manual.
7th ed. New York, NY, Springer-Verlag, 2010.
associata a un nodulo clinicamente rilevabile in un qualsiasi
quadrante o con componente invasiva all’esame patologico
si classifica in base alle dimensioni del nodulo o della componente invasiva. Per estensione alla parete toracica si intende
l’infiltrazione di coste, muscoli intercostali e/o muscolo dentato anteriore, ma non dei muscoli pettorali. La sola invasione
del derma non permette la classificazione del tumore come T4.
I linfonodi ascellari, mammari interni e sovraclaveari omolaterali sono considerati linfonodi locoregionali, essendo i
primi a essere interessati dal processo di metastatizzazione
(Fig. 8.15). Le metastasi in altri linfonodi, compresi quelli
cervicali e mammari interni controlaterali, sono considerate metastasi a distanza. La diffusione ai linfonodi regionali
è possibile anche per via ematica.
L’esame obiettivo del cavo ascellare è difficile, scarsamente
sensibile e poco specifico. Il valore predittivo positivo della
palpazione clinica si aggira tra il 61% e l’84%, mentre il
valore predittivo negativo non supera il 60% (De Freitas
et al., 1991; Lanng et al., 2007; Vaidya et al., 1996). La
stadiazione linfonodale patologica è quindi necessaria,
salvo in rari casi di donne anziane con tumori inferiori ai
2 cm di diametro e recettori ormonali espressi che possono
iniziare trattamento adiuvante ormonale senza biopsia
linfonodale.
La prima priorità nella valutazione dei linfonodi è identificare le macrometastasi (>2,0 mm). Le cellule tumorali isolate
(ITC) sono singole cellule o piccoli raggruppamenti (cluster)
non superiori a 0,2 mm, di solito identificate solo mediante
immunoistochimica o tecniche di indagine molecolare me-
Linfonodi sovraclaveari
III livello: linfonodi ascellari alti,
apicali, intraclaveari
Muscolo piccolo
pettorale
Linfonodi
della catena
mammaria
interna
I livello: linfonodi
ascellari bassi
II livello:
linfonodi
ascellari medi
FIG. 8.15 Stazioni di drenaggio linfonodale. Da Edge SB, Byrd DR, Compton
CC et al. American Joint Committee on Cancer: AJCC Cancer Staging Manual. 7th
ed. Springer-Verlag, New York, NY, 2010.
Ca pito l o 8
diante RT-PCR (reverse trascriptase-polymerase chain reaction).
I linfonodi contenenti solo ITC sono esclusi dalla conta
totale dei linfonodi positivi ai fini della classificazione N.
Il 15% dei linfonodi giudicati negativi all’esame istologico
di routine sono in realtà già metastatici se analizzati più
accuratamente o mediante tecniche di immunoistochimica
o di indagine molecolare (Fitzgibbons et al., 2000).
Con la definizione “clinicamente apparente” si intende
l’identificazione di linfonodi metastatici mediante indagini
radiologiche (linfoscintigrafia esclusa), valutazione clinica
o esame patologico macroscopico.
Le sedi più comuni di metastasi per via ematica sono, in
ordine di frequenza, ossa, polmoni, fegato ed encefalo. Siti
inusuali di metastasi (peritoneo, pleura, tratto gastroenterico e organi riproduttivi) si osservano più di frequente nel
carcinoma lobulare. Depositi di cellule tumorali evidenziati
inavvertitamente mediante biologia molecolare o microscopicamente nel sangue, midollo osseo o in altri tessuti diversi
dai linfonodi regionali, di dimensioni non superiori a 0,2
mm in una paziente senza evidenza clinica o radiologica di
metastasi a distanza vengono registrati come cM0(i+). Essi
non definiscono, da soli, uno stato metastatico sebbene appaiano correlarsi a rischio di recidiva e di morte aumentati.
Dalla definizione dei caratteri T, N e M deriva lo stadio
di malattia secondo la categorizzazione AJCC/UICC stage
grouping (Tab. 8.11).
Riassumendo, l’iter diagnostico e di stadiazione del carcinoma invasivo deve includere: storia ed esame obiettivo,
emocromo, test di funzionalità epatica, mammografia
diagnostica bilaterale (ecografia mammaria se necessaria),
determinazione di ER e PgR, stato di HER2.
TABELLA 8.11 Suddivisione in stadi secondo l’AJCC/
UICC stage grouping
Stadio
T
N
M
0
Tis
N0
M0
IA
T1
N0
M0
IB
T0, T1
N1mi
M0
IIA
T0
T1
T2
N1
N1
N0
M0
M0
M0
IIB
T2
T3
N1
N0
M0
M0
IIIA
T0
T1
T2
T3
T3
N2
N2
N2
N1
N2
M0
M0
M0
M0
M0
IIIB
T4
T4
T4
N0
N1
N2
M0
M0
M0
IIIC
Qualsiasi T
N3
M0
IV
Qualsiasi T
Qualsiasi N
M1
Modificata da: American Joint Committee on Cancer. AJCC Cancer Staging Manual.
7th ed. New York, NY, Springer-Verlag, 2010.
N e o p lasi e della mammella
La consulenza genetica è raccomandata se sussistono i
criteri per ipotizzare un rischio su base eredofamiliare.
Per la stadiazione delle pazienti in stadio I e II che presentano segni e sintomi suggestivi di localizzazioni ossee, addominali o toraciche (per esempio, dolore, test di
laboratorio alterati, sintomi respiratori) e delle donne in
stadio clinico T3 N1 M0 si dovrebbero prendere in considerazione, anche scintigrafia ossea, TC torace-addome,
ecografia o RM addome.
Queste raccomandazioni sono supportate da uno studio
che valuta pazienti con nuova diagnosi di carcinoma mammario, con scintigrafia ossea, ecografia epatica e radiografia
del torace. La scintigrafia ossea ha dimostrato di identificare
le metastasi nel 5,1%, 5,6% e nel 14% delle pazienti in
stadio I, II e III rispettivamente, mentre ecografia epatica o
radiografia del torace non evidenzia metastasi in pazienti
con stadio patologico I o II (Puglisi et al., 2005a).
Sempre per le pazienti in stadio I, II e T3 N1, infine, è
sconsigliato l’uso della PET. A supporto di ciò vi sta la bassa
probabilità, per queste donne, di avere malattia metastatica
evidenziabile dalla PET (troppi sono, infatti, i falsi positivi)
e il fatto che tale metodica è gravata da un alto numero di
falsi negativi per quanto riguarda il ritrovamento di lesioni
piccole (<1 cm) e/o di basso grado, e dalla bassa sensibilità nel ritrovare noduli ascellari metastatici (Kumar et al.,
2006; Wahl et al., 2004; Podoloff et al., 2007; Carr, et al.,
2006; Khan et al., 2007; Rosen et al., 2007).
Per quanto riguarda l’uso dei marcatori tumorali l’evidenza a sostenere la loro utilità è molto scarsa (Harris et al.,
2007). Pur essendo un esame semplice e poco costoso, la
loro valutazione ripetitiva, se non motivata da evidenze
cliniche, contribuisce al rialzo della spesa e al sovraccarico
laboratoristico. Durante la fase di follow-up attivo, l’utilizzo routinario dei marcatori tumorali sierici è addirittura
sconsigliato data la limitata specificità e sensibilità (Kokko
et al., 2002). CA 15.3 e CEA sono elevati nel 40% e 80%,
rispettivamente, dei tumori mammari avanzati. Alcuni
studi hanno dimostrato l’associazione tra l’elevazione dei
marcatori tumorali e il numero di siti metastatici, carico
di malattia e sopravvivenza. Il loro utilizzo può quindi
trovare spazio nella gestione del paziente con malattia
metastatica (Guadagni et al., 2001; Tondini et al., 1988;
Lauro et al., 1999; Molina et al., 1998).
FATTORI PROGNOSTICI E PREDITTIVI
Il fattore prognostico è una variabile misurabile, legata al
tumore o alla paziente, che correla con la storia naturale
della malattia. Il fattore predittivo rappresenta il marcatore
di risposta a una data terapia. In altre parole, il fattore predittivo influenza la prognosi in presenza di un trattamento
specifico e identifica la categoria di pazienti che con maggior probabilità trarrà giovamento da quel trattamento.
La valutazione di entrambi è parte integrante del processo decisionale nella cura della paziente con carcinoma
mammario.
I vari fattori, in studio per la loro validità prognostica e/o
predittiva, sono classificati in categorie in base al grado di
evidenza che li supporta:
267
268
Capitolo 8
●
●
●
Neo p la sie d ella m a m m ella
categoria I (fattori di provata importanza prognostica):
dimensioni del tumore, interessamento linfonodale,
istotipo, grado istologico, stato dei recettori ormonali;
categoria II (fattori studiati estensivamente ma non
validati formalmente): stato di HER2, MIB1/Ki67, invasione vascolare peritumorale;
categoria III (fattori il cui valore prognostico non è
provato): per esempio, stato di EGFR, aneuploidia del
DNA, pS2, catepsina D (Fitzgibbons et al., 2000).
La dimensione tumorale, determinata dal patologo (pT),
è uno dei fattori prognostici più potenti. Il suo valore è
direttamente proporzionale alla frequenza di metastasi
linfonodali (10-20% se <1,0 cm, 40% se >2,0 cm) e inversamente proporzionale alla speranza di sopravvivenza. È
difficile comunque definire un valore soglia al di sotto del
quale il fattore può essere considerato buono (a eccezione
dei tumori molto piccoli, pT1a). Lo stesso dicasi per il numero di linfonodi ascellari interessati. Il 70% dei pazienti
con coinvolgimento linfonodale svilupperà una recidiva
di malattia a 10 anni contro il 15-30% dei soggetti con
linfonodi negativi. La gravità dell’outcome è proporzionale al numero di linfonodi positivi e peggiora se sono
coinvolti linfonodi di apice o catena mammaria interna
(Singletary et al., 2002). La presenza di cellule isolate o
di micrometastasi nei linfonodi regionali si associa a una
peggiore sopravvivenza libera da malattia in assenza di
terapie adiuvanti (De Boer et al., 2009).
Il fatto che la maggior parte dei tumori mammari (6070%) non presenti caratteristiche specifiche rende limitata l’applicazione della tipizzazione istologica nella
gestione del paziente. A ogni modo il tipo istologico
può fornire informazioni sul comportamento biologico
della malattia. Per esempio, il tipo lobulare, rispetto al
duttale, dimostra più frequentemente espressione dei
recettori ormonali e presenta pattern insolito di metastatizzazione a retroperitoneo e superfici sierose. Inoltre,
gli istotipi tubulare, mucinoso e papillare (midollare,
adenoidocistico e apocrino in assenza di interessamento
linfonodale e altri segni di aumentato rischio metastatico) si accompagnano a prognosi favorevole (Rakha
et al., 2008).
La positività per ER (Fig. 8.16) e/o PgR (Fig. 8.17) identifica una patologia con potenziale endocrino-responsività. Il
tasso di risposta dei tumori positivi per i recettori ormonali
è del 60%, mentre quello dei tumori negativi è inferiore al
10%. Tumori che esprimono solo ER ma non PgR hanno
un tasso di risposta intermedio pari a circa il 40% (Tavassoli e Devilee, 2003). A predire ulteriormente la risposta alla
terapia ormonale in pazienti con recettori positivi vi sono:
lungo intervallo libero da malattia, metastasi ossee isolate
o coinvolgimento dei tessuti molli e risposta a precedenti
terapie ormonali (Santen et al., 1990).
Fattore prognostico e predittivo altrettanto rilevante è lo
stato di HER2. HER2 è una glicoproteina transmembrana
di 185 kDa, codificata dal proto-oncogene HER2/neu mappato sul cromosoma 17q21 (Akiyama et al., 1986). Essa
appartiene a una famiglia di recettori transmembrana con
attività tirosinchinasica insieme a HER1 (EGFR), HER3
(erbB3) e HER4 (erbB4). I recettori HER sono coinvolti
nella regolazione di diversi processi cellulari, quali il controllo della crescita cellulare, la sopravvivenza, la differen-
FIG. 8.16 Espressione della positività nucleare per il recettore estrogenico.
Il grado istologico elevato, G3, è considerato fattore prognostico sfavorevole a differenza di G1, favorevole. Per G2
la questione è più incerta: l’analisi genica, si è visto, tende a
riclassificarlo o come G1 o come G3 (Sotiriou et al., 2006).
L’importanza dello stato recettoriale ormonale è consolidata sul versante sia prognostico sia predittivo. Il 65% dei
tumori mammari presenta positività per i recettori degli
estrogeni e del progesterone, 10% è ER+/PgR!, 5% è ER!/
PgR!, 25% rimane ignoto (Puglisi e Minisini, 2011). La
valutazione dello stato recettoriale è eseguita in immunoistochimica (Mohsin et al., 2004; Hammond et al., 2010). I
recettori ormonali, quando espressi, hanno valenza positiva sul fronte prognostico. A tal proposito è da specificare
che, sebbene in passato sia stato utilizzato il cut-off point
10% per definire la positività dei recettori ormonali, oggi si ritiene che la presenza di un’espressione anche solo
dell’1% sia sufficiente per caratterizzare i tumori come ER
e/o PgR positivi.
FIG. 8.17 Espressione della positività nucleare per il recettore progestinico.
Ca pito l o 8
N e o p lasi e della mammella
Lo stato di HER2 viene definito sulla base dell’amplificazione del gene HER2/neu tramite tecnica FISH (Fig. 8.18)
o tramite quantificazione (Fig. 8.19), in analisi immunoistochimica, del recettore HER2 nella superficie cellulare
(Fig. 8.20). L’amplificazione genica o l’iperespressione
del recettore HER2 interessa circa il 15-25% dei carcinomi
infiltranti della mammella (Ross et al., 2009).
mento linfonodale all’esordio. Essi si caratterizzano per un
comportamento clinico maggiormente aggressivo. Tuttavia,
l’introduzione di trastuzumab, il primo anticorpo monoclonale umanizzato approvato per uso terapeutico e il primo
presidio diretto contro il dominio extracellulare di HER2,
ha drasticamente cambiato in senso favorevole la prognosi
delle donne con carcinoma mammario HER2 positivo (Puglisi e Piccart, 2005b). HER2 assume quindi un significato
predittivo di beneficio terapeutico dai farmaci anti-HER2.
I tumori HER2 positivi sono più frequentemente ad alto grado, presentano elevato indice mitotico e coinvolgi-
A oggi, l’espressione dei recettori ormonali e l’amplificazione di HER2 sono gli unici fattori validati formalmente
FIG. 8.18 Amplificazione, in analisi FISH, del gene HER2/neu.
FIG. 8.19 Iperespressione, in analisi immunoistochimica, del recettore HER2
nella superficie cellulare.
ziazione, l’adesione e la migrazione cellulare (Yarden e
Sliwkowski, 2001; Park et al., 2008; Yarden, 2001).
Analisi
con IHC
Il laboratorio
assicura
gli standard
di qualità
per l’analisi
in IHC
di HER2
Inviare a un laboratorio competente
No
Sì
Richiedere
analisi
IHC
No
Analisi
con FISH
IHC 0 v 1+
HER2 neg
IHC 2+
Bordeline
IHC 3+
HER2 pos
Richiedere
analisi FISH
Inviare a un laboratorio competente
Il laboratorio
assicura
gli standard
di qualità
per l’analisi
in FISH
di HER2
FISH (–)
HER2 neg
Eseguire IHC
Sì
Richiedere
analisi
FISH
Bordeline
FISH (+)
Rieseguire FISH
HER2 neg
Conta cellulare
addizionale
Bordeline
HER2 pos
HER2 pos
FIG. 8.20 Principi di valutazione dello stato di HER2. IHC: immunoistochimica; FISH: fluorescence in situ hybridization; pos: positivo; neg: negativo.
269
270
Capitolo 8
Neo p la sie d ella m a m m ella
come variabili predittive e la loro valutazione complessiva
è decisiva nella scelta dell’approccio terapeutico. L’esistenza di cross-talk tra le vie di ER e della famiglia dei recettori
ErbB, di cui fa parte anche HER2 spiega, per esempio,
perché le pazienti con neoplasie che esprimono i recettori
per gli estrogeni, il progesterone e anche HER2, anche detti
“triple positive”, rispondono poco alla sola terapia ormonale
(Shou et al., 2004).
Un altro fattore ampiamente analizzato in termini di valenza prognostica e predittiva è Ki67. Ki67/MIB1 è una
proteina nucleare espressa dalle cellule in fase di attiva
proliferazione. Dei diversi anticorpi monoclonali studiati
per misurarne l’espressione, solo MIB1 ha saputo evidenziare una proporzione inversa tra l’espressione di Ki67 e la
sopravvivenza (Brown et al., 1996; Gaglia et al., 1994). Il
valore soglia di Ki67, individuato all’immunoistochimica,
per affermare l’alta o bassa attività proliferativa è pari al
14% (Cheang et al., 2009). La positività di Ki67/MIB1 si
associa a prognosi peggiore ma, pur suggerendo una maggiore sensibilità alla chemioterapia, non ha dimostrato
valenza predittiva (De Azambuja et al., 2007).
L’invasione vascolare peritumorale costituirebbe un fattore
prognostico negativo, aumentando del 15% il rischio di
recidiva in 5 anni e diminuendo la sopravvivenza (Neville
et al., 1992; Lauria et al., 1995).
EGFR o HER1 è un recettore transmembrana glicoproteico
appartenente alla famiglia dei geni ErbB che può legare sia
l’epidermal growth factor receptor (EGFR) sia il transforming
growth factor- (TGF- ). È un proto-oncogene particolarmente potente la cui alterazione potrebbe configurarsi
come un fattore prognostico negativo.
Per quanto riguarda la neoangiogenesi, il fattore di crescita
VEGF (vascular endothelial growth factor) e i suoi recettori specifici e l’enzima timidina fosforilasi (TP) hanno un comprovato effetto pro-angiogenico. Alcuni studi evidenziano come
siano correlati a un aumento di probabilità di sviluppare
metastasi a distanza (Toi et al., 2005). Timidina fosforilasi
è spesso indotta nel microambiente tumorale da stimoli
fisiologici e chimici. Tale induzione enzimatica protegge le
cellule dall’apoptosi e favorisce la sopravvivenza cellulare,
stimolando il metabolismo nucleotidico e l’angiogenesi.
L’attività di TP è fondamentale nel metabolismo della capecitabina, rappresentando l’ultimo enzima necessario alla
sua trasformazione nella forma attiva (5-fluorouracile). La
concentrazione di TP è dunque correlata alla risposta alle
fluoropirimidine e la sua identificazione può selezionare
pazienti che presumibilmente beneficiano della capecitabina. Ciò suggerirebbe, per TP, un ruolo predittivo di risposta
a capecitabina (Bonotto et al., 2013).
Quando si fa riferimento all’aneuploidia del DNA si intende un contenuto anormale di DNA nel nucleo cellulare. Il
suo valore prognostico rimane tuttora largamente dibattuto (Hedley et al., 1993).
Il gene TP53 codifica per un fattore di trascrizione che regola il ciclo cellulare e ricopre la funzione di soppressore tumorale. La sua mutazione avrebbe significato sfavorevole.
PS2 è una proteina citoplasmatica la cui trascrizione è
estrogeno-regolata. Tendenzialmente è espressa in tumori
ben differenziati e sarebbe un indicatore sia prognostico
positivo sia predittivo di buona risposta al tamoxifene
(Thompson et al., 1993).
La catepsina D è una endoproteasi lisosomiale che pare
facilitare la metastatizzazione tumorale (Spyratos et al.,
1989).
L’inadeguatezza dei fattori prognostici singoli finora studiati ha, recentemente, concentrato la ricerca sull’individuazione di marcatori prognostici/predittivi multiparametrici; tra questi stanno acquisendo grande popolarità le
cosiddette firme genetiche. Per firma genetica (dal termine
anglosassone “gene signature”) si intende una serie di geni il cui pattern combinato di espressione sia correlato,
come una “firma” di aggressività biologica del tumore,
alla prognosi e/o alla risposta ai trattamenti. L’identificazione dei geni che compongono una “signature” avviene
attraverso metodiche complesse che, in alcuni casi, hanno
condotto alla produzione commerciale di test disponibili
nella pratica clinica routinaria. Le firme genetiche per carcinoma mammario disponibili commercialmente sono,
attualmente, quattro. Le caratteristiche principali di queste signature sono riportate in Tab. 8.12. Tra queste, due
sono quelle più popolari e meglio validate: Mammaprint
e Oncotype DX.
Mammaprint è una firma a 70 geni la cui identificazione
parte da un’analisi dell’espressione praticamente dell’intero genoma del tumore (“genome-wide” analysis) con la tecnologia di “DNA microarray chip”. Questa tecnica consente
di sviluppare una mappa visuale (heat map) dell’espressione dei singoli geni attraverso la lettura automatizzata della
fluorescenza emessa sui singoli pozzetti del chip durante
la stimolazione con un laser. Il colore della fluorescenza
(in genere rosso, per l’iperespressione) e l’intensità della
stessa fluorescenza forniscono una stima dell’espressione
del gene stesso. A partire da questa mappa genome-wide, si
è ridotta la complessità e la ridondanza dei dati attraverso
procedimenti di clusterizzazione statistica. Ciò ha consentito di ridurre il numero di geni potenzialmente utili
ad alcune centinaia. Successivamente, si è cercato di individuare quelli realmente informativi attraverso complesse
correlazioni statistiche con la prognosi di pazienti note,
fino all’identificazione dei 70 geni che fanno parte del test
commerciale. Il risultato del test consiste nella classificazione delle pazienti in due gruppi (basso e alto rischio) (Van
de Vijver et al., 2002). Uno degli svantaggi di tale test è la
necessità di un campione di tessuto fresco congelato. Non
è, pertanto, effettuabile quando questo campione non sia
stato conservato all’atto dell’intervento chirurgico (cosa
che non viene, di regola, effettuata routinariamente), in
particolare quando l’oncologo decida “a posteriori” che
è necessario ricorrere alle informazioni “genetiche” dopo
aver giudicato insoddisfacenti le informazioni derivate
dall’analisi standard (istologia + immunoistochimica) del
campione istologico. Recentemente, tuttavia, una versione
di Mammaprint per campioni inclusi in paraffina ha iniziato il processo di validazione clinica.
Oncotype DX è una firma a 21 geni. Per lo sviluppo di
questa firma si è partiti da un gruppo più ampio di geni
“candidati” (“candidate gene” approach) la cui selezione
è stata fatta in base alle conoscenze più aggiornate sulla
Ca pito l o 8
N e o p lasi e della mammella
TABELLA 8.12
Nome commerciale
Oncotype DX
Mammaprint
Theros
MapQuant DX
Azienda
Genomic Health
Agendia
Biotheranostics
Ipsogen
Tipo di test
Q-RT-PCR
DNA microarrays
Q-RT-PCR
DNA microarrays
Tipo di campione
tissutale
Incluso in paraffina
Fresco o congelato
Incluso in paraffina
Fresco o congelato
Indicazione
Per predire il rischio
di recidiva in pazienti ER+Ntrattate con tamoxifene
e per identificare
le pazienti a basso rischio
che non necessitano
di chemioterapia
Per aiutare la valutazione
prognostica in pazienti
<61 anni in stadio I o II,
N-, con tumore ≤5 cm
Per stratificare pazienti
con tumore ER+ in gruppi
a basso o ad alto rischio
di recidiva e per predire
una buona o cattiva
risposta al trattamento
endocrino
Per stratificare
ulteriormente i tumori
ER+ con grado istologico
G2 in tumori a basso
rischio G1 (Genomic
Grade) o ad alto rischio
G3 (Genomic Grade)
Livello di evidenza*
II
III
III
III
Laboratorio
centralizzato^
certificato
Si
Si
Si
Si
ER: recettore per strogeni; Q-RT-PCR: quantitative reverse-transcriptase-polymerase chain reaction
* I livelli di evidenza sono misurati su una scala che va da I (massimo livello di evidenza) a V (minimo livello di evidenza)
^ I Laboratori sono stati certificati in base ai criteri del Clinical Laboratory Improvement Amendments o dell’International Organization for Standardization
Modificata da: Sotiriou & Pusztai. New England J Med 2009.
biologia del tumore e sulla funzione di determinate molecole ritenute coinvolte nella progressione e aggressività
del tumore e/o nella sviluppo di resistenza ai trattamenti.
Attraverso una complessa analisi statistica si è giunti alla
selezione dei 21 geni rilevanti e si è, quindi, sviluppato un
algoritmo matematico che correli il pattern di espressione
di questi con la prognosi (Paik et al., 2004). La valutazione
dell’espressione di tali geni è effettuata con real-time PCR,
una metodica più semplice rispetto ai gene-chip, ma, proprio per questo, più affidabile e riproducibile. Inoltre, il
dosaggio dei geni può essere effettuato su campioni inclusi
in paraffina, consentendo, pertanto, al clinico di scegliere “a posteriori” quei casi in cui l’informazione genetica
possa essere utile per la decisione terapeutica. Un ulteriore
vantaggio del test è che il risultato è espresso in forma di
un indice continuo (recurrence score, RS) che fornisce una
stima quantitativa diretta della probabilità di recidiva della
paziente. Tuttavia, per semplicità, è possibile classificare le
pazienti in base al risultato del test in tre gruppi di rischio
(basso, medio e alto) sulla base di soglie predefinite di RS.
Una delle caratteristiche più interessanti di entrambe le firme
(Mammaprint e Oncotype DX) è che, per quanto sviluppate
a scopo prognostico, esse sembrerebbero poter predire la
sensibilità del tumore alla chemioterapia. In particolare, con
ciascuna delle due firme i tumori classificabili come a basso
rischio sembrerebbero scarsamente sensibili alla chemioterapia. Questi dati necessitano, comunque, di altre conferme.
Il principale svantaggio delle firme genetiche è il loro costo
elevato. Inoltre, in quanto metodiche complesse, l’analisi
del campione può essere effettuata solo presso un singolo
laboratorio di riferimento centralizzato a cui i campioni
vanno inviati. Tuttavia, questo garantisce un’affidabilità e
una riproducibilità molto superiore a quella delle indagini
immunoistochimiche routinarie e un’elevatissima affidabilità prognostica. Tuttavia, per quanto estremamente
promettenti, il reale valore aggiunto di tali test in termini di
ottimizzazione della strategia terapeutica è ancora in corso
di validazione clinica nell’ambito di grosse sperimentazioni randomizzate. Al momento, pertanto, si raccomanda
di utilizzare queste firme solo quando, dopo un’adeguata valutazione delle informazioni immunoistochimiche
tradizionali (ER, PgR, HER2, Ki67) rimanga ancora un
ragionevole grado di incertezza sull’impostazione della
strategia terapeutica (Goldhirsch et al., 2011).
TERAPIA DELLA MALATTIA INIZIALE
Rientrano nella definizione di malattia iniziale (early breast
cancer, EBC) i carcinomi in situ e i carcinomi invasivi in
stadio I-II e III operabile.
CARCINOMA DUTTALE IN SITU
Il carcinoma duttale in situ (DCIS) o carcinoma intraduttale è una lesione proliferativa originantesi nei dotti della
ghiandola mammaria, caratterizzata da un grado variabile
di atipia, ma senza segni di estensione extraduttale. Essendo una neoplasia non invasiva è, teoricamente, priva di
capacità metastatizzante. Tuttavia, il DCIS ha un’elevata
probabilità di evolvere verso una forma invasiva di cui è
considerato un precursore. A causa di ciò, il DCIS va sempre trattato con lo scopo di prevenirne l’evoluzione verso
un carcinoma invasivo della mammella.
Il cardine del trattamento del DCIS è l’asportazione chirurgica della lesione. Il DCIS tende a essere multifocale
e, pertanto, il trattamento deve tener conto di questo. In
particolare:
●
in presenza di segni clinico-strumentali di malattia
diffusa in diversi quadranti, il trattamento di elezione
è la mastectomia semplice senza asportazione dei linfonodi ascellari;
271
272
Capitolo 8
●
●
Neo p la sie d ella m a m m ella
in presenza di malattia clinicamente più limitata, sia la
mastectomia semplice, sia la chirurgia conservativa
(quadrantectomia o tumorectomia) seguita da radioterapia sul parenchima residuo sono valide opzioni, purché sia possibile ottenere margini di escissione
liberi microscopicamente da malattia e adeguati (si
veda oltre). In questo caso, una radiografia del campione chirurgico è consigliabile per assicurarsi che la
massa e/o le eventuali microcalcificazioni siano tutte
completamente escisse;
dopo trattamento locale è consigliabile un terapia adiuvante con tamoxifene, soprattutto in presenza di DCIS
con espressione dei recettori per estrogeni.
sviluppato uno score multivariato, il cosiddetto Van Nuys
Score, che integra tutti i fattori prognostici principali e che
ha mostrato un’ottima capacità prognostica (Silverstein et
al., 2003) (Tab. 8.13), consentendo di classificare il DCIS
in tre diverse categorie di rischio. Gli stessi Autori hanno
anche suggerito di indirizzare alla mastectomia i DCIS ad
alto rischio, all’escissione conservativa seguita da radioterapia i DCIS di categoria intermedia, e di limitare il trattamento alla semplice escissione conservativa per i DCIS a
basso rischio. Questo approccio, tuttavia, non ha trovato
unanime accettazione nella pratica clinica. Recentemente, è
stato sviluppato una variante del test Oncotype DX (firma
genetica a 21 geni per il carcinoma mammario invasivo
endocrino-responsivo) che, impiegando un sottogruppo
di 12 dei 21 geni originari, è in grado di predire in maniera
accurata il rischio di recidiva locale dei DCIS (Solin et al.,
2013). Se i risultati dovessero essere ulteriormente validati,
questo test potrebbe essere di utilità nell’individuare le pazienti che non necessitano di radioterapia postchirurgica.
Per quanto apparentemente semplice nel principio, il
trattamento del DCIS presenta numerosi aspetti ancora
controversi.
Per esempio, non esiste ancora accordo unanime sulla
definizione di adeguatezza dei margini. In linea generale,
sono considerati sicuramente adeguati margini liberi 10
mm, mentre certamente inadeguati i margini <1 mm. Non
esiste, invece accordo sull’adeguatezza dei margini tra 1 e
9 mm.
Sempre in termini di terapia locoregionale, alcuni Autori
suggeriscono di effettuare la biopsia del linfonodo sentinella (BLS) a tutte le pazienti che ricevono una mastectomia o un’escissione conservativa di alcune specifiche
aree (come la coda ascellare della mammella). In queste
situazioni, infatti, un’eventuale BLS successiva sarebbe scarsamente affidabile. Secondo questi Autori, la necessità di
una BLS di principio non è da collegarsi tanto alla biologia
del DCIS, che, teoricamente, non dovrebbe dare metastasi,
quanto dalla possibilità che, soprattutto nei DCIS di grandi dimensioni, eventuali focolai di carcinoma invasivo si
rendano evidenti solo all’esame istologico definitivo.
Un altro aspetto controverso riguarda la necessità di aggiungere sempre una radioterapia dopo un trattamento
chirurgico conservativo. È infatti chiaro che la radioterapia
postchirurgica riduce di circa il 50% il rischio di recidive
locali, ma non ha nessun impatto dimostrato sulla sopravvivenza. Tuttavia, la radioterapia espone al rischio di
rari effetti collaterali e può peggiorare il risultato estetico;
inoltre, rende impraticabile una successiva irradiazione in
caso di sviluppo di tumore invasivo ipsilaterale. Diversi
studi suggeriscono che pazienti selezionate a basso rischio
possano evitare la radioterapia dopo chirurgia conservativa
(Silverstein et al., 2003; Di Saverio et al., 2008; Hughes
et al., 2009). Non vi è accordo unanime, comunque, sulla
definizione di DCIS a basso rischio. Alcuni clinici, infatti,
definiscono il rischio di recidiva semplicemente in base
all’aspetto istologico del DCIS, con un alto rischio identificato dalla presenza di un alto grado nucleare (G3) o
dalla presenza di comedo-necrosi. È comunque chiaro
che il rischio di recidiva sia legato anche ad altri fattori,
quali: l’adeguatezza dei margini di resezione, l’età della
paziente, la grandezza del DCIS. Silverstein et al. hanno
L’ultimo aspetto controverso riguarda la terapia con tamoxifene, che viene in genere raccomandata nelle donne
con DCIS ER-positivo che ricevono un trattamento locale
conservativo più radioterapia. Anche se ampiamente impiegato, non esistono, invece, chiari dati a supporto del
suo impiego nelle donne che ricevono la mastectomia.
Inoltre, la sua utilità nei DCIS ER-negativi è sconosciuta.
CARCINOMA LOBULARE IN SITU
Il carcinoma lobulare in situ (LCIS) è una lesione proliferativa coinvolgente un’unità lobulare, che appare ripiena,
nella sua variane di LCIS classico, di cellule prevalentemente monomorfe, che distorcono il lobulo, ma non infiltrano
TABELLA 8.13
Score
1
2
3
Dimensioni (mm)
<15
16-40
>41
Margini (mm)
>10
1-9
<1
Classificazione patologica
Non alto grado,
senza necrosi
Non alto grado,
con necrosi
Alto grado
Età (anni)
≥61
40-60
≤39
Da uno a tre punti sono assegnati per ciascuno dei 4 differenti parametri predittivi di recidiva locale (dimensioni, ampiezza dei margini, classificazione patologica ed età).
I valori sono, quindi, sommati per produrre lo USC/VNPI score (da un minimo di 4 a un massimo di 12).
Modificata da: Silverstein & Buchanan, The Breast 2003.
Ca pito l o 8
lo stroma. A differenza del DCIS, il LCIS non è considerato
un precursore del carcinoma invasivo, ma solo un fattore
di rischio e, come tale, non richiede escissione chirurgica
in caso di riscontro occasionale di un LCIS su una biopsia.
Recentemente, è stata descritta una variabile pleomorfa
del LCIS. Questa variante sembrerebbe maggiormente
propensa all’evoluzione verso un carcinoma invasivo e il
suo eventuale trattamento rimane controverso.
CARCINOMA INVASIVO
Negli ultimi decenni si è avuta una progressiva evoluzione
delle tecniche chirurgiche, che sono progressivamente diventate meno aggressive e invasive. Questo cambiamento
è stato indotto dalla parallela evoluzione delle conoscenze
biologiche, che hanno consentito di capire che il carcinoma
della mammella va considerato una malattia sistemica ab
initio, per il rischio che eventuali micrometastasi sistemiche siano già presenti al momento della diagnosi. In una
situazione del genere, la prognosi è soprattutto influenzata
dall’impiego di un’efficace terapia sistemica adiuvante, mentre l’impiego di terapie locali aggressive si traduce solamente
in un danno estetico e funzionale. L’approccio moderno,
infatti, consiste proprio nel minimizzare l’aggressione locale
puntando a preservare, quanto più possibile, l’estetica e la
funzione, senza compromettere i risultati terapeutici. Per
tale motivo, il trattamento ottimale del cancro mammario
precoce (EBC) richiede un approccio multidisciplinare, con
un’integrazione delle competenze del chirurgo senologo, del
radioterapista, dell’oncologo, dell’anatomopatologo e dello
specialista in diagnostica per immagini senologica.
Terapia locoregionale
Terapia chirurgica
Il trattamento chirurgico, coadiuvato o meno dalla radioterapia, rappresenta il cardine della terapia locoregionale
della mammella e comprende due atti complementari: la
resezione del tumore primitivo e lo staging ascellare.
Resezione del tumore primitivo
Sono possibili tre diversi approcci chirurgici: la chirurgia
conservativa seguita da radioterapia, la mastectomia e la
mastectomia con ricostruzione. Sei studi randomizzati, e
una metanalisi degli stessi, hanno dimostrato che non vi
sono sostanziali differenze in termini di sopravvivenza tra
la chirurgia conservativa e la mastectomia (Morris et al.,
1997). Pertanto, la scelta ottimale del tipo di intervento
dipende esclusivamente dalla possibilità di ottenere un
buon risultato cosmetico, una volta effettuata una rimozione adeguata della lesione principale e di eventuali focolai
circostanti. Quando questo obiettivo non è perseguibile, la
mastectomia con ricostruzione dovrebbe essere l’opzione
chirurgica di scelta, a meno che la paziente non sia fortemente orientata verso la conservazione di parte del seno,
anche a rischio di un risultato cosmetico non soddisfacente. In linea generale, i fattori che orientano il chirurgo nella
scelta sono rappresentati da: localizzazione della lesione,
rapporto dimensioni tumore/dimensioni della mammella,
caratteristiche mammografiche, preferenze della paziente.
Nei casi in cui l’unico elemento che orienti verso una mastectomia sia il rapporto tra la dimensione del tumore e la
N e o p lasi e della mammella
dimensione della mammella (cioè, un tumore relativamente grande rispetto alle dimensioni del seno), e se la paziente
appare motivata alla conservazione del seno, è possibile
optare per un terapia sistemica primaria o neoadiuvante
(in genere: chemioterapia ± terapia a bersaglio molecolare)
con lo scopo di ridurre la neoplasia e permettere, quindi,
un intervento conservativo. La scelta del tipo di terapia
neoadiuvante da impiegare segue, in questo caso, gli stessi
principi che ispirano il trattamento dei tumori localmente
avanzati e che saranno discussi di seguito (vedi paragrafo
“ Terapia della malattia localmente avanzata”).
Alcune condizioni rappresentano delle controindicazioni
relative alla chirurgia conservativa. Queste includono:
●
●
●
●
●
impossibilità di accedere a un centro di radioterapia
per problemi logistici;
condizioni fisiche generali o psichiche della paziente
compromesse;
presenza di microcalcificazioni diffuse, sospette o maligne;
tumori multicentrici;
controindicazioni specifiche per la radioterapia, assolute e relative (si veda oltre).
Gli interventi di chirurgia conservativa prevedono l’escissione del tumore fino a ottenere adeguati margini in
tessuto sano. Questi interventi sono stati variamente denominati a seconda dell’ampiezza del tessuto sano rimosso di
principio (tumorectomia, wide excision o escissione ampia,
quadrantectomia). Tradizionalmente, la quadrantectomia,
intervento tipicamente “europeo”, era caratterizzata da
una più ampia escissione di tessuto sano rispetto agli altri
interventi conservativi, praticati soprattutto negli USA.
Queste differenze hanno via via perso di importanza e, attualmente, quello che si ritiene sufficiente è l’ottenimento
di margini di escissione adeguatamente liberi da neoplasia.
Il concetto di adeguatezza del margine rimane, comunque, controverso, ma molti Autori ritengono che quando
la neoplasia giunga in prossimità del margine (<2 mm),
si debba procedere all’allargamento dell’escissione (Forza
Operativa Nazionale Carcinoma Mammario, 2012).
L’intervento classico di mastectomia (mastectomia totale
o semplice) prevede l’asportazione della mammella e della
cute sovrastante. Nella variante proposta da Madden, quella più frequentemente praticata, il muscolo piccolo pettorale non viene asportato. Il risultato estetico e funzionale è
accettabile, anche in assenza di adeguata ricostruzione. In
casi selezionati vengono praticate varianti più conservative
della mastectomia semplice che agevolano gli interventi di
ricostruzione garantendo un migliore risultato estetico e
vengono praticate in casi selezionati. Nella mastectomia
skin-sparing, per esempio, vengono asportate la ghiandola e
il complesso areola-capezzolo, mentre una porzione più o
meno ampia di cute dell’area mammaria viene conservata.
Sebbene non esistano studi randomizzati, i risultati di studi retrospettivi non hanno evidenziato un aumento delle
recidive locali rispetto a procedure chirurgiche non skinsparing. Ancora più conservativa è la mastectomia nipplesparing, che prevede la conservazione anche del complesso
areola-capezzolo, che va irradiato con elettroni in sede di
intervento o successivamente. Questo intervento va riser-
273
274
Capitolo 8
Neo p la sie d ella m a m m ella
vato a neoplasie lontane dall’area del capezzolo e dopo
aver verificato intraoperatoriamente la negatività istologica
del tessuto retroareolare. Va precisato, tuttavia, che sono
attualmente ancora in corso studi randomizzati per verificare l’efficacia terapeutica di questo tipo di mastectomia
(Forza Operativa Nazionale Carcinoma Mammario, 2012).
Staging ascellare
La presenza di linfonodi ascellari metastatici rappresenta ancora oggi un’informazione prognostica rilevante e,
pertanto, lo staging ascellare costituisce un tempo fondamentale della chirurgia mammaria. Inoltre, in presenza di
malattia ascellare, la rimozione dei linfonodi persegue, in
teoria, anche un obiettivo terapeutico, sia per il controllo
locale, sia, forse, per il controllo del rischio sistemico. Lo
staging ascellare può essere effettuato con due tecniche
fondamentali: la biopsia del linfonodo sentinella (BLS)
e la dissezione linfonodale ascellare (DLA).
Biopsia del linfonodo sentinella In assenza di coinvolgimento
evidente dei linfonodi ascellari, la BLS rappresenta la tecnica standard per lo staging ascellare. Il linfonodo sentinella
(LS) è il primo linfonodo che riceve linfa direttamente dal
parenchima mammario e, quindi, dal tumore. I linfonodi
ascellari sono raggiunti dalla linfa attraverso il circolo linfatico superficiale periareolare. Il principio su cui si fonda
la BLS è rappresentato dalla diffusione linfatica ordinata
delle cellule metastatiche, secondo cui le metastasi “a salto” (skip metastases) che coinvolgono le stazioni linfatiche
successive senza aver interessato la prima stazione linfatica di deflusso (cioè il o i LS) sono molto rare. Vari studi
hanno confermato questa ipotesi, mostrando un tasso di
concordanza del 92-98% tra lo staging effettuato con BLS
rispetto a quello con DLA, con un tasso di falsi negativi in
media dell’8,8% (Lyman et al., 2005). Inoltre, in uno studio randomizzato coinvolgente circa 5.600 pazienti, non
si è osservata alcuna differenza in termini di sopravvivenza
tra pazienti sottoposte a DLA di principio, rispetto a quelle
sottoposte a BLS con eventuale DLA in caso di LS positivo
per la presenza di metastasi (Krag et al., 2010). Evitare la
DLA in pazienti con LS libero da metastasi è fondamentale, in quanto migliora notevolmente la qualità di vita
della paziente, riducendo il rischio di linfedema dell’arto
Linfonodo
clinicamente
positivo al
tempo della
diagnosi
Stadio clinico
I, IIA, IIB e IIIA
T3, N1, M0
FIG. 8.21 Algoritmo per lo staging ascellare nelle pazienti con
carcinoma mammario. National
Comprehensive Cancer Network. NCCN
Guidelines v2.2013.
Linfonodo
clinicamente
negativo al
tempo della
diagnosi
Agoaspirato
o biopsia
percutanea
positiva
Agoaspirato
o biopsia
percutanea
negativa
Rilevamento
ed escissione
del linfonodo
sentinella
superiore e preservando in maniera ottimale la funzionalità dell’arto (Mansel et al., 2006; Krag et al., 2007). Nelle
pazienti con metastasi ai LS si procede, normalmente, alla
DLA (contestuale, se le metastasi ai LS sono evidenziate in
sede di esame istologico intraoperatorio, o differenziata,
in caso le metastasi siano evidenziate all’esame istologico
definitivo). Tuttavia, la necessità di effettuare una DLA in
caso di BLS positiva rimane controversa. Recentemente,
infatti, uno studio randomizzato multicentrico ha dimostrato che evitare la DLA in pazienti con 1 o 2 metastasi ai
LS che ricevono chirurgia conservativa seguita da radioterapia e appropriata terapia adiuvante non produce risultati
inferiori alla DLA in termini di sopravvivenza libera da
malattia e di sopravvivenza globale (Giuliano et al., 2011).
Un algoritmo per la gestione della chirurgia ascellare che
tiene conto delle più recenti acquisizioni scientifiche nel
settore è riportato nella Figura 8.21.
Dal punto di vista tecnico, il LS può essere identificato
attraverso l’uso di un colorante vitale (patent blu-v) o
con un tracciante colloidale radioattivo (eventualmente in combinazione con il colorante vitale). Nel primo
caso, l’iniezione del tracciante viene effettuata durante
l’intervento in sede subdermicamente a livello della proiezione cutanea della neoplasia o, direttamente, in sede
subareolare. In caso di neoplasie profonde, può essere
preferibile inoculare il tracciante in sede peritumorale,
ma mai intratumorale. La metodica con il radiotracciante,
che prevede l’impiego di particelle colloidali di albumina
(nanocoll) marcate con 99mTc, è generalmente considerata
più affidabile e meglio performante. Le sedi di inoculo
sono le stesse, ma l’iniezione del tracciante va effettuata
da 2 a 24 ore prima dell’intervento chirurgico. È possibile,
in questo caso, fare una linfoscintigrafia per localizzare in
anticipo la proiezione cutanea del LS e che può essere di
grande aiuto al chirurgo. In sede operatoria, comunque, è
necessario disporre di una sonda per chirurgia radioguidata al fine di identificare correttamente il LS (o i LS) da
asportare. L’esame istologico definitivo del LS dovrebbe
essere effettuato con tecnica standard e colorazione con
ematossilina-eosina. Il linfonodo è definito chiaramente
metastatico in presenza di infiltrazione tumorale >2 mm
(macrometastasi). Del tutto incerto è il significato di lesioni di dimensioni inferiori ( 2 mm), definite micrometa-
Dissezione linfonodale livello I/II
Linfonodo
sentinella
negativo
Linfonodo
sentinella
positivo
Unito a tutti i seguenti criteri:
sentinella positivi
della mammella
per tutta la mammella
Linfonodo
sentinella
non
identificato
Nessuna ulteriore
chirurgia (categoria 1)
Dissezione linfonodale
livello I/II
oppure
Sì per tutti Considerare nessuna
ulteriore chirurgia
No
neoadiuvante
Dissezione linfonodale livello I/II
Ca pito l o 8
stasi, che non richiedono, di regola, la successiva DLA per
il basso rischio di ulteriori metastasi linfonodali. Ancora
più incerto, e presumibilmente minore, è il significato
della presenza nel LS di cellule tumorali isolate identificate
all’indagine immunoistochimica o del loro DNA, identificato con tecniche di RT-PCR.
La BLS, per la sua complessità tecnica, andrebbe effettuata
solo da team esperti che effettuano almeno 100-150 procedure l’anno. Tuttavia, essa sta lentamente sostituendo la
DLA di principio.
Dissezione linfonodale ascellare Quando siano presenti lin-
fonodi ascellari sospetti per metastasi, una verifica citologica o con core-biopsy dovrebbe essere effettuata e, in presenza di linfonodi positivi, la DLA di principio andrebbe
effettuata in sede di intervento chirurgico sul primitivo
(Fig. 8.21). La DLA consiste nella rimozione del tessuto
adiposo ascellare in cui sono presenti i linfonodi. Può
essere effettuata attraverso la stessa incisione praticata per
la rimozione del tumore primitivo o, nel caso di chirurgia
conservativa di tumori in aree distanti dall’ascella, attraverso una seconda incisione separata. Tradizionalmente,
era prevista la rimozione dei linfonodi di tutti e tre i livelli di Berg, identificati dai margini del muscolo piccolo
pettorale. Poiché questo intervento comporta un’elevata
morbilità, in particolare per il rischio di linfedema dell’arto
superiore, la tecnica standard di DLA prevede, attualmente,
un’asportazione limitata ai primi due livelli che, in genere,
comporta la rimozione di un numero soddisfacente di
linfonodi (almeno 6-10). In presenza di malattia bulky ai
primi due livelli, o in presenza di segni macroscopici di
coinvolgimento dei linfonodi di III livello, la rimozione
di questi ultimi è raccomandata per ridurre il rischio di
recidive locali, che sono difficili da controllare con terapie
mediche e radioterapia e sono associate a forte morbilità.
Radioterapia adiuvante
Il ruolo della radioterapia (RT) adiuvante nel controllo
locoregionale della malattia consiste nell’eradicazione
dei residui tumorali microscopici nella mammella per
ridurre il tasso di recidive locali dopo chirurgia. Il recente
aggiornamento della metanalisi dello EBCTCG (Early Breast
Cancer Trialists’ Collaborative Group), tuttavia, ha evidenziato che la RT adiuvante riduce anche il rischio di recidiva a
distanza e la mortalità (Early Breast Cancer Trialists’ Collaborative Group, 2011).
Dopo chirurgia conservativa, la RT adiuvante è sempre
indicata, salvo la presenza delle controindicazioni riportate
nella tabella 8.14.
Nelle pazienti non candidate a chemioterapia adiuvante,
la RT va iniziata entro le 8-12 settimane dall’intervento
chirurgico. Nelle pazienti che praticano chemioterapia
adiuvante, la RT va effettuata dopo il termine della chemioterapia, se le pazienti ricevono antracicline e/o taxani,
mentre può essere effettuata in contemporanea al regime
CMF.
La tecnica standard consiste nell’irradiazione del parenchima residuo con due campi tangenziali contrapposti e
con dosi di 50 Gy in 25 frazioni, 5 volte alla settimana.
N e o p lasi e della mammella
TABELLA 8.14 Controindicazioni assolute e relative
alla radioterapia adiuvante
Controindicazioni assolute
t Gravidanza (in alcuni casi, tuttavia, può essere presa in
considerazione la chirurgia conservativa nel terzo trimestre
se il trattamento radiante è previsto dopo il parto)
t Impossibilità di mantenere una posizione di trattamento
adeguata per una corretta irradiazione
t Alcune malattie del collageno in fase attiva (lupus, sclerodermia,
dermatomiosite)
Controindicazioni relative
t Precedente RT locale (inclusa l’irradiazione toracica per linfoma
di Hodgkin)
t Volume mammario non ottimale per una corretta irradiazione
t Malattie del collageno in fase non attiva
Tuttavia, alcuni studi randomizzati hanno indicato che
schemi ipofrazionati (o accelerati), con dosi di 40-42,5 Gy
in 13-16 frazioni, rappresentano un’accettabile alternativa
sia in termini di controllo locale sia in termini cosmetici
per le pazienti T1-2 N0 (Goldhirsch et al., 2011). L’aggiunta
di un supplemento di dose (boost di 10-16 Gy) sul letto
tumorale riduce il rischio di ricaduta locale (HR = 0,59; p
<0,0001) senza generalmente aggiungere tossicità al trattamento, e con un modesto impatto sul risultato estetico.
Il vantaggio assoluto in termini di controllo locale è più
elevato nelle pazienti di età 40 anni.
Alcuni Autori ritengono che, in pazienti anziane selezionate, la RT adiuvante dopo chirurgia conservativa possa essere
omessa. Tale convinzione si basa sui risultati di un piccolo
studio randomizzato (N = 639) condotto su pazienti con
età 70 anni, con tumore 2 cm, cN0, ER-positivo. In tale
studio nessuna differenza è emersa in sopravvivenza globale, sopravvivenza libera da metastasi a distanza, secondo
tumore primitivo, percentuali di mastectomie tra il braccio che aveva ricevuto la RT rispetto ai controlli. Tuttavia,
è stata osservata una differenza significativa in recidive
mammarie (2% vs 9%, 6 vs 27 casi, a favore della radioterapia) (Hughes et al., 2013). Tuttavia, i dati disponibili non
consentono, a tutt’oggi, di individuare un sottogruppo di
pazienti nel quale la RT sia certamente superflua.
Negli ultimi anni hanno guadagnato grande popolarità le
tecniche di irradiazione parziale del parenchima mammario residuo (partial breast irradiation o PBI). L’irradiazione
parziale della mammella può essere attuata con diverse
metodiche: brachiterapia interstiziale (sia low dose rate, sia
high dose rate), brachiterapia endoluminale (MammoSite),
radioterapia a fasci esterni, e radioterapia intraoperatoria
(IORT). Il volume irradiato e la dose somministrabile
variano considerevolmente da una tecnica all’altra e ogni
metodica presenta vantaggi e problematiche differenti.
I vantaggi offerti dalla PBI sono rappresentati essenzialmente dalla riduzione del numero di sedute e quindi della
durata del trattamento, con vantaggi logistici per le pazienti
e il decongestionamento delle liste di attesa dei centri di
radioterapia. Nonostante la sua rapida diffusione, la PBI va
considerata una metodica ancora sperimentale e va appli-
275
276
Capitolo 8
Neo p la sie d ella m a m m ella
cata solo a donne a basso rischio di recidiva locale (T1 N0
con recettori ormonali positivi) che andrebbero adeguatamente informate circa i potenziali vantaggi e svantaggi
della metodica (Smith et al., 2009).
Dopo mastectomia, la RT adiuvante è indicata nelle pazienti ad alto rischio di recidiva e, cioè, in caso di almeno uno
dei seguenti fattori di rischio: tumore >5 cm, 4 linfonodi
metastatici, estensione extracapsulare macroscopica a livello
dei linfonodi ascellari, interessamento della cute, interessamento della parete toracica. Nelle donne con 1-3 linfonodi
metastatici e senza altri fattori di rischio, l’impiego della RT
adiuvante è controverso, anche se l’ultima edizione della
metanalisi del EBCTCG indica che la riduzione del rischio di
recidiva locale è approssimativamente intorno al 15%, indipendentemente dal numero di linfonodi interessati, mentre
appare chiaramente trascurabile nelle donne N- (Clarke
et al., 2005). Per tale motivo, alcuni Autori suggeriscono
l’impiego della RT adiuvante postmastectomia nelle donne
giovani con 1-3 linfonodi metastatici.
Terapia sistemica adiuvante
La terapia medica adiuvante o precauzionale viene impiegata dopo il trattamento locoregionale con l’obiettivo di
colpire eventuali micrometastasi sistemiche e, conseguentemente, aumentare la probabilità di guarigione definitiva.
Le classi di farmaci impiegabili come terapia adiuvante
sono tre: farmaci endocrini (quali: tamoxifene, inibitori
dell’aromatasi, analoghi del GnRH), efficaci solamente nei
tumori con espressione dei recettori ormonali (cioè, nei
sottotipi tumorali luminal A e B); chemioterapici (polichemioterapia con CMF, antracicline, taxani), teoricamente
efficaci in tutti i sottotipi tumorali, ma forse maggiormente
nei tumori ER- e PgR-; farmaci a bersaglio molecolare
specifico. In quest’ultima classe terapeutica, l’unico farmaco attualmente approvato per l’uso clinico come terapia
adiuvante è il trastuzumab, un anticorpo monoclonale
anti-HER2, il cui impiego, pertanto, richiede come essenziale prerequisito, l’iperespressione di HER2 da parte del
tumore. Queste tre classi di farmaci sono complementari
e possono essere combinate in strategie terapeutiche complesse e “personalizzate”, sulla base dei fattori prognostici
e predittivi espressi dal tumore e, in particolare, sulla base
del sottotipo tumorale intrinseco. Volendo schematizzare,
la strategia terapeutica generale può essere riassunta come
riportato nei due seguenti paragrafi.
Strategia terapeutica in base al sottotipo tumorale
Luminal A: endocrinoterapia (± chemioterapia)
La terapia endocrina da sola è il trattamento adiuvante di
scelta nella maggior parte dei tumori luminal A. Questi
tumori, infatti, sono poco aggressivi biologicamente e hanno una prognosi molto buona. Sono, inoltre, altamente
endocrino-sensibili e il trattamento ormonale è sufficiente
a garantirne la guarigione nella maggior parte dei casi
(Goldhirsh et al., 2011). Controverso è l’impiego della
chemioterapia nei tumori luminal A, sia per l’eccellente
prognosi complessiva dopo terapia endocrina, sia perché
varie evidenze sperimentali ne suggeriscono una scarsa
sensibilità ai chemioterapici. L’aggiunta della chemioterapia alla terapia endocrina nell’ambito della strategia
terapeutica adiuvante va limitata a pochi casi selezionati in
questo sottotipo tumorale. Questa decisione è complessa
e altamente specialistica e va basata su un’attenta analisi
del rapporto tra potenziale beneficio aggiuntivo ed effetti
tossici. Eventuali fattori che, in maniera puramente indicativa, possano consigliare l’aggiunta della chemioterapia
sono rappresentati da:
●
●
coinvolgimento linfonodale ascellare (in particolare
se N >3);
presenza di caratteristiche biologiche intermedie tra
luminal A e B (recettori ormonali non molto alti, Ki67
vicino al 14%, grading elevato).
Nei casi limite, l’impiego di una firma genetica (per esempio, Oncotype DX) può, in teoria, aiutare a dirimere il
dubbio, ma il reale vantaggio nell’eseguire questi costosi
test in tali situazioni è ancora oggetto di studio e pertanto
l’uso di tale test andrebbe, al momento, limitato a situazioni particolari o all’ambito delle sperimentazioni cliniche
(Goldhirsch et al., 2011).
Luminal B HER2!: endocrinoterapia chemioterapia
Il trattamento combinato chemio-endocrino è il trattamento adiuvante di scelta nella maggior parte dei tumori
luminal B che non iperesprimono HER2. Questi tumori,
infatti, sono più aggressivi biologicamente e hanno una
prognosi meno buona rispetto ai luminal A. Sono, inoltre,
meno endocrino-sensibili e, probabilmente, più chemiosensibili. Per quanto riguarda il timing, a scopo prudenziale
e per evitare teoriche interferenze tra i due trattamenti,
la chemioterapia andrebbe iniziata quanto prima dopo
l’intervento chirurgico e la terapia endocrina andrebbe
intrapresa, salvo eccezioni, solo al termine di questa.
È opinione diffusa, tuttavia, che non tutti i tumori luminal
B necessitino della chemioterapia. In maniera opposta
rispetto ai luminal A, in questo sottotipo, la principale
sfida terapeutica per l’oncologo è l’individuazione dei casi
in cui la chemioterapia è superflua. Tale scelta è, come
sopra, complessa e altamente specialistica e va basata su
un’attenta analisi del rapporto tra potenziale beneficio
aggiuntivo ed effetti tossici. Eventuali situazioni che, in
maniera puramente indicativa, possano far propendere
per un trattamento solo endocrino sono:
●
●
dimensioni tumorali tra 0,6 e 1 cm in assenza di metastasi ascellari (pT1b N0 M0); per i tumori luminal 0,5
cm e N- (pT1a N0 M0) la chemioterapia è generalmente
controindicata;
presenza di caratteristiche biologiche intermedie tra
luminal A e B (recettori ormonali altamente espressi,
Ki67 vicino al 14%, grading basso).
Anche in questi casi, l’esecuzione di test di firma genetica
(per esempio, Oncotype DX) può aiutare a dirimere eventuali dubbi, anche se gli studi per la definitiva validazione
di questi test sono ancora in corso (Goldhirsch et al., 2011).
Luminal B HER2+:
chemioterapia + trastuzumab + endocrinoterapia
Questi tumori sono, in genere, più aggressivi rispetto al
sottotipo precedente, ma hanno il vantaggio di essere
Ca pito l o 8
potenzialmente sensibili a tutte e tre le classi di farmaci
disponibili. Il trattamento adiuvante standard prevede,
pertanto, l’impiego combinato di chemioterapia, trastuzumab e terapia endocrina. Il trattamento con trastuzumab
può essere iniziato in contemporanea alla chemioterapia
(scelta maggiormente efficace, ma con maggiore tossicità
cardiologica potenziale) o in sequenza. Maggiori dettagli
sono riportati nel paragrafo “Scelta del regime terapeutico”.
Anche in questo caso, è preferibile iniziare la terapia endocrina dopo il termine della chemioterapia.
Ancora controverso, comunque, è l’impiego del trastuzumab nei tumori di dimensioni inferiori a 1 cm e senza
metastasi ascellari (pT1a-b N0 M0), in quanto questi tumori piccoli erano poco o nulla rappresentati nelle sperimentazioni randomizzate che hanno dimostrato l’utilità
dell’anticorpo monoclonale anti-HER2. Tuttavia, molti
dati indiretti e la maggior parte delle linee guida internazionali suggeriscono di effettuare regolarmente questo trattamento nei tumori che siano almeno superiori a 0,5 cm
di diametro (pT1b N0 M0) (National Comprehensive
Cancer Network, 2013). Alcuni Autori, ritengono che casi
selezionati a basso rischio nell’ambito di questo sottotipo possano essere trattati con la sola terapia endocrina +
trastuzumab, omettendo, quindi, la chemioterapia. Tuttavia, questo approccio è privo, al momento, di qualunque
evidenza sperimentale e andrebbe limitato ai rari casi con
controindicazioni chiare alla chemioterapia.
HER2+ non luminal: chemioterapia + trastuzumab
Si tratta di un sottotipo aggressivo, ma altamente sensibile
al trattamento combinato chemioterapia + trastuzumab
che, pertanto, rappresenta lo standard terapeutico per
l’intero sottogruppo. Come per il sottotipo precedente,
valgono le stesse considerazioni a proposito dei tumori
di piccole dimensioni (National Comprehensive Cancer
Network, 2013).
“Triple negative” (ER-/PgR-/HER2!): chemioterapia
Si tratta di un sottotipo il cui elemento caratterizzante è
la non sensibilità ai trattamenti endocrini e anti-HER2. La
chemioterapia rappresenta, pertanto, l’unica arma terapeutica disponibile ed è, spesso, una scelta obbligata. Infatti, i
tumori triple negative (TN) hanno, mediamente, un rischio
di recidiva più elevato rispetto agli altri sottotipi e sono
comunemente considerati tumori aggressivi. In realtà, è
oramai chiaro che il sottotipo TN è molto eterogeneo e
comprende tumori a prognosi molto diversa. Nella maggior parte dei casi, i tumori TN hanno caratteristiche istologiche e immunoistochimiche che fanno pensare a un’alta
aggressività biologica (grading alto, Ki67 elevato). In questi casi il trattamento chemioterapico adiuvante è, quasi
sempre, indicato e può, ragionevolmente, essere omesso
solo nei tumori di dimensioni molto piccole ( 0,5 cm)
e senza linfonodi ascellari metastatici (pT1a N0 M0) (National Comprehensive Cancer Network, 2013). Più raramente, i tumori TN presentano caratteristiche di bassa
aggressività (grading basso, Ki67 basso). In questi casi,
l’indicazione alla chemioterapia può essere meno stringente e il trattamento può essere omesso anche in tumori
N e o p lasi e della mammella
pT1b N0 M0, in base a un’attenta analisi del singolo caso
e del rapporto tra potenziale beneficio ed effetti tossici.
Una discussione a parte meritano i tumori TN di istologia “midollare”, il cui trattamento rimane controverso.
Questi rari tumori presentano, nella variante classica, un
Ki67 molto alto, a indicazione di un’intensa attività proliferativa, ma si è ritenuto, in precedenza, che avessero
un basso potenziale metastatico. Ciò ha portato alcuni
Autori a suggerire, in questi casi, l’omissione della chemioterapia. Tuttavia, evidenze più recenti hanno messo
in dubbio la buona prognosi dei tumori midollari. Inoltre, evidenze della letteratura indicano che la diagnosi
di carcinoma midollare “tipico” ha un’alta variabilità
e scarsa riproducibilità tra diversi patologi. Pertanto,
per evitare la grave omissione di un trattamento potenzialmente guaritivo, si suggerisce, prudenzialmente,
di trattare questo istotipo raro alla stregua dei comuni
tumori duttali TN (National Comprehensive Cancer
Network, 2013).
Un altro oggetto di controversia è stata la sensibilità dei
tumori TN ai diversi farmaci chemioterapici. Alcuni Autori,
infatti, hanno ipotizzato che questo sottotipo tumorale,
in particolare quando presenti caratteristiche basal-like,
sia poco sensibile ai farmaci comunemente impiegati nel
tumore mammario (antracicline e taxani) e che, invece, sia
particolarmente sensibile ai derivati del platino o a regimi
terapeutici obsoleti, come il classico CMF. In realtà, non
esiste al momento alcuna solida evidenza a supporto di
queste affermazioni. Anzi, la maggior parte delle evidenze
disponibili depone per un’elevata sensibilità nei confronti
di antracicline e taxani (Liedtke et al., 2008). Pertanto, in
assenza di specifiche controindicazioni, il regime polichemioterapico da impiegare in questi casi dovrebbe contenere antracicline e taxani, così come suggerito dalle maggiori linee guida internazionali (National Comprehensive
Cancer Network, 2013) e come recentemente deliberato da
un panel di esperti internazionali riunitosi a marzo 2013
in occasione della Consensus Conference biennale di San
Gallen, in Svizzera (appunti personali).
Scelta del regime terapeutico
Chemioterapia
La chemioterapia rappresenta la prima forma di terapia
adiuvante sviluppata a partire dalla metà del secolo scorso.
Da allora, centinaia di studi clinici sono stati condotti
in tutto il mondo, generando un’immensa mole di dati
scientifici la cui interpretazione e trasposizione nella pratica clinica quotidiana è molto complessa. Un formidabile
strumento di sintesi di tutta l’evidenza scientifica disponibile è costituito dalla metanalisi periodica dei dati raccolti
in tutti gli studi randomizzati, nota come metanalisi di
Oxford o dello EEBCTCG, la cui ultima edizione è stata
recentemente pubblicata (Early Breast Cancer Trialists’
Collaborative Group, 2012). Il vantaggio della metanalisi è
quello di stimare in maniera molto precisa l’effetto medio
dei diversi trattamenti disponibili e di valutare se questo
effetto differisce in particolari sottogruppi di pazienti.
Coerentemente con la metanalisi, è possibile classificare i
regimi polichemioterapici per il carcinoma mammario in
tre diverse generazioni.
277
Capitolo 8
Neo p la sie d ella m a m m ella
A
B
50
5.253 donne: CMF standard
(o vs CMF standard)
(34% N+)
No CTX
39,8%
Recidiva (%)
40
FIG. 8.22 Effetto medio della somministrazione di un regime CMF
adiuvante nel carcinoma mammario sul rischio di recidiva (A)e sulla
mortalità globale (B). Early Breast
Cancer Trialists’ Collaborative Group.
Lancet 2012.
Mortalità globale (%)
50
30,2%
30
29,6%
CMF
20
20,3%
RR: 0,70 (95%: 0,63-0,77)
Log-rank 2p<0,00001
Miglioramento a 10 anni,
10,2% (ES, 1,4)
10
RR: 0,84 (IC 95%: 0,76-0,93)
Log-rank 2p = 0,0004
Miglioramento a 10 anni,
4,7% (ES, 1,3)
26,0%
CMF
20
16,4%
13,7%
10
5
0
10
5
10
Anni
Anni
A
B
9.527 donne: regimi don dosi cumulative
di antracicline ad alta efficacia
(53% N+) vs CMF
Recidiva (%)
40
FIG. 8.23 Effetto medio della somministrazione di un regime ad
alta efficacia contenente antracicline sul rischio di recidiva (A) e
sulla mortalità globale (B). CMF:
ciclofosfamide-metotrexato-fluorouracile. Early Breast Cancer Trialists’
Collaborative Group. Lancet 2012.
30
CMF
33,8%
31,2%
Antracicline
25,5%
20
5
9.527 donne
40
RR: 0,84 (IC 95%: 0,76-0,92)
Log-rank 2p = 0,0002
Miglioramento a 10 anni,
3,9% (ES, 1,1)
CMF
27,1%
23,2%
Antracicline
20
RR: 0,89 (95% CI 0,82-0,96)
Log-rank 2p=0,003
Miglioramento a 10 anni,
2,6% (ES, 1,1)
0
50
30
22,3%
10
0
15,7%
12,8%
10
0
10
0
5
10
Anni
Anni
B
A
11.167 donne
40
Antracicline controllo
34,8%
30
30,2%
Taxani + antracicline
27,3%
23,7%
20
RR: 0,84 (IC 95%: 0,78-0,91)
Log-rank 2p <0,00001
Miglioramento a 8 anni,
4,6% (ES, 1,0)
10
Mortalità globale (%)
50
No CTX
30,7%
30
0
0
50
FIG. 8.24 Effetto medio della
somministrazione contenente antracicline e taxani sul rischio di recidiva (A) e sulla mortalità globale
(B). RR: Rischio Relativo; ES: Errore
Standard. Early Breast Cancer Trialists’
Collaborative Group. Lancet 2012.
5.253 donne
40
0
Recidiva (%)
278
50
11.167 donne
40
RR: 0,86 (IC 95%: 0,79-0,93)
Log-rank 2p = 0,0002
Miglioramento a 8 anni, 3,2% (es 0,9)
30
Antracicline controllo
16,7%
23,5%
Taxani + antracicline
18,2%
20
16,3%
10
0
0
0 1
2 3
4 5
6 7 8
Anni
0 1
2 3
4 5
6 7 8
Anni
Ca pito l o 8
Regimi di 1a generazione Questi regimi sono basati sulla
combinazione di ciclofosfamide-metotrexato-fluorouracile
(CMF) e, somministrati per un numero di 6-12 cicli, riducono mediamente il rischio di recidiva di circa il 30% (RR
= 0,70) e la mortalità globale di circa il 16% (RR = 0,84)
(Fig. 8.22). Sembrano essere particolarmente efficaci nelle
donne al di sotto dei 55 anni e con linfonodi ascellari non
metastatici (Early Breast Cancer Trialists’ Collaborative
Group, 2012). Sono attualmente poco usati e rappresentano, perlopiù, un riferimento storico. Tuttavia, alcuni Autori
li ritengono ancora validi per alcuni specifici sottogruppi di
pazienti. In particolare, sulla base di analisi di sottogruppo non pianificate effettuate su un vecchio studio clinico
randomizzato denominato NCCTG MA5 (Cheang et al.,
2012) è stata avanzata l’ipotesi che questi regimi fossero
più efficaci di quelli a base di antracicline nel sottotipo tumorale triple negative (in particolare nel basal-like). Questa
ipotesi, tuttavia, è basata su dati deboli e non ha trovato,
al momento, sostanziali conferme.
Regimi di 2a generazione Si tratta di regimi polichemioterapici contenenti antracicline. Questi regimi sono mediamente più efficaci dei regimi tipo CMF. Tuttavia, è oramai
chiaro che non tutti i regimi a base di antracicline sono
egualmente efficaci. In particolare, è possibile distinguere
orientativamente regimi a bassa efficacia e regimi ad alta
efficacia. I regimi a bassa efficacia comprendono quelli denominati EC (epirubicina + ciclofosfamide) o AC (adriamicina + ciclofosfamide), che sono, in genere, somministrati
per soli 4 cicli e sono perlopiù usati nelle pazienti a rischio
limitato. Questi regimi sono sostanzialmente equivalenti
al CMF in termini in efficacia terapeutica, ma hanno un
diverso profilo di tollerabilità, inducendo meno tossicità gonadica e più alopecia e cardiotossicità (Early Breast
Cancer Trialists’ Collaborative Group, 2012). I regimi ad
alta efficacia comprendono quelli noti come FEC o CEF
(fluorouracile + epirubicina + ciclofosfamide) e FAC o CAF
(fluorouracile + adriamicina + ciclofosfamide), vengono
somministrati in genere per 6 cicli e devono prevedere una
dose di antracicline non inferiore a 60 mg/m2, nel caso della doxorubicina, o 100 mg/m2, nel caso della epirubicina.
Questi regimi sono più efficaci del CMF, producendo un’ulteriore riduzione del rischio di recidiva del tumore (11%,
pari a un RR = 0,89) e della mortalità globale (16%, pari
a un RR = 0,84) (Fig. 8.13). Tuttavia, come rovescio della
medaglia, sono gravati da una maggiore tossicità acuta e
di lungo periodo. Quest’ultima, particolarmente temibile,
ma per fortuna relativamente rara, comprende lo sviluppo
di insufficienza cardiaca congestizia e di leucemia mieloide
acuta (Azim et al., 2011). La frequenza di questi effetti tossici, comunque, per quanto probabilmente sottostimata,
non è tale da controbilanciare i favorevoli effetti sul rischio
tumorale nella maggior parte delle donne, come dimostra
la riduzione della mortalità globale legata ai trattamenti con
antracicline nella metanalisi di Oxford (si veda Fig. 8.23).
Grazie a questi dati, i regimi a base di antracicline si sono
affermati ampiamente intorno agli anni Novanta del secolo scorso, soppiantando, soprattutto nelle donne a più
elevato rischio, il classico CMF, e rappresentano ancora
oggi una valida opzione terapeutica nelle donne candidate
a ricevere una chemioterapia adiuvante.
N e o p lasi e della mammella
Regimi di 3a generazione Questi regimi sono stati sviluppati
tra il 1990 e il 2000 circa, e comprendono regimi a base di
antracicline + taxani, quali: TAC (docetaxel + adriamicina
+ ciclofosfamide) o TEC (docetaxel + epirubicina + ciclofosfamide), FEC seguito da docetaxel, AC (o EC) seguito
da paclitaxel. Questi ultimi sono anche definiti regimi
“blocco-sequenziali”, in quanto composti da due distinti
blocchi somministrati in sequenza: uno a base di antracicline (AC/EC/FEC), normalmente somministrato per
3-4 cicli, e uno a base di taxani, perlopiù in monoterapia,
somministrati per altrettanti cicli. L’ordine dei blocchi è,
in taluni regimi, invertito (per esempio, paclitaxel AC).
Questi regimi sono mediamente superiori a quelli di seconda generazione, e producono un’ulteriore riduzione
del rischio di recidiva e della mortalità globale del 14-16%
(Fig. 8.24). Va, comunque, precisato che questa superiorità
è chiaramente evidente solo in quegli studi in cui il taxano
sia stato aggiunto al regime di confronto con antracicline,
aumentando, pertanto il numero di cicli complessivi della
chemioterapia. Nei casi in cui il taxano sia stato impiegato
in sostituzione di una parte del regime di confronto, la
superiorità rispetto ai regimi di seconda generazione sarebbe marginale (Early Breast Cancer Trialists’ Collaborative
Group, 2012). Anche in questo caso, comunque, l’impiego
del taxano dovrebbe risultare teoricamente vantaggioso,
consentendo di ottenere un regime di efficacia pari a quelli
di seconda generazione, ma con il vantaggio di ridurre la
dose totale di antracicline somministrate e, in definitiva,
ridurre l’incidenza della cardiotossicità legata a esse. Per
questi motivi, i regimi a base di taxani e antracicline, soprattutto quelli “blocco-sequenziali”, hanno guadagnato
grande popolarità in quest’ultimo decennio, costituendo
lo standard terapeutico più utilizzato nelle donne a rischio
moderato-alto.
Allo scopo di ridurre al minimo il rischio di cardiotossicità,
sono stati recentemente sviluppati regimi con soli taxani
senza antracicline, quali, per esempio, il TC (docetaxel +
ciclofosfamide) somministrato per 4 cicli. Questo regime, confrontato con il regime di seconda generazione AC
(adriamicina + ciclofosfamide), ha mostrato, a parità di
numero di cicli, di essere più efficace in termini di riduzione del rischio di recidiva e di miglioramento della sopravvivenza globale (Jones et al., 2009), con il vantaggio di
indurre una cardiotossicità trascurabile. Per quanto questo
regime non sia mai stato confrontato direttamente con un
regime di seconda generazione ad alta efficacia (FEC/FAC/
CEF/CAF), è ragionevole dedurre, in base alla superiorità
nei confronti di AC, che sia di efficacia sostanzialmente
paragonabile, con il grande vantaggio della minore durata
(4 vs 6 cicli) e dell’assenza di cardiotossicità. Per questi
motivi, il regime TC ha guadagnato recentemente grande
popolarità come regime di riferimento per le pazienti con
rischio moderato-basso che siano candidate a ricevere una
chemioterapia adiuvante.
Endocrinoterapia
La terapia ormonale adiuvante è una terapia sistemica indicata in tutti i tipi di carcinoma mammario endocrino-responsivi (ER e/o PgR positivo >1%). Essa può seguire un trattamento chemioterapico (terapia endocrina sequenziale)
o costituire l’unico trattamento sistemico adiuvante. In
279
280
Capitolo 8
Neo p la sie d ella m a m m ella
caso di carcinoma mammario luminal B HER2+, la terapia
endocrina può essere somministrata contemporaneamente alla terapia adiuvante anti-HER2. I composti utilizzati
nell’ormonoterapia adiuvante appartengono a tre categorie
di farmaci, distinte per meccanismo di azione, ma aventi
tutte come obiettivo ultimo la riduzione della stimolazione
estrogenica sul carcinoma mammario. I farmaci utilizzati
nella terapia endocrina adiuvante nel carcinoma mammario appartengono a tre diverse classi:
1. modulatori selettivi del recettore per gli estrogeni
(SERM);
2. inibitori dell’aromatasi (IA);
3. analoghi del GnRH (GnRHa).
SERM Appartengono a questa classe il tamoxifene e il toremifene (clorotamoxifene). Tuttavia, mentre il tamoxifene è stato ampiamente studiato come terapia adiuvante,
mancano dati sperimentali a supporto del toremifene.
Pertanto, l’uso del toremifene come terapia adiuvante va,
prudenzialmente, evitato e limitato ai rari casi di intolleranza ad altri agenti ormonali. Il meccanismo di azione
dei SERM consiste in una competizione con l’estrogeno
per il legame con il recettore specifico (ER). Una volta
legato a ER, i SERM esercitano, a differenza dell’estrogeno,
solo una debole stimolazione del recettore, impedendo
competitivamente la stimolazione piena del recettore da
parte del suo ligando naturale. Tuttavia, l’entità della stimolazione di ER da parte di un SERM è diversa a seconda
dell’organo bersaglio e del tipo di farmaco. In linea di
massima, il tamoxifene esercita una stimolazione molto
debole sul tessuto mammario (risultando, quindi, in un
effetto netto inibitorio rispetto al normale estrogeno), e in
una stimolazione più forte su tessuto osseo (esercitando,
così, un’azione protettiva contro l’osteoporosi) ed endometriale. Il tamoxifene è un farmaco ottimamente tollerato,
ma non completamente privo di effetti collaterali. I più
frequenti effetti vasomotori manifestati sono: flushing al
volto, vampate di calore, tachicardia e sudorazione. Questi
disturbi, presenti nel 15-20% delle pazienti, tendono a
ridursi di intensità e frequenza nel tempo. Molto frequente
è anche l’amenorrea, che si manifesta in circa il 40-50%
delle donne in premenopausa. Molto meno frequenti, ma
clinicamente importanti, sono gli eventi tromboembolici
(1-3% dei casi) e le rare alterazioni della funzione visiva
(cataratta, edema maculare, neurite ottica e retinopatia).
Per l’effetto estrogeno-simile del tamoxifene a livello endometriale, in corso di trattamento può svilupparsi iperplasia
endometriale semplice e, molto più raramente, un carcinoma dell’endometrio. Per quanto molto temuto, in realtà
l’incidenza di carcinoma endometriale in donne trattate
con tamoxifene è molto bassa e pari a circa 1,5% versus
0,6% nei controlli a 10 anni. Tra l’altro, essendo il carcinoma dell’endometrio altamente guaribile, ne deriva una
mortalità correlata del tutto irrilevante (0,1% a 10 anni)
(Early Breast Cancer Trialists’ Collaborative Group, 2011).
Dal punto di vista farmacologico, va ricordato che il tamoxifene viene metabolizzato dal sistema enzimatico
citocromo P450. In particolare, attraverso il citocromo
CYP2D6 il tamoxifene viene trasformato in endoxifene
che ha un’affinità per ER 100 volte maggiore e che ne rappresenta, pertanto, il vero metabolita attivo. Alcuni farma-
ci antidepressivi inibitori del reuptake della serotonina,
come paroxetina e fluoxetina, talora utilizzati anche nel
trattamento di effetti collaterali (per esempio, vampate di
calore), possono determinare inibizione del CYP2D6 e,
teoricamente, ridurre l’efficacia del tamoxifene riducendone la conversione a endoxifene. È consigliabile, pertanto,
evitarne l’impiego in corso di terapia con tamoxifene e di
sostituirlo, eventualmente, con farmaci analoghi, ma con
una minore azione inibitoria sul citocromo CYP2D6, quali
venlafaxina, citalopram ed escitalopram.
Inibitori dell’aromatasi L’aromatasi è un enzima ubiquitario
principalmente espresso nelle gonadi e nelle ghiandole
surrenaliche, responsabile della conversione degli androgeni (principalmente androstenedione e testosterone) in
estrogeni. L’espressione dell’aromatasi è stata dimostrata
anche a livello stromale di alcuni tumori mammari, suggerendo una produzione estrogenica autocrina. L’aromatasi
appartiene alla famiglia dei citocromi P450 e catalizza
selettivamente la produzione di estrogeni a differenza di
enzimi simili che modulano la produzione di altri ormoni
steroidei (glucocorticoidi, androgeni e mineralcorticoidi).
Pertanto, l’inibizione selettiva dell’aromatasi riduce la sola
produzione di estrogeni senza produrre alterazioni dei
livelli di altri ormoni steroidei.
Gli IA sono essenzialmente di due tipi:
●
●
steroidei (ex tipo 1): sono definiti anche “inibitori suicidi” o inattivatori perché sono in grado di legarsi all’aromatasi in maniera covalente e di bloccarne in maniera
irreversibile l’attività enzimatica (che può essere ripristinata solo dopo nuova sintesi dell’enzima stesso).
L’unico tra gli IA moderni (cosiddetti IA di terza generazione) appartenente a questa classe è l’exemestano
(Lønning, 2004);
non steroidei (ex tipo 2): sono inibitori reversibili dell’aromatasi la cui azione avviene per legame con i siti
enzimatici attivi in modo competitivo con il substrato naturale, cioè l’androstenedione. Appartengono a
questa classe gli IA di terza generazione anastrozolo e
letrozolo (Lønning, 2004).
In premenopausa, l’espressione maggiore dell’aromatasi è a
livello ovarico, dove FSH stimola le cellule della granulosa a
sintetizzare più aromatasi e LH stimola le cellule della teca
a sintetizzare androstenedione (il suo principale substrato).
La riduzione dei livelli di estrogeni derivante dall’utilizzo di
IA in premenopausa determina un incremento ipofisario di
FSH/LH per mancato feedback negativo. Questa iperstimolazione induce la formazione di cisti ovariche e controbilancia
l’effetto inibitorio del farmaco sulla produzione di estrogeni.
Per questo motivo, la somministrazione di IA in donne
premenopausali è assolutamente controindicata in assenza
di un blocco dell’asse ipotalamo-ipofisario.
Nella postmenopausa la principale produzione di estrogeni avviene per conversione periferica dell’androstenedione
di origine surrenalica. Per questo motivo l’utilizzo di IA in
donne in postmenopausa induce una significativa riduzione dei livelli circolanti di estrogeni, con conseguente
inibizione della stimolazione tumorale (Lønning, 2004).
La drastica riduzione degli estrogeni induce, comunque,
una serie di effetti collaterali, di cui, i più frequenti, sono
Ca pito l o 8
Analoghi del GnRH (GnRHa) Il GnRH (gonadotropin-releasing
hormone) è un peptide secreto dai neuroni ipotalamici che
regola la sintesi e la secrezione di FSH (ormone follicolostimolante) e LH da parte dell’ipofisi. Una caratteristica
chiave della secrezione di GnRH è il suo rilascio pulsatile,
che è regolato, fisiologicamente, da un generatore di impulsi
di GnRH (o oscillatore di GnRH) localizzato nell’ipotalamo
mediobasale. È dimostrato che, mentre il rilascio pulsatile
del GnRH stimola la sintesi e la secrezione di gonadotropine, un’infusione continua di GnRH ne sopprime la secrezione a causa di una desensibilizzazione delle cellule
gonadotrope ipofisarie. I GnRHa sono peptidi sintetici simili
al GnRH, ma caratterizzati da una minore suscettibilità alla
degradazione proteolitica e da una maggiore affinità per i
recettori del GnRH. Essi sono, pertanto, anche denominati
analoghi superagonisti del GnRH. La loro somministrazione
in forma a rilascio prolungato simula l’infusione continua di
GnRH e, desensibilizzando le cellule gonadotrope ipofisarie,
inibisce la produzione di FSH e LH inducendo, in donne
in età fertile, una menopausa farmacologica reversibile. Ne
consegue una riduzione dei livelli di estrogeni circolanti e,
di conseguenza, dello stimolo proliferativo sulle cellule tumorali endocrino-sensibili (Robertson e Blamey, 2003). Gli
effetti collaterali indotti dai GnRHa sono sostanzialmente
simili a quelli della menopausa naturale: vampate di calore,
osteoporosi, aumento di peso, ipertensione, diabete e, ipoteticamente, aumento del rischio cardiovascolare.
In funzione del diverso meccanismo di azione dei farmaci ormonali, la scelta del trattamento endocrino adiuvante dipende dallo stato menopausale della paziente.
Premenopausa In questo caso il trattamento di scelta è il tamoxifene, somministrato alla dose di 20 mg al giorno per os
per 5 anni. A tali dosi il trattamento con tamoxifene riduce
mediamente il rischio di recidiva di circa il 40% (RR = 0,61)
e la mortalità cancro-correlata di circa il 30% (RR = 0,70)
(Fig. 8.25). Ancora controverso è l’impiego di tamoxifene
per periodi più prolungati. Alcuni studi iniziali di piccole
dimensioni avevano ipotizzato un effetto negativo delle
somministrazioni superiori a 5 anni. Recentemente, invece,
una grossa sperimentazione clinica randomizzata (studio
ATLAS) coinvolgente circa 13.000 donne ha dimostrato
che la somministrazione di tamoxifene protratta per 10
anni è superiore a quella standard di 5 anni, riducendo
ulteriormente sia il rischio di recidiva, sia la mortalità
globale (Davies et al., 2013). Ne deriva che il trattamento
per 10 anni possa essere preso in considerazione nelle
donne a rischio moderato-alto, dopo attenta valutazione
del rapporto tra potenziale beneficio aggiuntivo ed effetti
tossici (San Gallen Breast Cancer Consensus Conference
2013, appunti personali).
Per quanto ampiamente diffusi nella pratica clinica, il
ruolo dei GnRHa è tutt’altro che chiaro e, probabilmente, sopravvalutato. In una recente metanalisi degli studi
clinici randomizzati (Cuzik et al., 2007), il GnRHa come
trattamento endocrino singolo non ha prodotto risultati terapeutici statisticamente significativi e, pertanto, va
considerato un trattamento subottimale, da riservare solo
a quei rari casi intolleranti a tutte le altre opzioni endocrine disponibili. Dalla stessa metanalisi si evince che, nelle
pazienti che non ricevono la chemioterapia, l’aggiunta del
GnRH al tamoxifene non migliora in maniera statisticamente significativa né il rischio di recidiva, né la mortalità.
Tuttavia, si evidenzia una tendenza non significativa al
miglioramento dell’efficacia terapeutica, soprattutto nelle
donne con meno di 40 anni. Analoghi risultati, si osservano per le donne che ricevono chemioterapia seguita da
tamoxifene, con un più spiccato trend a favore delle donne
con meno di 40 anni. Ciò è in linea con il meccanismo di
azione dei GnRHa il cui effetto terapeutico è, ipoteticamente, limitato alle sole donne che non vanno in amenorrea
a causa del danno ovarico da chemioterapia (cosa che
accade più frequentemente nelle donne giovani). Tenendo
conto di questi dati, l’aggiunta del GnRHa al tamoxifene
non deve essere presa come un obbligo terapeutico, ma
come un’opzione da valutare caso per caso sulla base di un
attento bilancio tra potenziali benefici e tossicità. In particolare, nelle donne che non ricevono la chemioterapia, il
trattamento combinato tamoxifene + GnRHa può essere
A
Recidiva (%; +/– ES)
50
FIG. 8.25 Effetto medio della somministrazione di 5 anni di tamoxifene sul rischio di recidiva (A) e
sulla mortalità cancro-correlata (B).
ER: recettore degli estrogeni; RR: rischio
relativo; ES: errore standard. Early
Breast Cancer Trialists’ Collaborative
Group. Lancet 2012.
10.645 donne (100% ER positivo,
44% linfonodo positivo,
51% chemioterapia)
40,1%
40
30
Controllo
46,2%
25,9%
16,4%
0
10.645 donne
50
Controllo
33,1%
30
25,1%
20
20
10
B
40
5 anni di
tamoxifene
33,0%
28,7%
Mortalità per cancro alla mammella (%; +/– ES)
a carico del sistema osteoscheletrico, in particolare: artromialgie, osteoporosi e rischio di fratture. La comparsa di
artralgie è stata riportata come la causa più frequente di
sospensione del trattamento. Altri effetti collaterali tipici
sono: vampate di calore, secchezza vaginale, incremento
del peso corporeo, dislipidemie.
N e o p lasi e della mammella
RR: 0,61 (IC 95%: 0,57-0,65
Log-rank 2p <0,00001
Miglioramento a 15 anni,
13,2% (ES, 1,1)
0
5
10
15 anni
Frequenza di recidiva (% per anno) e analisi del log-rank
11,9%
10
8,6%
0
0
5 anni di
tamoxifene
23,9%
17,9%
RR: 0,70 (IC 95%: 0,64-0,75
Log-rank 2p <0,00001
Miglioramento a 15 anni,
9,2% (ES, 1,1)
5
10
15 anni
Frequenza di mortalità (% per anno):
percentuale totale meno percentuale
di donne senza recidiva e analisi del log-rank
281
Capitolo 8
Neo p la sie d ella m a m m ella
preso in considerazione in quelle a rischio non particolarmente basso. Analogamente, nelle pazienti che ricevono
la chemioterapia, l’aggiunta di un GnRHa al tamoxifene
può essere presa in considerazione in quelle che non vanno incontro ad amenorrea chemio-indotta, soprattutto se
a rischio moderato-alto di recidiva. Anche la durata del
trattamento con un GnRHa è controversa, ma si ritiene
che una somministrazione di almeno 2 anni sia necessaria.
Eventuali somministrazioni più prolungate vanno, ancora
una volta, prese in considerazione caso per caso sulla base
della tollerabilità del trattamento e del rischio di recidiva
della paziente.
Ancora oggetto di sperimentazione, infine, è il ruolo degli
IA. La somministrazione di tali farmaci in donne in premenopausa andrebbe, pertanto, limitata ai casi intolleranti al
tamoxifene e va effettuata ponendo la paziente in menopausa iatrogena con la contemporanea somministrazione
di un GnRHa per tutta la durata del trattamento endocrino
con IA (Goldhirsch et al., 2011).
Postmenopausa Nelle donne in postmenopausa, regimi
endocrini adiuvanti contenenti IA di terza generazione
(anastrozolo, letrozolo, exemestano) rappresentano il trattamento endocrino di scelta e comprendono due diverse
opzioni: regimi up-front, in cui lo IA va somministrato
direttamente in sostituzione del tamoxifene (per 5 anni);
regimi di sequenza/switch in cui lo IA è somministrato in
sequenza (per 2-3 anni) dopo 3-2 anni di tamoxifene, in
modo che la durata complessiva di terapia endocrina sia
comunque pari a 5 anni. Vari studi clinici randomizzati
includenti complessivamente più di 20.000 donne, e una
recente metanalisi di questi (Dowsett et al., 2010), hanno
mostrato che sia i regimi up-front sia i regimi sequenza/
switch sono moderatamente più efficaci del classico tamoxifene nelle donne in postmenopausa in termini di
prevenzione delle recidive di carcinoma mammario, con
una riduzione assoluta del rischio di recidiva compresa tra
3,4% e 3,9% (Fig. 8.26). Meno chiaro, e probabilmente
marginale, è il vantaggio in termini di riduzione della
mortalità. Sulla base di questi dati, i regimi con IA hanno
letteralmente soppiantato il tamoxifene e sono attualmente
impiegati nella grande maggioranza delle donne postmenopausali che ricevono terapia endocrina adiuvante.
Molti quesiti relativi all’ottimizzazione di impiego degli IA
restano, comunque, ancora aperti. Per esempio, non è possibile al momento definire se, e quale, IA di terza generazione sia superiore agli altri. Un solo studio randomizzato
di confronto diretto tra due diversi IA (studio MA.27) ha
fornito, al momento, i risultati. In questo studio, l’exemestano e l’anastrozolo entrambi somministrati come regime
up-front per 5 anni, sono risultati ugualmente efficaci e
tollerati (Goss et al., 2013). Nell’attesa che altri studi simili
giungano a maturazione, non esiste, pertanto, al momento,
alcun elemento solido per preferire uno specifico IA.
Allo stesso modo, non esiste una chiara evidenza scientifica
a favore di un tipo specifico di regime (up-front vs sequenza/switch). Infatti, in uno studio randomizzato di quasi
10.000 pazienti (studio TEAM) il confronto tra exemestano
in up-front versus la sequenza tamoxifene exemestano
entrambi per una durata complessiva di 5 anni, non ha
mostrato nessuna differenza significativa in termini di
rischio di recidive e di mortalità (van de Velde et al., 2011).
Tuttavia, un lieve e non significativo vantaggio in termini
di recidive si osserva nei primi anni a favore del regime
up-front nelle donne con coinvolgimento dei linfonodi
ascellari. Analogamente, nello studio BIG1-98, il regime
up-front con letrozolo è stato confrontato con due regimi sequenziali: tamoxifene letrozolo e letrozolo tamoxifene.
Anche in questo studio, nessuna differenza significativa è
emersa tra i regimi a confronto (Mouridsen et al., 2009).
Anche in questo studio si osserva un lieve e non significativo vantaggio in termini di recidive nel corso dei primi 2
anni di trattamento per le donne con metastasi ascellari
che avevano ricevuto il regime up-front. Questo fenomeno
può essere spiegato con il fatto che, nelle donne a rischio
più elevato, esiste un picco precoce di recidive proprio nei
primi 2 anni dalla chirurgia e questo picco potrebbe essere
meglio prevenuto dall’impiego del farmaco più efficace
A
50
B
Miglioramento a 3 anni, 3,1% (ES, 0,6)
Miglioramento a 6 anni, 3,6% (ES, 1,1)
Log-rank 2p <0,00001
30
20
19,2%
12,6%
15,3%
Recidiva (%, +/– ES)
40
Inibitori dell’Aromatasi
Tamoxifene
10
FIG. 8.26 Effetto medio della somministrazione di un trattamento
adiuvante con inibitore dell’aromatasi rispetto al tamoxifen sul rischio di recidiva per i regimi up§front (A) e i regimi sequenza/
switch (B). ES: errore standard.
Dowsett et al. J Clin Oncol 2010.
50
Miglioramento a 5 anni, 2,9% (ES, 0,7)
Miglioramento a 8 anni, 3,9% (ES, 1,0)
Log-rank 2p <0,00001
40
Recidiva (%, +/– ES)
282
Inibitori dell’Aromatasi
Tamoxifene
30
20
16,0%
8,1%
10
12,6%
9,6%
0
0
5
Tempo (anni)
8
5,0%
0
(=0)
0
(=2)
3
(=5)
6
(=8)
Tempo dall’assegnazione dei differenti trattamenti
(anni) (e tempo approssimato dalla diagnosi)
Ca pito l o 8
(cioè lo IA) fin dall’inizio. Volendo riassumere l’evidenza
scientifica disponibile e usando il buon senso clinico si
può affermare che entrambi i regimi, up-front e sequenza/
switch, rappresentano due valide opzioni terapeutiche e
la scelta tra queste va effettuata caso per caso analizzando
i potenziali benefici e tossicità di ciascuna opzione. In
particolare, il regime up-front può essere preferito nelle
donne a rischio più elevato perché maggiormente efficace
nel prevenire il picco di recidive precoci che si osserva in
queste pazienti. Il regime sequenza/switch, avendo un
profilo di tollerabilità mediamente migliore, rappresenta
l’opzione probabilmente più valida nelle pazienti a rischio
moderato-basso. Questa indicazione di massima, tuttavia,
può essere modificata per intollerabilità soggettiva e/o
fattori di rischio per specifici effetti collaterali. Per esempio, in presenza di un elevato rischio tromboembolico il
tamoxifene andrebbe evitato e il regime up-front diventa
la scelta nettamente preferibile. Viceversa, in presenza di
grave osteoporosi, la bilancia tende a spostarsi a favore del
regime sequenziale. Nei casi di intolleranza importante agli
IA, il tamoxifene rimane una valida opzione terapeutica
(visto che è solo moderatamente inferiore agli IA), sia da
solo, sia nell’ambito di un regime sequenziale invertito
IA tamoxifene (Godhirsch et al., 2011).
Una discussione a parte meritano i regimi cosiddetti extended,
in cui lo IA è somministrato per 3-5 anni al termine di 5
anni di tamoxifene e, quindi, per una durata complessiva
di terapia adiuvante fino a 10 anni. Il maggior studio randomizzato a sostegno di questo tipo di regime è lo studio
MA.17 (2005) che dimostra chiaramente come, nelle donne che hanno ricevuto 5 anni di tamoxifene senza andare
incontro a recidiva, l’aggiunta di 5 anni di letrozolo riduce
ulteriormente il rischio residuo di recidiva di circa il 40%.
La sopravvivenza, tuttavia, migliora marginalmente solo
nel sottogruppo di pazienti con metastasi ai linfonodi
ascellari. Questo regime, tuttavia, trova poco spazio nella
pratica clinica perché, per limitare al massimo il rischio
di recidiva nei primi 5 anni, la maggior parte delle pazienti riceve un regime up-front o sequenza/switch e non
esistono, al momento, dati di efficacia e tollerabilità per
prolungare ulteriormente il trattamento endocrino oltre i
5 anni con questi regimi. Tuttavia, un trattamento extended
con IA andrebbe specificamente preso in considerazione
in quelle donne che iniziano il trattamento adiuvante con
tamoxifene in età fertile e che si ritrovano chiaramente
postmenopausali al termine dei 5 anni di trattamento, in
particolare se il tumore era N+ (Godhirsch et al., 2011).
Terapia a bersaglio molecolare
L’unico farmaco della categoria attualmente registrato per
l’impiego adiuvante è il trastuzumab; si tratta di un anticorpo monoclonale diretto contro il dominio extracellulare
del recettore HER2. Di per sé ha attività moderata contro
il carcinoma mammario HER2+, ma sinergizza fortemente
con i regimi chemioterapici. Tuttavia, per la sua intrinseca
cardiotossicità, non può essere somministrato a pazienti
con una frazione di eiezione ventricolare inferiore alla norma. Inoltre, e per la sua capacità di potenziare la cardiotossicità da antracicline, la somministrazione contemporanea
a questi citotossici è controindicata.
N e o p lasi e della mammella
Varie sperimentazioni cliniche randomizzate, che complessivamente hanno arruolato circa 15.000 donne, hanno
dimostrato che la somministrazione di trastuzumab adiuvante in donne con tumore HER2+ che avevano ricevuto
chemioterapia adiuvante riduce il rischio di recidiva di un
45-50% e la mortalità di circa il 35-45%. La somministrazione standard di trastuzumab prevede 1 anno di trattamento (18 somministrazioni ogni 3 settimane) e la terapia
con trastuzumab può essere cominciata o in sequenza,
dopo il termine della chemioterapia, o in contemporanea
alla chemioterapia. Il regime chemioterapico preferibile,
in quest’ultimo caso, è il regime blocco-sequenziale AC o
(EC) taxano (docetaxel trisettimanale o paclitaxel settimanale) in cui il trastuzumab viene iniziato sul secondo
blocco, in contemporanea con il taxano. Uno studio randomizzato (NCCTG N9831) ha confrontato direttamente
l’efficacia e la tollerabilità della somministrazione contemporanea alla chemioterapia rispetto a quella sequenziale
(Perez et al., 2010) e ha dimostrato che la somministrazione contemporanea è più efficace di quella sequenziale
in termini di riduzione del rischio di recidiva. Tuttavia,
questa modalità di somministrazione produce un lieve
incremento della cardiotossicità, con una percentuale di
insufficienza cardiaca congestizia pari a 2,2%, nel regime
contemporaneo, versus l’1,5%, nel regime sequenziale.
Riconciliando tutti i dati disponibili si può affermare che
il regime contemporaneo è la migliore scelta nelle donne a
rischio moderato-alto, in particolare quando non vi siano
particolari fattori di rischio per cardiotossicità, mentre il
regime sequenziale rappresenta una scelta opportuna nei
casi a rischio basso e/o in presenza di fattori di rischio
cardiovascolare (per esempio, età avanzata, ipertensione,
sindrome metabolica ecc.). Proprio al fine di limitare la
cardiotossicità, nello studio BCIRG 006 è stato sperimentato un regime chemioterapico completamente privo di
antracicline (TCH: docetaxel, carboplatino e trastuzumab).
Il regime è risultato efficace, ma tendenzialmente inferiore,
seppure in maniera non significativa, rispetto al classico
regime blocco-sequenziale AC docetaxel + trastuzumab
(Slamon et al., 2011). Tuttavia, per la sua bassissima cardiotossicità, questo regime rappresenta una valida opzione
terapeutica nelle donne a rischio moderato-basso e/o in
presenza di fattori di rischio cardiovascolare aggiuntivi
(Goldhirsch et al., 2011).
TERAPIA DELLA MALATTIA
LOCALMENTE AVANZATA
Il termine di carcinoma mammario localmente avanzato comprende un gruppo eterogeneo di tumori, che
corrispondono allo stadio III, come definito dal sistema
di stadiazione dell’American Joint Cancer Committee.
Sono comprese in questa definizione situazioni cliniche
molto diverse tra loro e per le quali la strategia terapeutica
ottimale deve essere valutata di volta in volta, su base multidisciplinare. Tuttavia, in linea di principio, l’intervento
chirurgico di prima istanza è controindicato, perché tecnicamente non fattibile o perché insoddisfacente in termini
di risultati terapeutici, nella maggior parte dei tumori in
stadio III.
283
Capitolo 8
Neo p la sie d ella m a m m ella
In presenza di stadio IIIA per effetto di linfonodi ascellari
fissi a struttura (N2) o di stadio IIIB per effetto di fissità
del nodulo alla parete toracica, edema o ulcerazione della
cute, presenza di noduli cutanei satelliti, o per carcinoma
infiammatorio (T4), è indicata una strategia terapeutica
integrata, che consiste in una chemioterapia primaria o
neoadiuvante, seguita da chirurgia o radioterapia, a loro
volta eventualmente seguite da altri cicli di chemioterapia. Generalmente, i regimi impiegati in chemioterapia
primaria sono gli stessi previsti per la terapia adiuvante
(Goldhirsch et al., 2011) e, in particolare, quelli comprendenti un’antraciclina e un taxano, preferibilmente in un
regime blocco-sequenziale. Tali regimi possono essere
somministrati interamente in fase preoperatoria. Questa
modalità di terapia è in grado di indurre il 70-90% di remissioni, di cui un 5-15% di remissioni complete anatomopatologiche (cioè di completa scomparsa del tumore
al successivo esame istologico del parenchima mammario
rimosso). In alternativa, una volta raggiunta l’operabilità, si
può inviare la paziente alla chirurgia, per poi completare il
regime chemioterapico nella fase postchirurgica. Nel caso
di tumori HER2+ è indicata l’associazione di trastuzumab
alla chemioterapia. In questo caso il trastuzumab viene
proseguito nel postoperatorio fino al completamento del
trattamento standard di 1 anno. La percentuale di risposte
complete patologiche raggiunge, in questi casi, il 40-50%
(Gianni et al., 2010).
Nei casi in cui la malattia è rimasta inoperabile si pratica
una radioterapia per ottenere un controllo locale. Se, invece, la malattia è rientrata nei limiti tecnici di operabilità,
il trattamento preferibile è la mastectomia o, in casi selezionati, la chirurgia conservativa seguita da radioterapia
sul parenchima mammario residuo. Alla mastectomia, può
essere fatta seguire la radioterapia sulla parete toracica (che
viene in genere praticata dopo l’eventuale chemioterapia
postchirurgica).
La sopravvivenza a 5 anni è in media circa il 50% delle
pazienti, ma con ampia variabilità a seconda della situazione clinica e della risposta alla chemioterapia primaria.
In particolare, le pazienti che vanno incontro a una remissione completa patologica hanno una sopravvivenza
sostanzialmente migliore.
Paziente
Malattia
Carico tumorale
Intervallo libero
da malattia
Trattamento
FIG. 8.27 Fattori che influenzano il processo decisionale nel trattamento
del carcinoma mammario metastatico.
o dell’altro trattamento dipende da diversi fattori la cui
analisi assume un significato cruciale nel processo decisionale (Fig. 8.27).
L’avanzamento delle conoscenze in termini di biologia
tumorale e lo sviluppo parallelo di nuovi agenti antitumorali diretti contro determinati bersagli molecolari
(targeted therapies) ha reso particolarmente complessi ma al
contempo più efficienti gli algoritmi terapeutici. L’intento
di perseguire un approccio personalizzato in funzione
della specifica situazione clinica coniuga informazioni relative alle caratteristiche patologiche, immunofenotipiche
e molecolari del tumore con valutazioni che riguardano
il paziente (aspettative di cura, desideri, comorbilità, età,
stato menopausale ecc.).
Negli ultimi anni, grazie agli avanzamenti ottenuti in
campo sia diagnostico sia terapeutico, si è assistito a un
graduale incremento della sopravvivenza mediana delle pazienti con carcinoma mammario metastatico (Fig.
8.28) (Giordano et al., 2004; Chia et al., 2007). Tuttavia,
sebbene sia riportata una percentuale esigua di lungosopravviventi, l’intento della terapia rimane a tutt’oggi
palliativo. Fra gli scopi principali del trattamento, l’incremento della sopravvivenza globale, della sopravvivenza libera da progressione e della sopravvivenza libera
TERAPIA DELLA MALATTIA
METASTATICA
Circa il 5-10% dei carcinomi mammari si presenta in stadio avanzato alla diagnosi. Inoltre, circa un quinto delle
pazienti con diagnosi di carcinoma mammario metastatico
sopravvivrà fino a 5 anni.
A seguito di una diagnosi di carcinoma mammario in stadio precoce, in base ai diversi fattori prognostici, fino al
30% e fino al 70% delle pazienti sperimenterà una recidiva
rispettivamente in assenza o in presenza di un pregresso
coinvolgimento linfonodale (Cardoso et al., 2012b).
Le opzioni di trattamento sistemico del carcinoma mammario in stadio avanzato includono l’endocrinoterapia,
la chemioterapia, i farmaci biologici e le possibili combinazioni tra queste modalità terapeutiche (Cardoso
et al., 2012b; Andreetta et al., 2010). La selezione di uno
Sopravvivenza cumulativa
284
0,8
0,6
1990-1994
1995-2000
0,4
1985-1989
0,2
1980-1984
1974-1979
0,0
0
12
24
36
48
60
Mesi
FIG. 8.28 Miglioramento della sopravvivenza in pazienti con carcinoma
mammario metastatico negli anni. Giordano SH, Buzdar AU, Smith TL et al. Is
breast cancer survival improving? Cancer 2004;100:44-52.
Ca pito l o 8
da sintomi sono da considerarsi i più rilevanti, insieme
all’obiettivo implicito di garantire la migliore qualità di
vita possibile alle pazienti.
Nella scelta fra le diverse opzioni di terapia, l’oncologo
medico segue un processo decisionale, strutturato in modo analitico-sintetico, il cui esito si traduce in proposta
terapeutica (Puglisi et al., 2006).
Da un punto di vista metodologico, possono essere descritti i seguenti passaggi principali:
1.
2.
3.
4.
5.
6.
7.
analisi delle caratteristiche della patologia tumorale;
analisi delle caratteristiche cliniche;
analisi della letteratura scientifica;
interpretazione dei dati della letteratura scientifica;
proposta terapeutica;
discussione interattiva medico-paziente;
decisione terapeutica.
Analisi delle caratteristiche della patologia tumorale
Vi è crescente evidenza che la patologia tumorale mammaria sia caratterizzata da una variabilità biologica a cui
corrisponde una variabilità di comportamento clinico
(Kennecke et al., 2010). Fra i diversi parametri biomolecolari che definiscono specifici sottogruppi, lo stato dei
recettori ormonali (estrogenici e progestinici) e lo stato
di HER2 sono considerati i più rilevanti per indirizzare la
scelta terapeutica (Fig. 8.29).
In particolare, l’espressione dei recettori ormonali identifica una patologia generalmente a prognosi più favorevole
e con potenziale endocrino-sensibilità. In tali situazioni,
N e o p lasi e della mammella
in assenza di un carico elevato di malattia, un trattamento
antiormonale può essere preso in considerazione nelle
prime linee di trattamento. Infatti, la positività per i recettori ormonali costituisce un fattore predittivo di beneficio
terapeutico dagli agenti che interferiscono con lo stimolo
ormonale (antiestrogeni, agonisti LHRH, inibitori dell’aromatasi, fulvestrant, progestinici).
Lo stato di HER2 è un altro parametro altrettanto rilevante e condizionante le scelte terapeutiche. I tumori HER2
positivi, definiti tali sulla base dell’iperespressione del
recettore documentata con metodica immunoistochimica
o dell’amplificazione del gene HER2/neu all’esame FISH
o CISH, si caratterizzano per un comportamento clinico
maggiormente aggressivo. Tuttavia, la prognosi è ribaltata
in senso favorevole dall’impiego sequenziale di terapie
anti-HER2 (trastuzumab, pertuzumab, lapatinib, T-DM1)
in associazione alla chemioterapia e/o alla terapia endocrina (associazione di trastuzumab o lapatinib con inibitori
dell’aromatasi) (Dawood et al., 2010; Puglisi et al., 2012).
In altri termini, l’HER2 positività costituisce un fattore prognostico sfavorevole e, al contempo, un fattore predittivo
di beneficio terapeutico dai farmaci anti-HER2.
La patologia a oggi considerata a prognosi peggiore e per la
quale non esiste che l’unica opzione della chemioterapia,
eventualmente associata all’agente antiangiogenico bevacizumab, è il carcinoma mammario cosiddetto “triple negative” caratterizzato dall’assenza di espressione di entrambi i
recettori ormonali e dall’assenza di iperespressione/amplificazione di HER2. Pertanto, gli studi sulla patologia triple
negative si stanno attualmente focalizzando sulla ricerca di
potenziali bersagli alternativi, quali l’espressione dei recet-
Carcinoma mammario avanzato
Recettori ormonali positivi
Recettori ormonali negativi
HER2–
HER2+
HER2+
HER2–
Endocrinoterapia
SERM (tamoxifene)
SERD (fulvestrant)
Inibitori dell’aromatasi (AI)
Soppressione ovarica (LHRH analoghi)
Lapatinib + Al
Trastuzumab + Al
Trastuzumab + taxani
+/– pertuzumab
Chemioterapia*
Inibitore
dell’aromatasi
+ inibitore
di mTOR
(everolimus)
T-DM1
Lapatinib + trastuzumab?
Lapatinib + capecitabina?
Paclitaxel +/– bevacizumab,
Antracicline (doxorubicina,
epirubicina, doxorubicina
liposomiale), taxani (paclitaxel,
docetaxel, nab-paclitaxel),
capecitabina, eribulina,
vinorelbina, gemcitabina
* monoterapia o combinazione
Chemioterapia*
*L'uso sequenziale di agenti singoli (monoterapia) viene perlopiù proposto nei tumori con espressione dei recettori ormonali,
dopo diverse linee di terapia endocrina e in caso di malattia a lenta crescita. La polichemioterapia viene proposta principalmente nei carcinomi
con immunofenotipo "triple negative", in caso di malattia rapidamente progressiva e in pazienti con patologia localmente avanzata.
FIG. 8.29 Algoritmo decisionale basato sulle caratteristiche della patologia tumorale. SERM, modulatori selettivi del recettore per gli estrogeni; SERD, down-regolatori
selettivi del recettore per gli estrogeni; LHRH, ormone rilasciante l’ormone luteinizzante.
285
286
Capitolo 8
Neo p la sie d ella m a m m ella
tori androgenici o alcune caratteristiche molecolari delle
cellule con genotipo basal-like o mesenchimal stem cell-like.
Un tema di crescente interesse scientifico per le possibili
implicazioni clinico-terapeutiche è quello dell’indicazione alla biopsia delle metastasi. I principali intenti della
biopsia sono la conferma diagnostica e la ridefinizione dell’immunofenotipo (stato recettoriale e di HER2),
con la potenzialità di ampliare il ventaglio di opzioni
terapeutiche (Vignot et al., 2012; Foukakis et al., 2012;
Macfarlane et al., 2012). Infatti, vi è evidenza che in circa
un caso su tre o su quattro la biologia della metastasi
può risultare differente rispetto a quella della neoplasia
primitiva. In tali situazioni, la decisione terapeutica si
basa sull’informazione che offre maggiori possibilità di
cura per la paziente.
L’estensione della patologia tumorale (definita anche come
“carico tumorale”, traduzione del termine inglese “tumor
burden”), l’identificazione di un’eventuale malattia oligometastatica (numero limitato di sedi metastatiche), la caratterizzazione delle sedi di interessamento metastatico (malattia viscerale versus malattia ossea e/o dei tessuti molli)
sono tutti elementi che vengono presi in considerazione
nel processo decisionale terapeutico.
Analisi delle caratteristiche cliniche
Fra le principali caratteristiche della paziente che possono
influenzare le scelte terapeutiche, le seguenti assumono un
significato di primaria importanza:
●
●
●
●
●
performance status (correlazione con la prognosi e la
tollerabilità dei trattamenti);
età (determinazione dell’età biologica rispetto all’età
anagrafica, con valutazione geriatrica multidimensionale);
presenza di patologie ed eventuali terapie concomitanti
(stima dell’aspettativa di vita, valutazione di potenziali
interazioni farmacologiche);
trattamenti antitumorali ricevuti in precedenza (prevenzione di eventuali forme di tossicità dose-dipendente,
considerazioni sul re-challenge in funzione del diseasefree interval);
stato menopausale (terapie limitate allo stato di premenopausa o postmenopausa, considerazioni riguardo a
metodi di contraccezione).
Interpretazione dei dati della letteratura scientifica
Gli studi di fase III si prefiggono di valutare se un farmaco
sperimentale o una nuova combinazione di farmaci sia
in grado di indurre un beneficio, rispetto al cosiddetto
standard. L’obiettivo primario di uno studio di fase III, è
pertanto quello di confrontare l’efficacia di un trattamento
sperimentale rispetto al trattamento standard, al placebo
o alla best supportive care (nel caso in cui non esista alcun
trattamento specifico che sia valido per la condizione clinica in esame).
In base al disegno sperimentale, si distinguono in:
●
studi di superiorità, volti a verificare una differenza in
termini di efficacia tra i trattamenti;
●
studi di equivalenza, volti a verificare una pari efficacia
tra i trattamenti, posto un ragionevole vantaggio in
termini di tollerabilità.
Nella patologia metastatica, per la valutazione dell’efficacia
terapeutica, gli indicatori (end-point) più frequentemente
utilizzati sono i seguenti:
●
●
●
PFS (progression-free survival): sopravvivenza libera da
progressione, equivalente all’intervallo dalla randomizzazione fino all’evento (morte o progressione);
TTP (time to progression): tempo alla progressione, equivalente all’intervallo dalla randomizzazione fino all’evento (progressione);
OS (overall survival): sopravvivenza globale, equivalente
all’intervallo dalla randomizzazione fino all’evento
(morte).
Per verificare l’obiettivo primario si definisce un parametro
di riferimento (primary end-point) che avrà le caratteristiche
di tipo “tempo a evento” (event time) e sul quale si baserà
la definizione del campione. In particolare, la numerosità
campionaria deve essere tale da consentire di osservare,
nell’intervallo di durata dello studio, un numero sufficiente di eventi (progressione, morte).
Sebbene vi sia un accordo unanime nel considerare la OS
un obiettivo rilevante dal punto di vista clinico, è stato
osservato come sia particolarmente difficile dimostrare
un vantaggio in OS nei trial che analizzano i diversi trattamenti per il carcinoma mammario metastatico, specie
nella prima linea di trattamento. In particolare, la numerosità campionaria richiesta per garantire un’adeguata
potenza statistica potrebbe essere particolarmente elevata
e difficilmente ottenibile anche in studi internazionali e
multicentrici.
La SPP (survival post progression), ovvero l’intervallo di tempo che va dall’evento progressione all’evento morte, è un
concetto di recente valorizzazione nella metodologia clinica (Broglio e Berry, 2009). Attraverso analisi simulate, è
stato dimostrato che esiste una correlazione assoluta tra
hazard ratio (HR) di OS e HR di PFS quando la SPP è uguale
a 0, ovvero quando l’evento registrato dalla PFS coincide
con la morte, mentre la correlazione tra HR di OS e HR
della PFS diventa sempre più debole a mano a mano che la
SPP aumenta. Pertanto, al crescere della SPP, la probabilità
di evidenziare una differenza in termini di OS si riduce.
In particolare, in studi con un vantaggio documentato di
PFS, la probabilità di osservare un vantaggio anche in OS
sarà superiore al 90% per una durata di SPP intorno ai 2
mesi, mentre sarà inferiore al 20% se la durata del SPP è
dell’ordine dei 24 mesi. Per incrementare la probabilità di
evidenziare un vantaggio in OS potrebbe essere necessario
allocare un numero diverso di pazienti a seconda della durata della SPP. Per esempio, in uno studio che sia in grado
di dimostrare un vantaggio di 3 mesi in PFS analizzando
280 pazienti, sarebbe necessario arruolare circa 2.500 pazienti per dimostrare un vantaggio in OS in presenza di
una SPP di 24 mesi. Viceversa, sarebbe sufficiente un campione di circa 350 pazienti per dimostrare un vantaggio in
OS, se la SPP fosse di soli 2 mesi. Tali considerazioni sono
molto importanti quando si analizzano i risultati di uno
Ca pito l o 8
studio clinico. Talvolta, infatti, l’assenza di un documentato vantaggio in OS non significa che il farmaco sia poco
efficace ma unicamente che sia stato metodologicamente
impossibile evidenziarne il beneficio in termini di sopravvivenza globale.
Proposta terapeutica e discussione interattiva
medico-paziente
Nell’esplicitare la proposta terapeutica alla paziente, l’oncologo medico deve sottolineare intenti e obiettivi del trattamento e informare in merito agli aspetti di tollerabilità
(stima degli effetti collaterali ed eventuale istruzione sulla
gestione degli stessi) e alle modalità di somministrazione
(durata, numero degli accessi in ospedale, eventuale necessità di ricovero).
Le diverse opzioni terapeutiche devono essere presentate
in termini di benefici attesi e di rischio di incorrere in effetti indesiderati. I desideri della paziente vanno ascoltati
e rispettati.
La discussione interattiva dovrebbe essere condotta avendo
presente il concetto di strategia terapeutica, cioè intravedendo i passaggi successivi (sequenza di diverse linee di
trattamento) e focalizzando sulla priorità di una scelta
rispetto alle alternative.
Il trattamento del carcinoma mammario metastatico richiede una conoscenza approfondita della letteratura
scientifica in merito alla biologia tumorale e alle implicazioni cliniche della stessa (studi di ricerca traslazionale su
fattori prognostici e predittivi). Inoltre, la letteratura sui
farmaci (endocrinoterapia, chemioterapia, farmaci biologici) è sempre più articolata e in continua evoluzione dal
punto di vista metodologico. La valutazione dei risultati
di un trial clinico non deve prescindere da un’analisi critica degli end-point primari e secondari scelti nel disegno
dello studio stesso. Talvolta, l’evidenza scientifica non è
direttamente disponibile e le scelte terapeutiche richiedono
particolare esperienza clinica, da associare sempre al buon
senso e a un grado elevato di umanizzazione.
Opzioni terapeutiche
Sulle base delle considerazioni precedenti, è chiaro come non esista un trattamento standard del carcinoma
mammario avanzato. La terapia è pertanto adattata alla
situazione clinica e alle caratteristiche della paziente e
della patologia. Per quanto attiene alla chemioterapia, in
termini di sopravvivenza, l’uso sequenziale di agenti singoli è nella maggioranza dei casi equivalente alla terapia
di combinazione (Cardoso et al., 2009). Ne consegue che
quest’ultima viene riservata alle situazioni in cui è richiesta
una risposta (riduzione del volume tumorale) in tempi
brevi. Pertanto, in pazienti in cui la malattia non mostra
una tendenza alla rapida progressione e per le quali il trattamento endocrino non è indicato, la chemioterapia con
agente singolo rappresenta la prima scelta terapeutica. La
durata di ciascun regime e il numero di cicli da somministrare vengono stabiliti in base agli agenti chemioterapici
impiegati, tenendo conto della tossicità cumulativa degli
stessi e avendo cura di rispettare la qualità di vita della
paziente (tollerabilità su base individuale).
N e o p lasi e della mammella
TABELLA 8.15 Agenti endocrini impiegati
in monoterapia o in combinazione nel trattamento
del carcinoma mammario metastatico
Modulatori selettivi dei recettori estrogenici
t Tamoxifene
t Toremifene
Deregolatore del recettore estrogenico
t Fulvestrant
Agonisti LHRH
t Goserelin
t Triptorelin
t Leuprorelina
Antiaromatasi
t Non steroidei (anastrozolo, letrozolo)
t Steroidei (exemestane)
Progestinici
t Megestrolo acetato
t Medrossiprogesterone acetato
LHRH: ormone rilasciante l’ormone luteinizzante.
Nelle pazienti in cui il tumore presenta espressione dei
recettori ormonali e assenza di iperespressione/amplificazione di HER2, la terapia endocrina è l’opzione da preferire
indipendentemente dalle sedi di malattia ma a condizione
che non sia richiesta una risposta terapeutica in tempi rapidi (Cardoso et al., 2012a). Generalmente, il trattamento
ormonale è ben tollerato e pertanto viene proseguito fino
a evidente progressione di malattia.
Le diverse opzioni di terapia endocrina sono riassunte nella
tabella 8.15. La scelta dell’agente da impiegare è basata sullo stato menopausale, sulla presenza di controindicazioni
specifiche, sul profilo di tossicità del farmaco e sulla terapia
eventualmente impiegata in fase adiuvante.
In particolare, in pazienti in stato premenopausale nelle
quali non era stato precedentemente utilizzato il tamoxifene o nelle quali l’antiestrogeno era stato sospeso da oltre
un anno, il tamoxifene, eventualmente in combinazione
con l’ablazione/soppressione ovarica (agonista del LHRH,
ovariectomia o radioterapia sulle gonadi), è l’opzione
terapeutica di scelta. Le linee successive non differiscono
da quanto impiegato in postmenopausa (si veda oltre).
Nelle donne in postmenopausa, gli inibitori dell’aromatasi
non steroidei (anastrozolo, letrozolo) o steroidei (exemestano) sono le opzioni da preferire se non precedentemente impiegati o se interrotti da oltre un anno. Tale
indicazione si basa sull’evidenza di superiorità rispetto
al tamoxifene in termini di tasso di risposta, tempo alla
progressione e, per il letrozolo, sopravvivenza a 2 anni. In
caso di progressione a un inibitore steroideo è preferibile
impiegare un agente non steroideo e viceversa. Tra le altre
opzioni, il tamoxifene rimane una scelta accettabile anche
come prima linea di trattamento insieme al fulvestrant
che, alla dose di 500 mg ogni 4 settimane, ha dimostrato
una superiorità rispetto all’anastrozolo. Le linee di terapia
ormonale successive alla prima sono condizionate dalla
scelta terapeutica effettuata in prima linea e comprendono:
287
288
Capitolo 8
Neo p la sie d ella m a m m ella
tamoxifene, inibitore dell’aromatasi di classe differente
rispetto a quella impiegata in precedenza, fulvestrant e
progestinici (per esempio, megestrolo acetato e medrossiprogesterone acetato). Recentemente, è stato dimostrato
che l’aggiunta di un inibitore di m-TOR, l’everolimus, a un
antiaromatasi steroideo o al tamoxifene è in grado di migliorare l’outcome, se confrontato con la terapia endocrina
da sola, in pazienti che sperimentano una progressione
durante o dopo una terapia con inibitori dell’aromatasi.
(Baselga et al., 2012a).
In pazienti con evidenza di endocrino-resistenza (de novo
o acquisita) il trattamento si avvale della chemioterapia
(Tab. 8.16). La scelta della prima linea, così come osservato per la terapia endocrina, è condizionata dalla terapia
utilizzata in fase adiuvante. Pertanto, i taxani (paclitaxel,
docetaxel, nab-paclitaxel) sono da preferire in caso di precedenti trattamenti a base di antracicline.
Nelle forme più aggressive caratterizzate da un carico di
malattia elevato, una combinazione di agenti chemioterapici può essere vantaggiosa. Un’opzione ulteriore da
adottare in prima linea consiste nell’agente antiangiogenico bevacizumab che, combinato con un taxano o con
capecitabina, ha dimostrato una superiorità in termini
di sopravvivenza libera da progressione rispetto alla sola
chemioterapia (Gray et al., 2009; Miles et al., 2010; Robert
et al., 2011). La mancata dimostrazione di un vantaggio
TABELLA 8.16 Agenti chemioterapici impiegati
in monoterapia o in combinazione nel trattamento
del carcinoma mammario metastatico
A base di antracicline
t Doxorubicina o epirubicina in monoterapia (schedula
settimanale o trisettimanale)
t Doxorubicina + ciclofosfamide (AC) o epirubicina +
ciclofosfamide (EC)
t Doxorubicina liposomiale (monoterapia) o in combinazione
con ciclofosfamide
t Fluorouracile + doxorubicina + ciclofosfamide (FAC)
t Fluorouracile + epirubicina + ciclofosfamide (FEC)
A base di taxani
t Paclitaxel settimanale in monoterapia
t Paclitaxel settimanale in combinazione con bevacizumab
t Docetaxel trisettimanale o settimanale in monoterapia
t Nab-paclitaxel
t Combinazione antracicline + taxani
t Docetaxel + capecitabina
t Paclitaxel + gemcitabina
t Paclitaxel + vinorelbina
t Paclitaxel + carboplatino
Agenti singoli
t Capecitabina
t Eribulina
t Vinorelbina
Altre combinazioni
t A base di platino (cisplatino + 5-fluorouracile;
carboplatino + gemcitabina)
t Ciclofosfamide + metotrexato + fluorouracile (CMF)
t Capecitabina + vinorelbina
t Ciclofosfamide orale con metotrexato orale
(regime metronomico)
in sopravvivenza globale, sebbene verosimilmente legata
ad aspetti di ordine metodologico, ha reso controverso il
riconoscimento di un reale vantaggio della combinazione
bevacizumab/chemioterapia e ne suggerisce un impiego
limitato a casi selezionati previa valutazione attenta del
rapporto costo/beneficio.
Le linee chemioterapiche successive alla prima possono
includere i diversi farmaci con dimostrata attività terapeutica nel carcinoma mammario metastatico (antracicline,
capecitabina, eribulina, vinorelbina, gemcitabina ecc.).
In pazienti con carcinoma mammario HER2 positivo,
la scelta si sposta verso la combinazione di una terapia
anti-HER2 (trastuzumab, pertuzumab, lapatinib) con la
chemioterapia e, in casi selezionati con concomitante
espressione dei recettori ormonali, si adotta la combinazione terapia endocrina in associazione a trastuzumab o
lapatinib (Puglisi et al., 2012; Arteaga et al., 2011).
In prima linea, l’aggiunta del pertuzumab alla combinazione di trastuzumab e docetaxel ha dimostrato un vantaggio
in termini di tasso di risposta, sopravvivenza libera da progressione e sopravvivenza globale (Baselga et al., 2012b).
Tuttavia, la trasferibilità e la generalizzabilità dei risultati
dello studio con il pertuzumab sono incerte dal momento
che la popolazione analizzata non viene considerata rappresentativa di quanto si osserva nella pratica clinica corrente.
In particolare, solo il 10% delle pazienti dello studio aveva
ricevuto trastuzumab e circa il 50% delle pazienti non era
stato trattato con antracicline e taxani in fase adiuvante.
Recentemente, l’impiego di un immunoconiugato, il TDM1, si è dimostrato vantaggioso in termini di tasso di
risposta, tempo alla progressione e sopravvivenza rispetto
alla combinazione di capecitabina e lapatinib (Verma et
al., 2012). Inoltre, il T-DM1 ha evidenziato un profilo di
tossicità talmente favorevole da rendere molto probabile
una sua collocazione nel trattamento di seconda linea del
carcinoma mammario metastatico HER2 positivo.
Nelle linee successive, mantenere il blocco di HER2 con
il trastuzumab modificando l’agente chemioterapico di
affiancamento è considerato una strategia terapeutica proficua pur in assenza di un’evidenza scientifica formalmente
solida (Pegram e Liao, 2012).
In particolare, la combinazione di lapatinib e capecitabina si è dimostrata superiore rispetto alla sola capecitabina in termini di tempo alla progressione in pazienti
precedentemente trattate con trastuzumab, antracicline
o taxani (Cameron et al., 2010). Non è noto, tuttavia, se
la combinazione capecitabina/lapatinib sia da preferire
alla strategia di mantenere il trastuzumab modificando il
partner chemioterapico.
Infine, a sostegno dell’importanza di mantenere un blocco
di HER2 con il trastuzumab in pazienti già trattate con
trastuzumab, uno studio ha dimostrato la superiorità in
termini di sopravvivenza globale della combinazione lapatinib/trastuzumab rispetto alla monoterapia con lapatinib
(Blackwell et al., 2012). Lo studio, condotto in pazienti
pretrattate con diverse linee di terapia, aveva come prerequisito un pregresso trattamento con trastuzumab, antracicline e taxani.
Ca pito l o 8
In pazienti con metastasi ossee, l’impiego di bifosfonati (per
esempio, acido zoledronico) o di denosumab (anticorpo
anti-RANKL ligando) trova indicazione al fine di ridurre il
rischio di complicanze (fratture, dolore, ipercalcemia ecc.)
(Wong et al., 2012). Particolare attenzione va posta alla prevenzione degli effetti collaterali di tali farmaci (insufficienza
renale, osteonecrosi mandibolare), adattandone l’impiego
e la durata alle situazioni cliniche specifiche.
In casi particolari, previa valutazione specialistica multidisciplinare, il trattamento delle metastasi ossee può giovare
del ricorso alla radioterapia o dell’impiego di radioisotopi.
In pazienti con metastasi encefaliche, la radioterapia panencefalica trova indicazione in presenza di un coinvolgimento esteso (lesioni multiple e/o di grandi dimensioni).
Viceversa, in presenza di uno o pochi foci metastatici, la
resezione chirurgica o la radiochirurgia stereotassica costituiscono valide alternative terapeutiche (Lim e Lin, 2012).
FOLLOWUP
Gli obiettivi principali del follow-up nel carcinoma mammario riprendono quelli generici applicabili alle diverse
patologie oncologiche e assumono alcune peculiarità specifiche (Hayes, 2007):
●
●
●
prevenzione e diagnosi precoce di nuovi tumori mammari e di eventuali recidive ancora suscettibili di trattamento con intento radicale;
sorveglianza per le recidive a distanza o per l’insorgenza
di tumori in altre sedi (per esempio, ovaio, colon-retto,
utero);
prevenzione e sorveglianza degli effetti collaterali fisici
e psicologici delle terapie oncologiche.
Convenzionalmente, il follow-up del carcinoma mammario consiste nel ricorso a esami clinici periodici e nell’esecuzione di una mammografia annuale.
A oggi, infatti, non è stata prodotta alcuna evidenza
scientifica a sostegno di un follow-up più intensivo e
tale pratica, in assenza di beneficio, andrebbe scoraggiata. Recentemente, l’ASCO (American Society of Clinical
Oncology) ha incluso il follow-up del carcinoma mammario nella lista delle prime cinque attività oncologiche
che potrebbero essere migliorate e semplificate al fine
di limitare costi ingiustificati (Schnipper et al., 2012).
Follow-up
FIG. 8.30 Follow-up del carcinoma
mammario.
N e o p lasi e della mammella
Secondo l’ASCO (Khatcheressian et al., 2013; Khatcheressian et al., 2006) e sostanzialmente in linea con quanto
raccomandato da altre società scientifiche come l’ESMO
(European Society of Medical Oncology) e l’AIOM (Associazione Italiana di Oncologia Medica), la visita medica
periodica e la mammografia annuale costituiscono i
fondamenti di un follow-up ottimale. In sintesi, le linee
guida ASCO suggeriscono di effettuare un esame clinico
ogni 3-6 mesi nei primi 3 anni dopo la diagnosi, ogni
6-12 mesi tra il terzo e il quinto anno dalla diagnosi e su
base annua dopo il quinto anno. La prima mammografia
di controllo viene consigliata non prima di 6 mesi dal
completamento del trattamento radioterapico sul parenchima mammario residuo e, quindi, circa 9-12 mesi
dopo l’intervento chirurgico. Successivamente, è raccomandato un controllo mammografico annuale. Sebbene
non siano disponibili riferimenti scientifici in merito
all’età alla quale sospendere i controlli mammografici,
è noto come nelle donne più anziane la mammografia
sia caratterizzata da una sensibilità elevata (Lash et al.,
2007).
Ne consegue che la decisione sull’eventuale sospensione
dei controlli annuali viene effettuata su base individuale, valutando situazione clinica e aspettativa di vita della
paziente.
Tra le altre indagini diagnostiche sulla mammella, l’ecografia può costituire un valido complemento in presenza
di mammelle “mammograficamente dense” (Nothacker
et al., 2009). Inoltre, il ricorso alla risonanza magnetica
mammaria è consigliato in donne portatrici di mutazione
a livello dei geni BRCA1 e BRCA2 con aumentato rischio
di secondo tumore primitivo a livello sia ipsilaterale sia
controlaterale (Warner et al., 2011).
Attualmente, in assenza di sintomi o segni clinici che richiedano un approfondimento diagnostico, le linee guida
delle diverse società scientifiche non supportano il ricorso
a esami ematochimici (esame emocromocitometrico, profilo epato-renale, marcatori tumorali) ed esami radiologici
(radiografia del torace, scintigrafia ossea, ecografia epatica,
tomografia computerizzata multidistrettuale, tomografia
a emissione di positroni ecc.). Tali raccomandazioni si
basano sui risultati di studi randomizzati che, tuttavia,
risalgono ad anni in cui si disponeva di minori opzioni
Mammografia annuale.
Visita clinica ogni 3-6 mesi
per i primi 5 anni poi ogni 12 mesi
Altri esami sulla base
di sospetto clinico
Tamoxifene
Esami
ginecologici
su indicazione
clinica
Antiaromatasi
Densitometria
ossea
su indicazione
clinica
Se terapia
ormonale
289
290
Capitolo 8
Neo p la sie d ella m a m m ella
diagnostico-terapeutiche e di informazioni limitate riguardo alla biologia tumorale (GIVIO Investigators, 1994; Palli
et al., 1999; Rosselli Del Turco et al., 1994).
In particolare, oggi è noto che il rischio di recidiva è funzione dell’immunofenotipo. Per esempio, tumori con
espressione dei recettori ormonali presentano un rischio
di recidiva minore ma più prolungato nel tempo (Davies et
al., 2011). Viceversa, la patologia cosiddetta “triple negative”
(assenza di espressione dei recettori ormonali e di iperespressione/amplificazione di HER2) presenta un pattern
di recidiva caratterizzato da un rischio più elevato che si
concentra nei primi 2 anni dalla diagnosi e si riduce in
modo sostanziale negli anni successivi (Dent et al., 2009;
Jatoi et al., 2011). Sulla base di tali premesse, è sentita la
necessità di disegnare nuovi studi rivolti a sottogruppi di
pazienti per le quali siano ipotizzabili potenziali vantaggi
da un follow-up più intensivo, al fine di poter intervenire
con beneficio su metastasi individuate precocemente (malattia oligometastatica) (Hortobagyi, 2001).
La verifica dell’aderenza ai trattamenti oncologici, nonché
il monitoraggio e la gestione di eventuali effetti collaterali
dei trattamenti stessi sono altri obiettivi fondamentali del
follow-up.
In pazienti in postmenopausa, sia essa fisiologica o indotta
dai trattamenti, trova indicazione effettuare una densitometria ossea basale prima di assumere farmaci per i quali
l’osteoporosi rappresenta un effetto collaterale potenziale
(antiaromatasi, agonisti LHRH) (Dhesy-Thind, 2012). Inoltre, alle donne in trattamento con inibitori dell’aromatasi va
consigliato uno stile di vita che includa attività fisica quotidiana e un apporto adeguato di vitamina D3, riservando il
trattamento con bifosfonati alle situazioni in cui vi sia già
una diagnosi di osteoporosi (Hillner et al., 2003).
L’esame pelvico, preferenzialmente attraverso un’ecografia
transvaginale, trova indicazione in pazienti non isterectomizzate che stiano ricevendo tamoxifene con intento adiuvante
e che, in corso di trattamento, presentino una metrorragia di
qualsiasi entità (Fig. 8.30) (Bezircioglu et al., 2012).
BIBLIOGRAFIA
Aebi S, Davidson T, Gruber, Cardoso F. Primary breast cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol
2011:22(suppl);vi12-vi24.
Akiyama T, Sudo C, Ogawara H et al. The product of the human c-erbB-2 gene: A185kilodalton glycoprotein with tyrosine kinase activity. Science 1986;232:16441646.
Andreetta C, Minisini AM, Miscoria M, Puglisi F. First-line chemotherapy with or
without biologic agents for metastatic breast cancer. Crit Rev Oncol Hematol
2010;76:99-111.
Arteaga CL, Sliwkowski MX, Osborne CK et al. Treatment of HER2-positive breast
cancer: current status and future perspectives. Nat Rev Clin Oncol 2011;9:16-32.
Azim HA Jr, de Azambuja E, Colozza M et al. Ann Oncol. 2011 Sep;22(9):1939-47.
Baines CJ, Miller AB, Bassett AA. Phisical examination. Its role as a single screening modality in the Canadian National Breast Screening Study. Cancer 1989;63:1816-1822.
Baselga J, Campone M, Piccart M et al. Everolimus in postmenopausal hormonereceptor-positive advanced breast cancer. N Engl J Med 2012a;366(6):520-529.
Baselga J, Cortés J, Kim SB et al.; CLEOPATRA Study Group. Pertuzumab plus
trastuzumab plus docetaxel for metastatic breast cancer. N Engl J Med
2012b;366(2):109-119.
Berg WA. Benefits of screening mammography. JAMA 2010;303:168-169.
Bezircioglu I, Baloglu A, Tarhan MO et al. Evaluation of endometrium by transvaginal ultrasonography and Doppler in tamoxifen-treated women with breast
cancer. Eur J Gynaecol Oncol 2012;33:295-299.
Blackwell KL, Burstein HJ, Storniolo AM et al. Overall survival benefit with lapatinib in combination with trastuzumab for patients with human epidermal
growth factor receptor 2-positive metastatic breast cancer: final results from the
EGF104900 Study. J Clin Oncol 2012;30:2585-2592.
Bleyer A, Welch HG. Effect of Three Decades of Screening Mammography on BreastCancer Incidence. N Engl J Med 2012;21:1998-2005.
Bonotto M, Bozza C, Di Loreto et al. Making Capecitabine Targeted Therapy for
Breast Cancer: Which is the Role of Thymidine Phosphorylase? Clin Breast
Cancer 2013;13(3):167-172.
Broglio KR, Berry DA. Detecting an overall survival benefit that is derived from
progression-free survival. J Natl Cancer Inst 2009;101:1642-1649.
Brown RW, Allred DC, Clark GM et al. Prognostic value of Ki67 compared to S-phase
fraction in axillary node negative breast cancer. Clin Cancer Res 1996;2:585-592.
Cameron D, Casey M, Oliva C et al. Lapatinib plus capecitabine in women with
HER-2-positive advanced breast cancer: final survival analysis of a phase III
randomized trial. Oncologist 2010;15:924-934.
Capella C, Eusebi V, Mann B et al. Endocrine differentiation in mucoid carcinoma
of the breast. Histopathology 1980;4:613-630.
Cardoso F, Bedard PL, Winer EP et al.; ESO-MBC Task Force. International guidelines
for management of metastatic breast cancer: combination vs sequential singleagent chemotherapy. J Natl Cancer Inst 2009;101:1174-1181.
Cardoso F, Costa A, Norton L et al. 1st International consensus guidelines for
advanced breast cancer (ABC 1). Breast 2012a;21(3):242-252.
Cardoso F, Harbeck N, Fallowfield L et al.; ESMO Guidelines Working Group. Locally
recurrent or metastatic breast cancer: ESMO Clinical Practice Guidelines for
diagnosis, treatment and follow-up. Ann Oncol 2012b;23(suppl 7):vii11-vii19.
Carr CE, Conant EF, Rosen MA et al. The impact of FDG PET in the staging of breast
cancer. J Clin Oncol 2006;24(suppl):abstr 530.
Casciato DA, Barry BL. Manual of Clinical Oncology. 4th ed. Lippincott Williams
& Wilkins, Philadelphia, 2000.
Cheang MC, Chia SK, Voduc D et al. Ki67 Index, HER2 Status, and Prognosis of
Patients With Luminal B Breast Cancer. J Natl Cancer Inst 2009:101:736-750.
Cheang MC, Voduc KD, Tu D et al. Clin Cancer Res 2012;18(8):2402-2412
Chia SK, Speers CH, D’yachkova Y et al. The impact of new chemotherapeutic
and hormone agents on survival in a population-based cohort of women with
metastatic breast cancer. Cancer 2007;110:973-979.
Clarke M, Collins R, Early Breast Cancer Trialists’ Collaborative Group (EBCTCG)
et al. Lancet 2005;366(9503):2087-2106.
Coleman RE, Rubens RD, Fogelman I. Reappraisal of the baseline bone scan in
breast cancer. J Nucl Med 1988;29:1045-1049.
Cotran RS, Kumar V, Robbins SL. Robbins Pathologic basis of disease. Saunders,
Philadelphia, 2000.
Cuzick J, Ambroisine L et al. LHRH-agonists in Early Breast Cancer Overview group.
Lancet 2007;369(9574):1711-1723.
Davies C, Godwin J, Gray R et al. Early Breast Cancer Trialists’ Collaborative Group
(EBCTCG). Relevance of breast cancer hormone receptors and other factors to
the efficacy of adjuvant tamoxifen: patient-level meta-analysis of randomised
trials. Lancet 2011;378:771-784.
Davies C, Pan H, Godwin J et al. Adjuvant Tamoxifen: Longer Against Shorter
(ATLAS) Collaborative Group. Lancet. 2013;381(9869):805-816. Erratum in:
Lancet. 2013;381(9869):804.
Dawood S, Broglio K, Buzdar AU et al. Prognosis of women with metastatic breast
cancer by HER2 status and trastuzumab treatment: an institutional-based review.
J Clin Oncol 2010;28:92-98.
De Azambuja E, Cardoso F, de Castro G et al. Ki67 as prognostic marker in early
breast cancer: a meta-analysisof published studies involving 12,155 patients. Br
J Cancer 2007;96:1504-1513.
De Boer M, Van Deurzen CHM, Van Dijck JAAM et al. Micrometastases or Isolated
Tumor Cells and the Outcome of Breast Cancer. N Engl J Med 2009;361:653-663.
De Freitas R Jr, Costa MV, Schneider SV et al. Accuracy of ultrasound and clinical
examination in the diagnosis of axillary lymph node metastases in breast cancer.
Eur J Surg Oncol 1991;17:240.
Dent R, Hanna WM, Trudeau M et al. Pattern of metastatic spread in triple-negative
breast cancer. Breast Cancer Res Treat 2009;115:423-428.
Dhesy-Thind SK. Screening for Osteoporosis in Postmenopausal Women With Breast
Cancer Receiving Aromatase Inhibitors: Less Is More? J Clin Oncol 2012;30:14081410.
Di Saverio S, Catena F, Santini D et al. Breast Cancer Res Treat. 2008;(3):405-416.
Dowsett M, Cuzick J, Ingle J et al. J Clin Oncol. 2010;28(3):509-518.
Early Breast Cancer Trialists’ Collaborative Group (EBCTCG), Davies C, Godwin J
et al. Lancet. 2011;378(9793):771-784.
Early Breast Cancer Trialists’ Collaborative Group (EBCTCG), Peto R, Davies C et
al. Lancet. 2012;379(9814):432-444.
Edge SB, Byrd DR, Compton CC et al. American Joint Committee on Cancer: AJCC
Cancer Staging Manual. 7th ed. Springer-Verlag, New York, NY, 2010.
Ca pito l o 8
Elston CW, Ellis IO. Pathological prognostic factor in breast cancer: experience
from a large study with long-term follow-up. Histopathology 1991;19:403-410.
Eusebi V, Magalhaes F, Azzopardi JG. Pleomorphic lobular carcinoma of the breast: an
aggressive tumor showing apocrine differentiation. Hum Pathol 1992;11:193-198.
Fitzgibbons PL, Page DL, Weaver D et al. Prognostic factors in breast cancer. College of American Pathologists consensus statement 1999. Arch Pathol Lab Med
2000;124:966-978.
Forza Operativa Nazionale Carcinoma Mammario. Linee Guida 2012.
Foukakis T, Åström G, Lindström L et al. When to order a biopsy to characterize a
metastatic relapse in breast cancer. Ann Oncol 2012;23(suppl 10):x349-x353.
Gaglia P, Bemardi N, Venesio T et al. Cell proliferation of breast cancer evaluated
by anti Brd-U and anti Ki67 anti- bodies; its prognostic value on short term
recurrences. Eur J Cancer 1994;29A:1509-1513.
Gianni L, Eiermann W, Semiglazov V et al. Lancet. 2010;375(9712):377-384.
Giordano SH, Buzdar AU, Smith TL et al. Is breast cancer survival improving?
Cancer 2004;100:44-52.
Giuliano AE, Hunt KK, Ballman KV et al. JAMA. 2011;305(6):569-575.
GIVIO Investigators. Impact of follow-up testing on survival and health-related
quality of life in breast cancer patients. A multicenter randomized controlled
trial. JAMA 1994;271:1587-1592.
Globocan. Breast cancer fact sheet. http://globocan.iarc.fr/. 2008.
Goldhirsch A, Wood WC, Coates AS et al. Strategies for subtypes-dealing with
the diversity of breast cancer: highlights of the St Gallen International Expert
Consensus on the Primary Therapy of Early Breast Cancer 2011. Ann Oncol
2011;22:1736-1747.
Goss PE, Ingle JN, Martino Set al. J Natl Cancer Inst 2005;97(17):1262-1271
Goss PE, Ingle JN, Pritchard KI et al. J Clin Oncol. 2013;31(11):1398-1404.
Gray R, Bhattacharya S, Bowden C et al. Independent review of E2100: a phase III
trial of bevacizumab plus paclitaxel versus paclitaxel in women with metastatic
breast cancer. J Clin Oncol 2009;27:4966-4972.
Guadagni F, Ferroni P, Carlini S et al. A re-evaluation of carcinoembryonic antigen
(CEA) as a serum marker for breast cancer: a prospective longitudinal study. Clin
Cancer Res 2001;7:2357-2362.
Hackshaw AK, Paul EA. Breast self-examination and death from breast cancer: a
meta-analysis. Br J Cancer 2003;88:1047-1053.
Hammond ME, Hayes DF, Dowsett M et al. American Society of Clinical Oncology/
College of American Pathologists guideline recommendations for immunohistochemical testing of estrogen and progesterone receptors in breast cancer. J
Clin Oncol 2010;28:2784-2795.
Hankinson SE, Willett WC, Colditz GA et al. Circulating concentrations of insulinlike growth factor-I and risk of breast cancer. Lancet 1998;351:1393-1396.
Harris L, Fritsche H, Mennel R et al. American Society of Clinical Oncology 2007
update of recommendations for the use of tumor markers in breast cancer. J
Clin Oncol 2007;25:5287.
Hayes DF. Clinical practice. Follow-up of patients with early breast cancer. N Engl
J Med 2007;356:2505-2513.
Hedley DW, Clark GM, Cornelisse CJ et al. Consensus review of the clinical utility
of DNA cytometry in carcinoma of the breast. Cytometry 1993;14:482-485.
Hillner BE, Ingle JN, Chlebowski RT et al.; American Society of Clinical Oncology.
American Society of Clinical Oncology 2003 update on the role of bisphosphonates and bone health issues in women with breast cancer. J Clin Oncol
2003;21:4042-4057.
Hortobagyi GN. Can we cure limited breast cancer? J Clin Oncol 2001;20:620-623.
Hughes LL, Wang M, Page DL et al. J Clin Oncol. 2009;27(32):5319-5324.
Hughes KS, Schnaper LA, Bellon JR et al. J Clin Oncol. 2013 Jul 1;31(19):2382-2387.
Huynh PT, Lemeshko SV, Mahoney MC et al. ACR Appropriateness Criteria® Stage
I Breast Carcinoma. J Am Coll Radiol 2012;9:463-467.
Jatoi I, Anderson WF, Jeong JH, Redmond CK. Breast cancer adjuvant therapy: time
to consider its time-dependent effects. J Clin Oncol 2011;29:2301-2304.
Jones S, Holmes FA, O’Shaughnessy J et al. J Clin Oncol. 2009 Mar 10;27(8):1177-1183.
Kennecke H, Yerushalmi R, Woods R et al. Metastatic behavior of breast cancer
subtypes. J Clin Oncol 2010;28:3271-3277.
Khan QJ, O’Dea AP, Dusing R et al. Integrated FDG-PET for initial staging of breast
cancer. J Clin Oncol 2007;25(suppl):abstr 558.
Khatcheressian JL, Wolff AC, Smith TJ et al.; American Society of Clinical Oncology. American Society of Clinical Oncology 2006 update of the breast cancer
follow-up and management guidelines in the adjuvant setting. J Clin Oncol
2006;24:5091-5097.
Khatcheressian JL, Hurley P, Bantug E et al. Breast Cancer Follow-Up and Management After Primary Treatment: American Society of Clinical Oncology Clinical
Practice Guideline Update. J Clin Oncol 2013;31(7):961-965.
Kokko R, Holli K, Hakama M. Ca 15-3 in the follow-up of localised breast cancer:
a prospective study. Eur J Cancer 2002;38:1189-1193.
Krag DN, Anderson SJ, National Surgical Adjuvant Breast and Bowel Project et al.
Lancet Oncol. 2007;8(10):881-888.
N e o p lasi e della mammella
Krag DN, Anderson SJ, Julian TB et al. Lancet Oncol. 2010;11(10):927-933.
Kumar R, Chauhan A, Zhuang H et al. Clinicopathologic factors associated with false
negative FDG-PET in primary breast cancer. Breast Cancer Res Treat 2006;98:267274.
Lakhani S, Ellis IO, Schnitt SJ et al. WHO classification of tumour of the breast.
4th ed. IARC, Lyon, 2012.
Lanng C, Hoffmann J, Galatius H, Engel U. Assessment of clinical palpation of the
axilla as a criterion for performing the sentinel node procedure in breast cancer.
Eur J Surg Oncol 2007;33:281.
Lash TL, Fox MP, Buist DS et al. Mammography surveillance and mortality in older
breast cancer survivors. J Clin Oncol 2007;25:3001-3006.
Lauria R, Perrone F, Carlomagno C et al. The prognostic value of lymphatic and
blood vessel invasion in operable breast cancer. Cancer 1995;76:1772-1778.
Lauro S, Trasatti L, Bordin F et al. Comparison of CEA, MCA, CA 15-3 and CA 2729 in follow-up and monitoring therapeutic response in breast cancer patients.
Anticancer Res 1999;19:3511-3515.
Liedtke C, Mazouni C, Hess KR et al. J Clin Oncol. 2008;26(8):1275-1281.
Lim E, Lin NU. New insights and emerging therapies for breast cancer brain metastases. Oncology (Williston Park) 2012;26:652-659.
Lønning PE. Endocr Relat Cancer. 2004;11(2):179-189.
Lord SJ, Lei W, Craft P et al. A systematic review of the effectiveness of magnetic resonance imaging (MRI) as an addition to mammography and ultrasound in screening young women at high risk of breast cancer. Eur J Cancer 2007;43:1905-1917.
Lyman GH, Giuliano AE, American Society of Clinical Oncology et al. J Clin Oncol.
2005;23(30):7703-7720.
Macfarlane R, Seal M, Speers C et al. Molecular alterations between the primary
breast cancer and the subsequent locoregional/metastatic tumor. Oncologist
2012;17:172-178.
Mann RM, Kuhl CK, Kinkel K, Boetes C. Breast MRI: guidelines from the European
Society of Breast Imaging. Eur Radiol 2008;18:1307-1318.
Mansel RE, Fallowfield L, Kissin M et al. J Natl Cancer Inst. 2006;98(9):599-609.
Mariuzzi GM. Anatomia patologica e correlazioni anatomo-cliniche. Piccin, Padova, 2007.
McNeil BJ, Pace PD, Gray EB et al. Preoperative and follow-up bone scans in patients
with primary carcinoma of the breast. Surg Gynecol Obstet 1978;147:745-748.
Melchor L, Benítez J. Hum Genet. 2013;132(8):845-863.
Miles DW, Chan A, Dirix LY et al. Phase III study of bevacizumab plus docetaxel
compared with placebo plus docetaxel for the first-line treatment of human
epidermal growth factor receptor 2-negative metastatic breast cancer. J Clin
Oncol 2010;28:3239-3247.
Miller AB, To T et al. Canadian National Breast Screening Study-2: 13-year results of
randomized trial in women aged 50-59 years. J Nat Cancer Inst 2000;92:14901499.
Mohsin SK, Weiss H, Havighurst T et al. Progesterone receptor by immunohistochemistry and clinical outcome in breast cancer: A validation study. Mod Pathol
2004;17:1545-1554.
Molina R, Jo J, Filella X et al. c-erbB-2 oncoprotein, CEA, and CA 15.3 in patients
with breast cancer: prognostic value. Breast Cancer Res Treat 1998;51:109-119.
Morris AD, Morris RD, Wilson JF et al. Cancer J Sci Am. 1997;3(1):6-12.
Moss SM, Cuckle H, Evans A et al. Effect of mammographic screening from age 40
years on breast cancer mortality at 10 years’ follow-up: a randomised controlled
trial. Lancet 2006;368:2053-2060.
Mouridsen H, Giobbie-Hurder A et al. BIG 1-98 Collaborative Group. N Engl J
Med. 2009;361(8):766-776.
National Comprehensive Cancer Network. NCCN Guidelines v2.2013.
National Comprehensive Cancer Network. NCCN Practice Guidelines in Oncology:
Breast Cancer Screening and Diagnosis. v.1.2012.
Nattinger AB. In the clinic. Breast cancer screening and prevention. Ann Intern
Med 2010;152:ITC41.
Nelson HD, Tyne K, Naik A et al.; US Preventive Services Task Force. Screening for
breast cancer: an update for the US Preventive Services Task Force. Ann Intern
Med 2009;151(10):727-737.
Neville AM, Bettelheim R, Gelber RD et al. Factors predicting treatment responsiveness and prognosis in node-negative breast cancer. The International (Ludwig)
Breast Cancer Study Group. J Clin Oncol 1992;10:696-705.
Nothacker M, Duda V, Hahn M et al. Early detection of breast cancer: benefits and
risks of supplemental breast ultrasound in asymptomatic women with mammographically dense breast tissue. A systematic review. BMC Cancer 2009;9:335.
O’Mara RE. Bone scanning in osseous metastatic disease. JAMA 1974;229:1915-1917.
Paik S, Shak S, Tang G et al. N Engl J Med. 2004;351(27):2817-2826.
Palli D, Russo A, Saieva C et al. Intensive vs clinical follow-up after treatment of
primary breast cancer: 10-year update of a randomized trial. National Research
Council Project on Breast Cancer Follow-up. JAMA 1999;281:1586.
Park JW, Neve RM, Szollosi J et al. Unraveling the biologic and clinical complexities
of HER2. Clin Breast Cancer 2008;8:392-401.
291
292
Capitolo 8
Neo p la sie d ella m a m m ella
Pegram M, Liao J. Trastuzumab treatment in multiple lines: current data and future
directions. Clin Breast Cancer 2012;12:10-18.
Perez EA, Suman VJ, Davidson NE et al. J Clin Oncol. 2011;29(34):4491-4497.
Pisano ED, Fajardo LL, Caudry DJ et al. Fine-needle aspiration biopsy of nonpalpable breast lesions in a multicenter clinical trial: results from the radiologic
diagnostic oncology group V. Radiology 2001;219:785.
Plevritis SK, Kurian AW, Sigal BM et al. Cost-effectiveness of screening BRCA1/2 mutation Carriers with Breast Magnetic Resonance imaging. JAMA 2006;295:23742384.
Podoloff DA, Advani RH, Allred C et al. NCCN Task Force Report: PET/CT scanning
in cancer. J Natl Compr Canc Netw 2007;5(suppl 1):S1-S24.
Puglisi F, Follador A, Minisini AM et al. Baseline staging tests after a new diagnosis of breast cancer: further evidence of their limited indications. Ann Oncol
2005a;16:263-266.
Puglisi F, Piccart M. Trastuzumab and breast cancer. Are we just beyond the prologue
of a fascinating story? Onkologie 2005b;28:547-549.
Puglisi F, Cardoso F, Lebrun F, Piccart M. First-Line Treatment of Metastatic Breast Cancer: Available Evidence and Current Recommendations. Am J Cancer
2006;5:99-110.
Puglisi F, Andreetta C, Fasola G et al. Bone scan for baseline staging in invasive
breast cancer at the time of primary presentation. Breast Care 2007;2:358-364.
Puglisi F, Minisini AM. Adjuvant endocrine therapy in postmenopausal breast cancer
patients: Does hormone receptor status influence decision-making? Crit Rev
Oncol Hematol 2011;77:87-99.
Puglisi F, Minisini AM, De Angelis C, Arpino G. Overcoming treatment resistance
in HER2-positive breast cancer: potential strategies. Drugs 2012;72:1175-1193.
Rakha EA, El-Sayed ME, Powe DG et al. Invasive lobular carcinoma of the breast:
response to hormonal therapy and outcomes. Eur J Cancer 2008;1:73-83.
Robert NJ, Diéras V, Glaspy J et al. RIBBON-1: randomized, double-blind, placebocontrolled, phase III trial of chemotherapy with or without bevacizumab for
first-line treatment of human epidermal growth factor receptor 2-negative,
locally recurrent or metastatic breast cancer. J Clin Oncol 2011;29:1252-1260.
Robertson JF, Blamey RW. Eur J Cancer 2003;39(7):861-869.
Rosen EL, Eubank WB, Mankoff DA. FDG PET, PET/CT, and breast cancer imaging.
RadiGraphics 2007;27:S215-S229.
Ross JS, Slodkowska EA, Symmans WF et al. The HER-2 receptor and breast cancer:
ten years of targeted anti-HER-2 therapy and personalized medicine. Oncologist
2009;14:320-368.
Rosselli Del Turco M, Palli D, Cariddi A et al. Intensive diagnostic follow-up after treatment of primary breast cancer. A randomized trial. National Research Council
Project on Breast Cancer follow-up. JAMA 1994;271:1593-1597.
Santen RJ, Manni A, Harvey H et al. Endocrine treatment of breast cancer in women.
Endocr Rev 1990;11:221-265.
Schnall M, Orel S. Breast MR imaging in the diagnostic setting. Magn Reson Imaging
Clin N Am 2006;14(3):329-337.
Schnipper LE, Smith TJ, Raghavan D et al. American Society of Clinical Oncology
identifies five key opportunities to improve care and reduce costs: the top five
list for oncology. J Clin Oncol 2012;30:1715-1724.
Shou J, Massarweh S, Osborne CK et al. Mechanisms of tamoxifen resistance: increased estrogen receptor-HER2/neu cross-talk in ER/HER2-positive breast cancer.
J Natl Cancer Inst 2004;96:926-935.
Silverstein MJ, Buchanan C. Breast. 2003;12(6):457-471.
Singletary SE, Allred C, Ashley P et al. Revision of the American Joint Committee
on Cancer staging system for breast cancer. J Clin Oncol 2002;17:3628-3636.
Slamon D, Eiermann W, Breast Cancer International Research Group et al. N Engl
J Med. 2011;365(14):1273-1283.
Smith BD, Arthur DW, Buchholz TA et al. J Am Coll Surg. 2009;209(2):269-277.
Solin LJ, Gray R, Baehner FL, Butler SM et al. J Natl Cancer Inst. 2013;105(10):701-710.
Sotiriou C, Pusztai L. Gene-expression signatures in breast cancer. N Engl J Med
2009;360:790-800.
Sotiriou C, Wirapati P, Loi S et al. Gene expression profiling in breast cancer: understanding the molecular basis of histologic grade to improve prognosis. J Nat
Cancer Inst 2006;98:262-272.
Spyratos F, Brouillet JP, Defrenne A et al. Cathepsin-D: an independant prognostic
factor for metastasis of breast cancer. Lancet 1989;8672:1115-1118.
Tabar L, Yen M-F, Vitak B et al. Mammography service screening and mortality in
breast cancer patients: 20-year follow-up before and after introduction of screening. Lancet 2003;361:1405-1410.
Tavassoli FA, Devilee P. WHO 2003 Classification of tumors. Tumors of the breast
and female genital organs: pathology and genetics. IARC Press, Lyon, 2003.
Teh W, Wilson AR. The role of ultrasound in breast cancer screening. A consensus statement by the European Group for Cancer Screening. Eur J Cancer 1998;34:449450.
Thompson AM, Hawkins RA, Elton RA et al. pS2 is an independent factor of good
prognosis in primary breast cancer. Br J Cancer 1993;68:93-96.
Toi M, Atiqur Rahman M, Bando H et al. Thymidine phosphorylase (platelet-derived
endothelial-cell growth factor) in cancer biology and treatment. Lancet Oncol
2005;6:158-166.
Tondini C, Hayes DF, Gelman R et al. Comparison of CA15-3 and carcinoembryonic antigen in monitoring the clinical course of patients with metastatic breast
cancer. Cancer Res 1988;48:4107-4112.
Tworoger SS, Eliassen AH, Sluss P et al. A prospective study of plasma prolactin
concentrations and risk of premenopausal and postmenopausal breast cancer.
J Clin Oncol 2007;25(12):1482-1488.
Vaidya JS, Vyas JJ, Thakur MH et al. Role of ultrasonography to detect axillary node
involvement in operable breast cancer. Eur J Surg Oncol 1996;22:140.
van de Velde CJ, Rea D, Seynaeve C et al. Lancet 2011;377(9762):321-331.
van de Vijver MJ, He YD, van’t Veer LJ et al. N Engl J Med. 2002;347(25):1999-2009.
Verma S, Miles D, Gianni L et al.; EMILIA Study Group. Trastuzumab emtansine
for HER2-positive advanced breast cancer. N Engl J Med 2012;367:1783-1791.
Vignot S, Besse B, André F et al. Discrepancies between primary tumor and metastasis: A literature review on clinically established biomarkers. Crit Rev Oncol
Hematol 2012;84:301-313.
Voduc KD, Cheang MCU, Tyldesley S et al. Breast cancer subtypes and the risk of
local and regional relapse. J Clin Oncol 2010;28:1684-1691.
Wahl RL, Siegel BA, Coleman RE, Gatsonis CG. Prospective multicenter study of
axillary nodal staging by positron emission tomography in breast cancer: a report
of staging breast cancer with PET study group. J Clin Oncol 2004;22:277-285.
Warner E, Hill K, Causer P et al. Prospective study of breast cancer incidence in
women with a BRCA1 or BRCA2 mutation under surveillance with and without
magnetic resonance imaging. J Clin Oncol 2011;29:1664-1669.
Wellings SR, Jensen HM. On the origin and progression of ductal carcinoma in the
human breast. J Nat Cancer Inst 1973;50:1111-1118.
White E, Miglioretti DL, Yankaskas BC et al. Biennial vs. annual mammography
and the risk of late-stage breast cancer. J Natl Cancer Inst 2004;96:1832-1839.
Wong MH, Stockler MR, Pavlakis N. Bisphosphonates and other bone agents for
breast cancer. Cochrane Database Syst Rev 2012;2:CD003474.
Wooster R, Weber BL. Breast and ovarian cancer. N Engl J Med 2003;348:2339-2347.
Yarden Y, Sliwkowski MX. Untangling the ErbB signaling network. Nat Rev Mol
Cell Biol 2001;2:127-137.
Yarden Y. The EGFR family and its ligands in human cancer: signalling mechanisms
and therapeutic opportunities. Eur J Cancer 2001;37(suppl 4):S3-S8.










