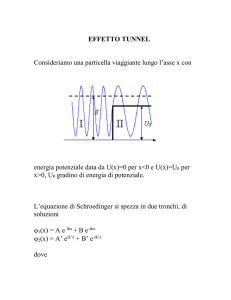
Le vibrazioni nei cristalli
I moti vibrazionali in molecole e cristalli vengono solitamente descritti come modi normali di
vibrazione; questi discendono direttamente dall’applicazione del formalismo quantistico al moto
atomico. Di seguito illustro brevemente i passaggi logici fondamentali che portano alla definizione
dei modi normali e delle loro frequenze.
Partiamo dal caso di una particella singola isolata dal resto dell’Universo. Rispetto a un sistema di
riferimento in cui questa si muove con velocità v (e non è accelerata, poiché su questa particella non
agiscono forze, essendo per definizione isolata da qualsiasi altro oggetto e, quindi, anche da
sorgenti di forza), tale particella avrà impulso (quantità di moto) p = mv, dove m è la sua massa;
l’energia cinetica della particella (energia di movimento) sarà T = p2/2m; questa è l’unica forma di
energia associata a una siffatta particella. Ora, mettiamo una seconda particella nel nostro sistema:
siano v1 e v2 le velocità delle due particelle, e m1 e m2 le loro masse; l’energia cinetica totale sarà:
T=
p12 p 22
+
m1 m2
dove p1 e p2 sono le quantità di moto delle due particelle. Se esiste una forza di attrazione tra le due
particelle avente forma F=k r12 , dove k è una costante e r12 è la distanza, a un dato istante, tra le
due particelle, a questa sarà associata una energia potenziale della forma
V =
1
k ⋅ r122
2
e l’energia totale risultante è E = T + V
Una forza avente la forma su scritta (lineare con la distanza r) è per esempio quella che si ha per
due masse legate da una molla, la cui resistenza alla trazione è descritta dalla costante k. Entro certi
limiti (sostanzialmente, per r molto piccoli) una legge di forza simile vale anche per atomi
chimicamente legati entro una molecola o cristallo. Il moto delle due masse così legate si chiama
moto armonico; moti sottoposti a leggi di forza più complicate possono comunque essere trattati
secondo l’approssimazione armonica della legge di forza se gli spostamenti delle masse dalle
rispettive posizioni di equilibrio sono molto piccoli. In effetti, il potenziale V scritto sopra va
modificato, o diversamente interpretato, proprio per tener conto di una separazione di equilibrio tra
le due masse, ovvero di una distanza r12 alla quale le due masse hanno il minimo di energia
potenziale: se d12 è tale distanza di equilibrio
V =
1
k ⋅ ( r12 − d 12 ) 2
2
In tal caso l’espressione della forza viene modificata in
r
r
F = k ⋅ ( r12 − d 12 )u
r
dove u è un vettore di modulo unitario (indica unicamente la direzione della forza).
Quando r12 = d12 il potenziale V è nullo e l’energia ha un minimo. Questo è l’oscillatore armonico
classico: le due masse si spostano lungo la loro congiungente, intorno alle rispettive posizioni di
equilibrio, come indicato nella figura sottostante: le frecce indicano le oscillazioni di moto delle due
masse aventi posizioni di equilibrio rappresentate dalle due linee verticali poste alla distanza d12; le
ampiezze del moto (lunghezza delle frecce) delle due masse (A1d, A1s, ampiezze relative alla massa
1, nei due versi destro e sinistro rispettivamente; A2d, A2s grandezza analoghe relative alla massa 2)
non sono necessariamente uguali: in generale A1d ≠ A2d e A1s ≠ A2s , ma A1d = A1s e A2d = A2s se il
moto è armonico.
r
u
m1
m2
Tra i possibili stati dell’oscillatore armonico, la meccanica classica prevede quello di quiete, in cui
entrambe le masse sono ferme alla distanza di equilibrio; in tal caso l’energia totale dell’oscillatore
è nulla. Nell’ipotesi di fissare ad una posizione specifica una delle due masse (sia m1), se l’altra
(m2) viene allontanata dalla prima, e portata a una distanza r12 superiore a d12, l’energia potenziale
del sistema aumenta secondo la formula su scritta per V; quanto tale massa viene rilasciata, questa
r
sotto l’azione della forza armonica (F diretta secondo il verso di u indicato in figura) accelera verso
m1, aumentando la propria velocità e facendo così aumentare l’energia cinetica T (inizialmente
nulla); quando la m2 raggiunge la posizione di equilibrio, l’energia potenziale va a zero, ma il valore
dell’energia cinetica è salito allo stesso valore numerico che V aveva all’inizio; la massa continua
allora la sua corsa verso m1, per inerzia, portando la sua distanza da questa a un valore minore di
d12; così facendo, l’energia potenziale aumenta, ma T diminuisce fino al valore nullo (questo, per
effetto della forza repulsiva esercitata da m1, per distanze m1-m2 minori di d12: infatti r12 – d12 è
minore di zero, se r12 è minore di d12, e la forza cambia di segno, ovvero ha verso opposto rispetto a
r
u ), dopo di che il moto si inverte. Ciò che resta costante in questo moto vibrazionale è l’energia
totale E=T+V. Se non interviene alcun meccanismo dissipativo che riduce nel tempo l’energia E del
sistema, l’oscillatore è destinato al moto perpetuo (m2 continuerà a oscillare rispetto alla sua
posizione di equilibrio, con la stessa ampiezza.
L’oscillatore quantistico
Un sistema di due masse legate da una legge di forza armonica, del tipo visto sopra (F = kr), oscilla
intorno alla posizione di equilibrio con frequenza ν data da
ν =
1
2π
k
2µ
m1 m2
m1 + m2
La meccanica quantistica predice per tale oscillatore l’energia (totale)
dove µ è la massa ridotta del sistema: µ =
1
E = ( n + ) hν
2
dove n è un numero intero positivo, zero compreso.
L’energia più bassa dell’oscillatore non è zero, come è possibile in meccanica classica, ma è quella
che si ottiene ponendo n=0:
E0 =
1
hν
2
(energia di punto zero).
L’ampiezza e l’energia dell’oscillatore è dunque legata al valore di n. In un insieme fatto da una
miriade di oscillatori identici (si pensi a un gas di molecole biatomiche identiche come N2 – azoto,
oppure O2 - ossigeno), la loro distribuzione su tutti i possibili stati vibrazionali segue una legge
statistica ben definita (distribuzione di Bose - Einstein) che è funzione della temperatura: tanto più
alta è quest’ultima, tanto più alta è la probabilità che un dato oscillatore preso a caso nell’insieme
sia in uno stato vibrazionale eccitato ad alto valore di n. Alla temperatura più bassa possibile (lo
zero assoluto, 0K, che corrisponde a -273,15 °C), tutti gli oscillatori sono nello stato fondamentale
con n=0 e hanno l’energia di punto zero; quindi, anche a 0K, gli atomi nelle molecole non sono
fermi ma oscillano intorno alle loro rispettive posizioni di equilibrio. Se si fermassero, l’energia
vibrazionale scenderebbe a zero, ma questo non è possibile perché la più bassa energia che ogni
oscillatore può avere corrisponde a 1/2 hv. Questo vuol anche dire che l’oscillatore quantistico non
può emettere alcuna radiazione elettromagnetica, poiché questa è indissolubilmente legata
all’energia dei campi elettrici e magnetici associati: emettere radiazione significa perdere energia
che però, se questa è già la minima possibile, non può essere persa… La meccanica quantistica si
limita perciò a dire che l’oscillatore, qualunque sia la sua natura, si trova in stati stazionari che non
cambiano nel tempo, a meno di perturbazioni esterne, s’intende.
Riassumendo (ed estendendo…)
1) Entro qualsiasi struttura molecolare o cristallina gli atomi non sono fissi alle rispettive
posizioni di equilibrio, ma oscillano intorno a queste. Ogni atomo non si muove
indipendentemente dagli altri: i moti degli atomi sono collettivi e prendono il nome di modi
normali di vibrazione. La forma dei vari modi (come si muovono gli atomi in ciascuno di
essi) dipende dalle energie e dagli equilibri interni della struttura e dalla sua simmetria. La
simmetria strutturale impone certi vincoli alla simmetria del potenziale (o se si preferisce, è
la simmetria del potenziale interatomico che impone vincoli alla simmetria strutturale…)
che, a propria volta, determina i vincoli sulla forma dei modi normali di vibrazione. Per
esempio, nella molecola d’acqua (H2O) la forma dei tre modi normali, dettata dalla
simmetria è come illustrata nella figura sottostante, dove le frecce indicano la direzione di
spostamento degli atomi: abbiamo un piegamento (bending) e due modi di stiramento
(stretching) di cui uno simmetrico (i due idrogeni si allontanano e si avvicinano
contemporaneamente all’ossigeno) e uno asimmetrico (un idrogeno si avvicina mentre
l’altro si allontana dall’ossigeno, e viceversa):
O
H
H
Bending
Stretching simmetrico
Stretching asimmetrico
2) Ogni modo normale ha una frequenza caratteristica associata: la frequenza è il numero di
oscillazioni, nell’unità di tempo, che il modo normale effettua intorno alla posizione di
equilibrio: un modo a 20THz, per esempio, effettuerà in un secondo un numero di
oscillazioni pari a 20x1012.
Approfondiamo ulteriormente l’argomento sulle vibrazioni cristalline e, per semplificare,
riferiamoci al caso monodimensionale. Supponiamo di avere una semplice molecola lineare
biatomica di cloruro di sodio (NaCl); la molecola ha due atomi quindi è associata a 3x2 = 6 gradi di
libertà, di cui 3 sono traslazioni rigide, e 2 sono rotazioni:
X
Cl
Na
Z
Y
Nella figura, le tre traslazioni rigide sono lungo le direzioni X, Y e Z, e le due rotazioni sono
intorno agli assi X e Y (quest’ultimo è perpendicolare al piano della figura). L’unico grado di
libertà vibrazionale (6 totali -3 traslazioni -2 rotazioni) consiste nell’oscillazione intorno alle
rispettive posizioni di equilibrio dei due ioni Na e Cl, nei versi indicati dalle frecce poste sotto gli
atomi, lungo la direzione Z. Questo moto vibrazionale comporta l’allungamento e l’accorciamento
della distanza Na-Cl (stiramento, stretching).
Supponiamo adesso di prendere un sistema leggermente più complesso, ma ancora lineare: la
molecola 4 atomi (NaCl)2: Na-Cl-Na-Cl. Qui abbiamo 3x4 = 12 gradi di libertà totali, e quindi 123-2 = 7 gradi di libertà vibrazionali; questi corrispondono ad altrettanti modi normali, ciascuno con
la propria frequenza. Uno di questi modi sarà molto simile a quello già visto per la molecola
biatomica NaCl: i due ioni sodio si muovono con la stessa ampiezza, nella stessa direzione e verso,
ed esattamente l’opposto fanno i due ioni cloro: per esempio, ad un dato instante, i due Na si
sposteranno verso destra, mentre i due Cl verso sinistra:
Na Cl
Na Cl
o, lasciando solo le frecce (in rosso quelle relative a Na e in nero quelle relative a Cl):
Poi ci sarà un modo del tipo in cui i due atomi di sodio si muovono in senso opposto
l’uno rispetto all’altro, ed altrettanto fanno gli atomi di cloro. Alternativamente, potremmo dire che
mentre la coppia di atomi, Na e Cl, alla sinistra della molecola, si avvicina, l’analoga coppia sulla
destra si allontana (poi il moto si inverte al culmine dell’ampiezza di oscillazione).
Oltre a quelli visti che sono tutti modi di stretching, ci sono anche quelli di bending (piegamento)
che corrispondono a spostamenti dei vari atomi nelle direzioni X e/o Y, per esempio:
↑ ↓ ↑ ↓
In tal caso, ad un dato istante la molecola avrà una conformazione a zig-zag.
Faccio notare che i modi di stretching avvengono lungo la direzione della molecola (asse Z), mentre
quelli di bending avvengono nelle due direzioni perpendicolari.
Possiamo più o meno facilmente immaginare cosa capita nel caso di una catena lineare molto lunga
(NaCl)n (dove n è un numero molto grande): avremo 3xn – 5 gradi di libertà vibrazionali ripartiti
tra i modi di stretching e quelli di bending. Al limite potremmo pure vedere le tre traslazioni come
oscillazioni a frequenza nulla: se tutti gli atomi (sia di sodio, sia di cloro) si muovessero della stessa
quantità, nella stessa direzione e verso, l’intera molecola traslerebbe… per esempio, la seguente è
una traslazione (rigida) verso sinistra:
…..
Ora, numeriamo gli atomi da sinistra a destra:
1 2 3 4 5 6 7
Nella traslazione, ogni atomo si muove in una data direzione di una certa quantità, sia questa x (il
sodio 1 si sposta a sinistra di x; lo stesso accade al cloro 2, al sodio 3, ecc…). Se i vari atomi si
spostassero di quantità diverse, la traslazione non sarebbe più rigida, perché inevitabilmente alcuni
di essi si avvicinerebbero o allontanerebbero dagli altri. Lungo la catena, allora, per la traslazione
abbiamo x costante. Che succede se x non è costante ma è funzione dell’atomo a cui si riferisce?
Abbiamo una vibrazione di stretching! Scriviamo x(i) per indicare l’ampiezza di oscillazione
intorno alla posizione di equilibrio dell’atomo i (con i, numero intero, che varia da 1 al numero 2n
di atomi della catena).
Potremmo esprimere tale numero x(i) con una qualche funzione periodica del tipo
2π z i
x ( i ) = A cos
λ
dove zi è la posizione di equilibrio dell’atomo i lungo la catena (ad esempio, ponendo l’origine
sull’atomo 1, per cui z1 = 0), A è l’ampiezza di oscillazione, e λ è la lunghezza d’onda caratteristica
del modo. Se λ vale infinito (in pratica, se λ è un numero molto grande) il rapporto 2πz/λ tende a
zero, da cui il coseno tende ad 1 e, di conseguenza, x(i) tende al valore costante A: ma questa è la
traslazione rigida della catena lungo la direzione Z! Allora la traslazione della catena può essere
vista come una particolare oscillazione a lunghezza d’onda infinita.
Vediamo adesso il caso in cui λ vale 2d = 2(zi – zi-1). Si noti che nel nostro caso zi – zi-1 corrisponde
proprio alla distanza di equilibrio di ogni coppia di atomi primi vicini; per esempio, se i=2, z2 – z1 è
la distanza (d) tra il sodio 1 e il cloro 2, ma questa distanza (che è la distanza di equilibrio Na-Cl) è
la stessa per tutte le coppie di atomi contigui Na e Cl. Allora abbiamo z1=0; z2=d; z3=2d; z4=2d… e
conseguentemente 2πzi/λ = 0 (i=1), π (i=2), 2π (i=3),…, quindi, in definitiva: x(1)=A; x(2)=-A,
x(3)=A, x(4)=-A… Gli atomi 1, 3, 5… cioè tutti gli atomi dispari, che sono tutti e soli gli atomi di
sodio, si spostano nella stessa direzione, della stessa quantità A; tutti gli atomi pari (quelli di cloro)
si spostano della medesima quantità, ma nel verso esattamente opposto (quantità –A). Questo è
proprio uno dei modi vibrazionali di stretching visti sopra per la piccola molecola NaCl e (NaCl)2:
possiamo considerarlo come uno stretching associato ad una lunghezza d’onda pari a 2 volte la
distanza d, di equilibrio, Na-Cl. Ancora, la distanza 2d corrisponde a una caratteristica importante
della nostra catena:
Na --- Cl --- Na --- Cl --- Na --- Cl --- Na
d
d
d
d
d
d
Precisamente, 2d è la più piccola distanza tra due atomi di sodio (o di cloro) e corrisponde alla
lunghezza della cella elementare del nostro cristallo monodimensionale: ripetendo lungo la
direzione Z tante unità (n unità) Na---Cl---, una affiancata all’altra, otteniamo infatti l’intera catena
(NaCl)n avente lunghezza 2nd. Il lato della cella elementare vale proprio 2d, e tale cella contiene un
atomo di sodio e uno di cloro.
In definitiva, una vibrazione del tipo
è una traslazione, cioè un modo di stretching a lunghezza d’onda infinita.
Una vibrazione
è un modo di stretching con lunghezza d’onda pari alla lunghezza della cella elementare.
E una vibrazione del tipo
a cosa corrisponde?
Vediamo… consideriamo ad esempio il sodio (frecce rosse): il moto di questo si inverte passando
da una cella elementare a quella vicina; questo vuol dire
x(1) = A, x(3) = -A…
da cui:
cos (2πz1/λ)=1; cos (2πz3/λ)=-1;…
ma allora 2πz3/λ = π, e quindi, poiché z3 = 2d, risulta λ = 4d. Tale moto vibrazionale è dunque uno
stretching associato ad una lunghezza d’onda pari a 4d. In tal modo, tutti i modi vibrazionali di
stretching vengono ad essere associati a onde caratteristiche le cui lunghezze (appunto, d’onda)
variano tra 2d (la più piccola) e infinito, quest’ultima essendo corrispondente alla traslazione rigida
dell’intera catena (in tal caso lungo Z). Continuando l’analisi, si osserva che quest’onda associata ad
ogni modo vibrazionale modula l’ampiezza di oscillazione di ogni atomo da un valore zero (atomo
fermo) a un valore massimo pari ad A. Tale onda di modulazione viaggia nella stessa direzione di
oscillazione dei singoli atomi e viene, perciò, detta longitudinale.
Considerazioni del tutto equivalenti valgono per i modi di bending e, poiché in tal caso l’onda di
modulazione (ancora lungo Z che è la direzione di allungamento della catena) è perpendicolare alle
direzioni di oscillazione degli atomi (queste ultime essendo lungo X e Y), vien detta trasversale.
Per ogni lunghezza di modulazione abbiamo un’onda longitudinale e due trasversali (due trasversali
rispetto ai moti atomici lungo X e Y).
Per ragioni un po’ troppo difficili tra trattare ora, ma che potremmo vedere più avanti, i modi
associati a lunghezza d’onda infinita o multipla di 2d (aventi quindi λ=∞, 2d, 4d, …) vengono detti
di centro zona. Nel nostro caso, con riferimento ai modi longitudinali, abbiamo visto due diversi
modi di centro zona: quello con λ infinita che corrispondeva alla traslazione del cristallo, e quello
con λ=2d in cui tutti gli atomi di sodio oscillavano con la stessa ampiezza in tutte le celle, e in
opposizione di fase rispetto agli atomi di cloro (cioè con gli atomi di cloro che si muovono nel verso
opposto a quello del sodio). Il primo modo vien detto acustico (vedremo poi la ragione), il secondo
ottico. La traslazione è dunque un modo acustico di centro zona.
Passando dal cristallo monodimensionale al cristallo reale tridimensionale il quadro resta invariato
nelle caratteristiche principali: avremo 3 modi acustici (che nel centro zona diventano le tre
traslazioni), di cui uno longitudinale e due trasversali, e un certo numero di modi ottici sia
trasversali, sia longitudinali, in dipendenza di quanti atomi ci sono nella cella elementare.
Spazio reciproco e curve di dispersione.
Buona parte della fisica dello stato solido, compresa quella che tratta delle vibrazioni cristalline, è
descritta all’interno di un spazio che non è quello usuale, ma viene detto reciproco. Non entro qui
nei dettagli della definizione di tale spazio e delle sue proprietà, perché la matematica necessaria è
piuttosto complessa. Mi limito perciò ad un approccio puramente descrittivo. Per semplificare
ulteriormente, farò ancora riferimento al cristallo monodimensionale visto nel paragrafo precedente.
Avevamo individuato la cella cristallina nel segmento Na---Cl--- di lunghezza 2d, dove d è la
distanza Na-Cl. Chiamiamo con a la quantità 2d (a = 2d è dunque il parametro di cella). Passiamo
ora dal cristallo al reticolo soggiacente:
a
A
O
La distanza tra due punti contigui del reticolo è a; una cella elementare è per esempio rappresentata
dal segmento O-A e contiene un atomo di Na e un atomo di Cl.
A partire da questo reticolo, possiamo definirne un altro, detto reciproco, per cui la distanza tra
punti contigui (sia b) vale 2π/a: b=2π/a.
b
B’
O
B
Anche questo reticolo, al pari del reticolo diretto che rappresenta il cristallo, è periodico (la distanza
tra ogni coppia di punti contigui è costante e pari a b); presenta quindi simmetria traslazionale e,
come per il diretto, è definibile una cella elementare, per esempio il segmento O-B. Anziché tale
segmento, nel reciproco conviene però definire una cella elementare diversa (ma equivalente alla
prima, nel senso che l’affiancamento di tutte le celle elementari riproduce ancora l’intero reticolo
reciproco): detta O l’origine del reticolo reciproco, si definisce cella reciproca il luogo dei punti
(dello spazio in cui il reticolo è immerso – spazio reciproco) più vicini a O rispetto a qualsiasi altro
punto del reticolo. Tale luogo di punti coincide dunque col segmento che va dalla metà del
segmento B’-O, fino alla metà del segmento O-B. La sua lunghezza è ancora b, con estremi aventi
coordinate (rispetto all’origine O del reticolo) -π/a, π/a. Questo segmento viene chiamato prima
zona di Brillouin. L’origine è detta centro zona (di Brillouin), mentre gli estremi sono il bordo
zona. Data l’equivalenza di ogni punto del reticolo reciproco a ogni altro del medesimo (in effetti
possiamo assegnare come origine qualunque punto del reticolo), in pratica ogni punto di detto
reticolo è anche un centro zona.
Lo spazio e il reticolo reciproco servono, tra le altre cose, per rappresentare i vettori d’onda delle
vibrazioni cristalline; il vettore d’onda è, appunto, un vettore avente come direzione e verso quello
di propagazione dell’onda medesima e come lunghezza (modulo) la quantità 2π/λ, essendo λ la
relativa lunghezza d’onda. Avevamo visto che le traslazioni del cristallo sono assimilabili a modi
vibrazionali aventi lunghezza d’onda infinita, e quindi avranno vettore d’onda di lunghezza nulla
(2π/λ è un numero che tende a zero all’aumentare di λ): il punto del reciproco che rappresenta tali
vettori d’onda è dunque l’origine del reticolo, cioè il centro zona.
Avevamo visto che il modo avente λ = 2d = a corrisponde a quello in cui tutti gli atomi di Na si
spostano della stessa quantità e nella stessa direzione, che è esattamente opposta a quella degli
atomi di Cl. Nel nostro spazio reciproco, il vettore d’onda corrispondente a questo modo è
rappresentato dal punto B della figura sopra; ma, nel reticolo, B è equivalente ad O, dunque lo
stesso vettore d’onda dovrebbe anche essere rappresentato dal punto O… e in effetti è proprio così!
Infatti, per questo modo, le caratteristiche del moto atomico (cioè le ampiezze dei moti dei vari
atomi) non cambiano passando da una cella all’altra (ripeto la frase scritta sopra…”tutti gli atomi di
sodio si spostano della stessa quantità e nella stessa direzione”, e lo stesso accade per quelli di
cloro); dunque, a tutti gli effetti, questo modo si comporta come uno avente lunghezza d’onda
infinita. Possiamo anche immaginarlo come una traslazione rigida del sottoreticolo del sodio, che si
muove in modo opposto al sottoreticolo del cloro. In definitiva, tale modo è descritto dal punto O,
che è all’interno della prima zona di Brillouin (ne è proprio l’origine) ed è un altro modo di centro
zona (modo ottico).
Una considerazione, e generalizzazione, importante a questo punto è che ogni modo descritto da un
vettore d’onda rappresentato da un punto all’esterno della prima zona di Brillouin è pure
rappresentabile da un punto all’interno di questa. Precisamente: sia G il vettore corrispondente al
segmento O-B (il vettore G è il segmento orientato di origine O e punto finale B):
O
G
B
definiamo l’insieme di tutti i vettori del reticolo reciproco attraverso la scrittura nG, dove n è un
qualunque numero intero positivo o negativo, zero compreso (per esempio, i vettori -2G; -1G = -G;
0G ≡ 0; G e 2G sono vettori del reticolo; 1.5G invece non lo è…). Formalmente possiamo scrivere
che B=O+G e B’=O-G (oppure, B’=O+(-G)). Attraverso questa definizione diciamo che
due punti A e B dello spazio reciproco sono equivalenti se il vettore A-B appartiene all’insieme nG;
oppure, in altre parole, se esiste un numero intero n, positivo o negativo, tale che A-B=nG.
I punti B’ e B sono evidentemente equivalenti a O, poiché i vettori B’-O e B-O sono vettori del
reticolo reciproco (-G e G, rispettivamente).
Ne deriva che i vettori d’onda di tutti i modi normali di vibrazione nel cristallo possono essere
rappresentati dai soli punti appartenenti alla prima zona di Brillouin.
Cosa dire del modo avente lunghezza d’onda λ pari a 4d = 2a? Avevamo visto che questo è un
modo schematizzabile come
con gli atomi di sodio e cloro che cambiano la direzione del moto passando da una cella a quella
vicina. Per λ=2a, k=2π/λ = 2π/2a = π/a: siamo esattamente al bordo zona di Brillouin. E’ da tener
presente che in uno schema di moto come disegnato sopra non si tiene conto della reale ampiezza
dei moti atomici, che possono essere diversi per atomi di specie diversa (e, in generale, le ampiezze
per Na sono diverse da quelle per Cl). In particolare, per certi modi, le ampiezze dei moti per una
delle due specie può essere nulla. Abbiamo in effetti due modi, entrambi di bordo zona, in cui in un
caso (1) Na si muove e Cl rimane fermo, e in un altro (2) è il sodio a rimaner fermo, mentre Cl si
muove:
1) • • • •
2) • • • •
Per la nostra catena, con riferimento ai soli modi longitudinali (come abbiamo visto, si tratta di
quelli associati a onde aventi vettori d’onda paralleli alla catena), a ogni punto k dello spazio
reciproco monodimensionale sono associati due modi dei quali uno è detto acustico e l’altro ottico;
per il centro zona, il modo acustico coincide con la traslazione; per il bordo zona, il modo acustico
corrisponde al modo (1), visto sopra, e quello ottico al modo (2).
Ad ogni modo di vibrazione corrisponde una frequenza (sia ν) ben definita e, poiché ogni modo è
associato a un particolare vettore k dello spazio reciproco, ne deriva una relazione tra ν e k e, cioè,
una funzione ν(k): questa funzione prende il nome di curva di dispersione. Rimanendo al caso della
catena, poiché a ogni punto k sono associate due onde (con frequenze in generale diverse), avremo
in pratica due diverse curve di dispersione, di cui una, νa(k), associata ai modi acustici e l’altra,
νo(k), ai modi ottici. La figura sottostante mostra il risultato di un calcolo delle curve di dispersione
nel caso della catena infinita di fluoruro di litio (LiF; Li-F-Li-F-Li-F… parente stretta di NaCl). La
zona rappresentata nello spazio reciproco è metà della prima zona di Brillouin, e va dall’origine al
bordo zona positivo. In ascissa (asse orizzontale) sono riportati i valori di k/k0, dove k0 indica il
modulo (lunghezza) del vettore B-O del reticolo reciproco (k0 è il modulo di G): entro la prima zona
di Brillouin k/k0 varia da 0 (centro zona) a 0.5 (bordo zona). In ordinata (asse verticale) sono
riportate le frequenze calcolate per alcuni valori di k/k0.
Nella figura sono visibili due rami: quello più in basso (a più basse frequenze) parte con frequenza
nulla all’origine (ν=0 per k/k0=0) e arriva fino a una frequenza di circa 500 cm-1 a bordo zona;
questo viene detto ramo acustico. Il ramo ottico è quello più in alto, corrispondente a una frequenza
di circa 920 cm-1 a centro zona, ed una di 850 cm-1 a bordo zona.
Ogni onda ha associata una velocità di propagazione: la velocità V di un’onda è pari al prodotto
della sua frequenza (ν) per la lunghezza d’onda (λ); in formule: V= λν. Esprimendo λ in funzione di
k=2π/λ, si ha V = 2πν/k = ω/k (avendo posto ω=2πν: frequenza angolare). In LiF (catena) il
parametro di cella a vale 3.36 Å; k0 vale allora 2π/3.36·10-10 = 1.87·1010 m-1. Per il ramo acustico la
pendenza della curva νa(k) è circa costante; tale pendenza è proprio il rapporto νa(k)/k = ωa(k)/2πk =
V/2π, per cui dalla pendenza della curva di dispersione acustica è possibile risalire alla velocità
delle onde acustiche longitudinali: nel caso specifico della catena LiF, dal grafico riportato, si
ricava per tale velocità il valore di 877 metri al secondo. Questa è la velocità di propagazione del
suono lungo la nostra catena monodimensionale infinita di LiF (per questo si parla di ramo
acustico).
La velocità del suono ricavata per la catena lineare è molto superiore a quella che si misura nell’aria
(340 m/sec) ed è in linea con quella che si osserva nelle fasi condensate: ad esempio, in acqua si
registra un valore di 1460 m/sec, mentre nel ferro si ha una velocità di 5000 m/sec. E’ interessante
notare l’andamento della curva νa(k) nei pressi del bordo zona (k ≈ 0.5): la pendenza tende a zero,
ed è esattamente zero al bordo zona; ciò vuol dire che la velocità del suono lungo la catena si
annulla per frequenze prossime a 530 cm-1, per le quali k/k0 ≈ 0.5; in effetti nessun suono può
propagarsi lungo la catena per frequenze comprese tra 530 e 846 cm-1, quest’ultima essendo la
frequenza a bordo zona del ramo ottico (si tratta di frequenze ampiamente nel campo degli
ultrasuoni).
Il ramo ottico deriva il suo nome dal fatto che le vibrazioni di frequenza non nulla, a centro zona,
(quelle a 920 cm-1 nel nostro caso) sono in grado di interagire con la radiazione elettromagnetica
assorbendola: il campo elettrico oscillante associato alla radiazione elettromagnetica entra in
risonanza con quello prodotto, entro il cristallo, dalla vibrazione e l’energia radiante
elettromagnetica viene convertita in energia meccanica di movimento degli atomi, con aumento
delle ampiezze di vibrazione; si parla in tal caso di eccitazione dei modi normali di vibrazione.
Vibrazioni: onde o particelle?
Uno dei concetti più importanti in ambito quantistico, che trova conferme sperimentali continue ed
è sfruttato in molti dispositivi tecnologici, è il cosiddetto dualismo onda-particella: ad ogni
particella risulta associata un’onda avente lunghezza λ=h/p, dove h è la costante di Planck (che vale
6.626·10-34 j·sec) e p è l’impulso della particella. Per una particella dotata di massa m, avente
velocità V, si ha p = mV; tale espressione vale se la velocità non è troppo alta e prossima alla
velocità della luce, nel qual caso occorre usare l’espressione relativistica per l’impulso. La stessa
relazione tra λ e p vale anche per particelle non dotate di massa per le quali p è definito in maniera
differente. Questa associazione tra onde e particelle trova il suo culmine nella moderna teoria delle
stringhe che tratta come corde vibranti tutte le particelle elementari. Ebbene, vale anche l’inverso:
se un oggetto tradizionalmente pensato come particella viene, in talune circostanze, trattato come se
fosse un’onda, anche un oggetto tradizionalmente pensato come un’onda può essere trattato come
una particella! In effetti, è proprio il formalismo della meccanica quantistica che supporta l’idea di
onde interpretate come particelle. Il caso più noto e comune è quello della radiazione
elettromagnetica: all’onda elettromagnetica viene associato il concetto di fotone, una particella a
massa nulla che trasporta il campo elettromagnetico oscillante; nella discussione di molti fenomeni
in cui è implicata la luce è conveniente descrivere il campo radiante come un fascio di fotoni che si
propaga nella direzione del fronte d’onda. In generale, a ogni forza fondamentale nota in fisica
(forza gravitazionale; elettromagnetica; forza nucleare forte e forza debole) è associato un campo
oscillante e una particella portatrice del campo: abbiamo così i gravitoni, i fotoni, i gluoni e le
particelle W e Z0 che trasportano i campi associati alle 4 forze fondamentali. I gravitoni e i fotoni
sono particelle a massa nulla, il che comporta un raggio d’azione infinito per le forze implicate; i
gluoni e le particelle W e Z0 sono invece dotate di massa e il campo d’azione delle corrispondenti
forze è allora limitato spazialmente; ad esempio, le forze nucleari che sono responsabili della
grande coesione delle particelle (protoni e neutroni) entro un nucleo, hanno un raggio d’azione
ridotto a una frazione delle dimensioni del nucleo atomico.
E’ possibile, anzi conveniente in molti casi, associare ai modi normali di vibrazione in un cristallo
una particella particolare: il fonone. Si tratta, come per il fotone, di una particella a massa nulla, la
cui esistenza è limitata all’interno del cristallo. L’impulso p del fonone è pari a hk/2π, dove h è la
costante di Planck e k=2π/λ (in tal modo si ha p=h/λ).
A suo tempo avevamo già detto che l’energia associata a un oscillatore armonico è
1
E = ( n + ) hν
2
Tale energia dipende dal numero quantico n: data la frequenza ν dell’oscillatore, le sole energie
possibili per questo sono quelle che si ottengono assegnando a n tutti i possibili valori interi, zero
compreso. L’energia più bassa per l’oscillatore (quella di punto zero) si ottiene per n=0; al salire di
n, l’energia cresce e l’oscillatore si dice essere in uno stato vibrazionale eccitato (ad energie
maggiori, a parità di frequenza, si hanno ampiezze di oscillazione via via crescenti). In un cristallo,
poiché la frequenza di ogni oscillatore (modo normale) è legata al numero d’onda k ed esistono tanti
modi normali in funzione del numero di atomi della cella elementare, potremmo scrivere
1
E n ( k , j ) = ( n + ) hν j ( k )
2
dove l’indice j identifica un particolare ramo tra quelli esistenti (ottico o acustico che sia).
Nel linguaggio particellare, identifichiamo il numero quantico n con il numero di fononi, nj(k), di
frequenza νj(k), nel cristallo, aventi energia
E ( k , j ) = hν j ( k )
e l’energia totale vibrazionale del cristallo sarà data specificando il numero di fononi per ogni modo
normale (k,j):
1
E = ∑ [ n j ( k ) + ]E ( k , j )
2
j ,k
dove il simbolo Σj,k indica la sommatoria su tutti i fononi di tipo j e k. Nel caso della catena lineare
di NaCl (of LiF), limitatamente alle vibrazioni longitudinali, l’indice j identifica i due soli rami
acustico o ottico, e l’indice k è continuo su tutti i punti dello spazio reciproco entro la prima zona di
Brillouin (BZ); tecnicamente, data la continuità di k, la sommatoria su quella variabile dovrà essere
sostituita da un integrale:
1
E = h ∑ ∫ [ n j ( k ) + ]ν j ( k )dk
2
j BZ
L’energia vibrazionale del cristallo dipende dal numero di fononi esistenti per ogni frequenza; tale
numero dipende dalla temperatura del cristallo ed è regolato da una legge statistica ben precisa che
prende il nome di distribuzione di Bose-Einstein, legge a cui soddisfano tutte le particelle analoghe
ai fononi, come ad esempio i fotoni, che vengono collettivamente chiamate bosoni (le altre
particelle elementari che costituiscono la materia, come gli elettroni, i protoni, ecc… vengono dette
fermioni e soddisfano alla statistica di Fermi-Dirac). Il numero di fononi, per ciascuna frequenza, a
ogni temperatura è dunque regolato dalla legge di Bose-Einstein. Si parla di gas di fononi
all’interno del cristallo. A differenza dei fermioni, il numero di bosoni non è vincolato ad alcun
valore costante, invariante nel tempo: il numero di fononi non è dunque costante. In particolare, a
zero Kelvin non esiste alcun fonone (ogni oscillatore è nello stato di energia minima con numero
quantico nj(k)=0); a temperature superiori il cristallo si popola di fononi, il che vuol dire che
aumentano le ampiezze di oscillazione degli atomi.
A ogni temperatura, il numero nj(k) di fononi associati al modo normale (k, j) dipende comunque
dalla frequenza νj(k): tanto più alta è quest’ultima, tanto più basso sarà il numero di fononi
corrispondenti; in pratica a basse temperature avremo moltissimi fononi acustici nelle vicinanze del
centro zona (che hanno basse frequenze, si veda la figura sopra) e solo pochi fononi ottici.
Introducendo l’argomento sui modi normali di vibrazione in molecole e cristalli, avevamo parlato di
potenziali armonici; ebbene, entro un modello puramente armonico per il cristallo infinito (cioè
privo di superfici) i fononi non possono interagire tra di loro. Tuttavia il potenziale all’interno di un
cristallo non è mai puramente armonico: esistono le cosiddette componenti anarmoniche del
potenziale (inoltre un cristallo reale è dotato di superficie), e queste rendono possibile l’interazione
tra i vari fononi. Abbiamo allora urti tra fononi, che possono in tal modo scambiarsi impulso ed
energia senza il vincolo di conservazione del numero totale di particelle (ma col vincolo della
costanza dell’energia e dell’impulso complessivi); ad esempio, due fononi di impulso p1 e p2 ed
energie E1 ed E2 possono entrare in collisione per dare origine a un unico fonone di energia
E3=E1+E2 e impulso p3=p1+p2; la probabilità di queste collisioni aumenta con l’entità dei termini
anarmonici e con la temperatura che porta a un incremento del numero di fononi e, dunque, della
densità del gas all’interno del cristallo.
L’anarmonicità del potenziale è una caratteristica relativamente facile da individuare
macroscopicamente: l’espansione termica di un cristallo (l’aumento delle sue dimensioni con la
temperatura) è per esempio un suo effetto diretto ed è misurata per qualunque sostanza cristallina.