LE PROTEINE
Dopo l’acqua, i costituenti principali della materia vivente sono le
proteine.
Il corpo umano è formato da 65% di acqua, 16% di proteine, 13% di grassi
e una piccola quantità di carboidrati.
Le PROTEINE sono polimeri formati da monomeri detti amminoacidi (AA),
uniti a formare lunghe catene chiamate catene polipeptidiche.
Una proteina è formata da 1 o più catene polipeptidiche ripiegate su se
stesse fino ad assumere una precisa struttura tridimensionale.
Hanno dimensioni molto variabili, da quelle più piccole come l’ormone
Insulina, a quelle più grandi come la Titina (proteina muscolare).
Molte proteine sono formate da più di una catena polipeptidica come
l’Emoglobina.
STRUTTURA DELLE PROTEINE
AMMINOACIDI
ISOMERIA OTTICA
Gli amminoacidi sono in tutto 20. Il carbonio centrale asimmetrico, cioè
che lega (con legami covalenti) i 4 sostituenti diversi, è detto
è quindi un carbonio chirale.
, ed
Gli amminoacidi con il carbonio centrale chirale hanno isomeria ottica ( e
possono quindi esistere 2 isomeri di questi AA, l’isomero D e l’isomero L).
Di questi 20 amminoacidi, 19 sono chirali, la glicina non è chirale in
quanto ha 2 sostituenti uguali, perché R nella glicina è uguale ad H, e
quindi non ha isomeria ottica. (gli altri 19 AA hanno isomeria ottica).
Glicina R = H
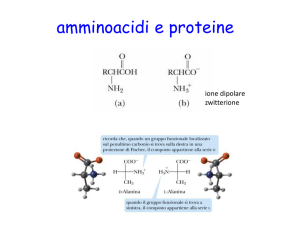
Se immaginiamo di vedere un amminoacido in modo tridimensionale sul
foglio, dovremmo disegnarlo così:
La linea tratteggiata indica che il gruppo è sotto il piano, il cuneo indica
che il gruppo è sopra il piano. Gli amminoacidi secondo la proiezione di
Fischer vanno disegnati come nell’immagine che segue:
In natura esiste solo l’isomero L degli amminoacidi, cioè con il gruppo
NH3 a sinistra (si ha invece l’isomero D quando NH3 è a destra).
Anche gli amminoacidi possono deviare la luce polarizzata a destra o a
sinistra. Quando l’AA è sotto forma di ione bipolare si chiama zwitterione,
e si può comportare sia da acido che da base (comportamento anfotero).
ESEMPI di AA
Cisteina molto importante (perché fa legami particolari detti ponti
disolfuro che vedremo in seguito) R = CH2 - SH
Acido Aspartico
Alanina
Lisina
Serina
CLASSIFICAZIONE DEGLI AA IN BASE AL GRUPPO R
I vari gruppi R dei 20 AA hanno proprietà diverse a seconda se hanno
carica POSITIVA, NEGATIVA, POLARI, ecc….
1) Gruppi R apolari idrofobici (cioè non vanno d’accordo con l’acqua),
questi gruppi R tendono a stare all’interno della proteina (es:
alanina). Sono 6 AA
2) Gruppi R polari (cioè idrofili) non carichi, questi gruppi formano
legami H con l’acqua (es: cisteina, serina). Sono 6 AA
3) Gruppi R polari idrofili con carica positiva (es: lisina). Sono 3 AA.
4) Gruppi R polari idrofili con carica negativa (es: acido aspartico). Sono
2 AA
5) Gruppi R aromatici (con catene laterali aromatiche come la
fenilalanina). Sono 3 AA.
LE PROTEINE POSSONO AVERE MOLTEPLICI
FUNZIONI:
1)
2)
3)
4)
5)
Sostegno meccanico
Protezione
Trasporto
Catalitica di alcune reazioni chimiche
difensiva
LEGAME PEPTIDICO
I peptidi e le proteine sono polimeri di AA legati tra loro da un legame
peptidico. Il legame peptidico tra 2 AA diversi si forma tra il gruppo
carbossilico di un AA e il gruppo amminico dell’altro AA, e si libera una
molecola di acqua.
+
STRUTTURA DELLE PROTEINE
Nelle proteine vi sono 4 livelli di organizzazione strutturale
1) STRUTTURA PRIMARIA
Sequenza di AA legati tra loro da legami peptidici. Tutte le proteine
esistenti derivano da combinazioni diverse dei 20 AA naturali.
2) STRUTTURA SECONDARIA
Consiste nella regolare ripetizione di ripiegamenti caratteristici che
interessano regioni diverse della catena polipeptidica. In ambiente
acquoso la catena polipeptidica assume strutture regolari e
ripetitive ( eliche, foglietti) molto stabili (e quindi con minima
energia interna della molecola).
Possono essere di 2 tipi:
α-ELICA nella quale la catena polipeptidica è avvolta a formare
una spirale destrogira, grazie a dei legami idrogeno che si
formano tra l’ossigeno del gruppo C=O e l’idrogeno del gruppo
N-H di un altro AA. Questa struttura può essere impedita se ci
sono dei gruppi R molto grandi o con cariche che si
respingono.
La troviamo nelle cheratine che si trovano nei capelli, nelle
unghie, nei peli e nelle penne degli uccelli.
β A FOGLIETTO PIEGHETTATO formate a partire da 2 o più
catene polipeptidiche che si affiancano e sono tenute insieme.
I legami sono sempre tra C=O ed N-H
Spesso le proteine hanno entrambe le strutture.
3) STRUTTURA TERZIARIA
Produce una specifica forma tridimensionale, la cui superficie
esterna presenta gruppi funzionali capaci di svolgere particolari
reazioni chimiche con altre molecole specifiche. Questa struttura
conferisce alla proteina la massima stabilità in quanto è la struttura
con il minor contenuto energetico possibile. I responsabili di queste
strutture terziarie sono le interazioni tra i gruppi R.
La struttura terziaria è stabilizzata da legami tra catene laterali di
residui AA che si trovano spazialmente vicini:
Legame ionico tra AA carichi positivi e AA carichi negativi.
Legame a idrogeno tra gruppi donatori di H e gruppi accettori
di H presenti nelle catene laterali.
LEGAME IDROFOBICO: tendenza delle catene laterali non
polari ad unirsi tra loro in modo da offrire la minore superficie
al solvente acquoso.
PONTE S-S (ponte disolfuro): legame covalente. Importante
nella stabilizzazione della struttura terziaria. Si forma quando,
dopo che la proteina ha assunto la struttura terziaria, due
gruppi –SH (di 2 cisteine) vengono a trovarsi spazialmente
vicini e si ossidano.
Sulla base dei diversi livelli strutturali assunti, le proteine sono classificate
in FIBROSE e GLOBULARI
PROTEINE FIBROSE. La struttura secondaria è prevalente. Sono
costituite da lunghe catene polipeptidiche disposte in lunghi fasci o
foglietti .
Struttura estremamente ordinata
Funzione di protezione e sostegno
Rappresentano fino a 1/3 del peso in proteine dei vertebrati
Sono costituiti prevalentemente da proteine fibrose:
a) Pelle, Piume, Capelli, Corna, Unghie e Squame con funzione di
PROTEZIONE
b) Cartilagine, Tendini e ossa con funzione di SOSTEGNO.
Sono insolubili in acqua perché costituite prevalentemente da AA
con radicali idrofobici che sporgono verso l’esterno della
struttura
PROTEINE GLOBULARI. Assumono struttura terziaria e qualche volta
quaternaria
Sono macromolecole compatte di forma più o meno sferica. Hanno
una struttura meno ordinata delle fibrose.
Funzione di trasporto e di catalisi
Ne fanno parte tutte le proteine che intervengono nella regolazione
delle attività della cellula.
Sono proteine globulari: Enzimi, Trasportatori di ossigeno e lipidi nel
sangue, alcuni Ormoni Recettori di membrana, Anticorpi
4) STRUTTURA QUATERNARIA
Molte proteine funzionali contengono 2 o più catene polipeptidiche,
chiamate subunità, ciascuna ripiegata nella sua specifica struttura
terziaria.
La struttura quaternaria è il risultato del modo in cui le subunità si
legano insieme tramite interazioni non covalenti (le subunità sono
unite mediante legami H, ionici, idrofobici).L’unione delle subunità
può permettere l’insorgere di proprietà non possedute dai singoli
monomeri.
L’alterazione della struttura tridimensionale di una proteina è detta
DENATURAZIONE (ESEMPIO: quando si cuoce l’uovo le sue proteine
sono denaturate), ed è accompagnata dalla perdita della propria
funzionalità. La maggior parte delle proteine può essere denaturata con il
calore, che altera i legami deboli, in particolare i legami H. Altri agenti
denaturanti: valori di pH estremi, solventi organici, urea ecc…
LA DENATURAZIONE E’ UN PROCESSO REVERSIBILE Le proteine globulari,
una volta denaturate, possono riacquistare la loro struttura nativa e la
loro attività biologica se vengono riportate nelle condizioni in cui la
conformazione attiva è stabile.