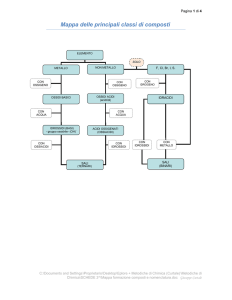
Nomenclatura
Composti binari
OSSIDI BASICI
Metallo + ossigeno
ossido basico
1° caso: il metallo forma un solo ossido
Na (n°ox = +1) +
O2 (n° ox = -2)
Na2O (da bilanciare)
Nella costruzione della formula il n° di ossidazione del primo elemento (senza il segno) diventa il
pedice del secondo e viceversa.
Nomenclatura:
composto
Na2O
n° ox Na
+1
tradizionale
Ossido di sodio
IUPAC
Ossido di disodio
Per metalli che, come il sodio, hanno un solo n° di ossidazione il nome tradizionale si costruisce
semplicemente facendo seguire ad ossido il nome del metallo. I metalli che hanno un solo n° di
ossidazione, e quindi formano soltanto un ossido, sono quelli del I gruppo A (+1), del II gruppo A
(+2) e del III gruppo A l’alluminio (+3). Inoltre Ag (+1), Zn (+2)
Fe (n° ox = +2) + O2
FeO
Fe (n° ox = +3) + O2
Fe2O3
2° caso: il metallo forma due ossodi
nomenclatura
composto
FeO
Fe2O3
n° ox Fe
+2
+3
tradizionale
Ossido ferroso
Ossido ferrico
IUPAC
Monossido di ferro
Triossido di diferro
L’ossido in cui il metallo presenta il valore più basso del n° di ox prende il suffisso –oso, quello in
cui presenta il valore più alto, il suffisso –ico. I metalli con due numeri di ossidazione più comuni
sono: Fe e Cr (+2 e +3), Cu e Hg (+1 e +2), Pb e Sn (+2 e +4)
ANIDRIDI (O OSSIDI ACIDI)
Primo caso: il non metallo forma solo una anidride
Non metallo + O2
C (n° ox = +4)
+ O2
anidride
CO2
Nomenclatura
composto
CO2
n° ox del C
+4
tradizionale
Anidride carbonica
IUPAC
Biossido di carbonio
Altri elementi tipici che formano una sola anidride sono il B e il Si
Secondo caso: il non metallo forma due anidridi
As (n° ox +5) + O2
As2O5
As (n° ox +3) + O2
As2O3
Nomenclatura
composto
As2O5
As2O3
n° ox dell’As
+5
+3
tradizionale
Anidride arsenica
Anidride arseniosa
IUPAC
Pentossido di diarsenico
Triossido di diarsenico
Una regola generale vuole che il n° di ossidazione più alto per ogni elemento sia pari al gruppo di
appartenenza; per gli elementi dal quarto gruppo in poi i numeri di ox inferiori, più importanti, si
ottengono scendendo di due unità una o più volte. Gli altri non metalli che formano due anidridi tra
gli elementi tipici sono quelli del V gruppo ad eccezione dell’azoto e del fosforo che ne formano
tre, tra quelli del VI ci sono lo S e il Se. Ricava nomi e formule delle anidridi dello S.
Terzo caso: il non metallo forma tre anidridi
N (n° ox +5) + O2
N2O5
N (n° ox +3) + O2
N2O3
N (n° ox +1) + O2
N2O
Nomenclatura
composto
N2O5
N2O3
N2O
n° ox dell’N
+5
+3
+1
tradizionale
Anidride nitrica
Anidride nitrosa
Anidride iponitrosa
Ricava le formule e i nomi delle tre anidridi del P.
Quarto caso: il non metallo forma quattro anidridi
Cl (n° ox +7) + O2
Cl2O7
Cl (n° ox +5) + O2
Cl2O5
Cl (n° ox +3) + O2
Cl2O3
IUPAC
Biossido di diazoto
Triossido di diazoto
Monossido di diazoto
Cl (n° ox +1) + O2
Cl2O
Nomenclatura
composto
Cl2O7
Cl2O5
Cl2O3
Cl2O
n° ox del Cl
+7
+5
+3
+1
tradizionale
Anidride perclorica
Anidride clorica
Anidride clorosa
Anidride ipoclorosa
IUPAC
Eptaossido di dicloro
Biossido di dicloro
Triossido di dicloro
Monossido di dicloro
Bromo e iodio fanno parte del VII gruppo come il Cl, fanno eccezione perché formano tre anidridi
ma, a parità di n° di ox, mantengono la stessa nomenclatura delle anidridi del cloro, non formano
l’anidride bromosa e l’anidride iodosa.
IDRURI
a) Idruri metallici: (o ionici) formula generale MeHn
I metalli sono meno elettronegativi dell’idrogeno pertanto in questi composti l’idrogeno ha n° di ox
-1. Si usa la nomenclatura dei composti binari che non contengono ossigeno, il nome si ottiene
facendo seguire la desinenza –uro all’elemento più elettronegativo, nel nostro caso l’idrogeno,
quindi si aggiunge il nome del metallo. Es
Nomenclatura
composto
NaH
MgH2
AlH3
FeH2
FeH3
n° ox del Me
+1
+2
+3
+2
+3
tradizionale
Idruro di sodio
Idruro di magnesio
Idruro di alluminio
Idruro ferroso
Idruro ferrico
IUPAC
Idruro di sodio
Diidruro di magnesio
Triidruro di alluminio
Diidruro di ferro
Triidruro di ferro
b) Idruri covalenti: formula generale XHn dove X è il non metallo
In questi composti il non metallo è un elemento più elettronegativo dell’idrogeno quindi andrebbe
scritto dopo (HnX), si preferisce mantenere questa forma per riservare l’altra agli idracidi (punto C)
Nomenclatura
composto
NH3
PH3
CH4
SiH4
n° ox del non metallo
-3
-3
-4
-4
c) Idracidi: formula generale HnX
tradizionale
Idruro di azoto - ammoniaca
Idruro di fosforo - fosfina
Idruro di carbonio - metano
Idruro di silicio - silano
IUPAC
Triidruro di azoto
Triidruro di fosforo
Tetraidruro di carbonio
Tetraidruro di silicio
Sono chiamati idracidi perché in acqua liberano ioni H+, il loro nome si ottiene facendo seguire il
suffisso -idrico al nome del non metallo preceduto dal termina acido.
Nomenclatura
composto
HF
HCl
HBr
HI
H2S
H2Se
n° ox del non metallo
-1
-1
-1
-1
-2
-2
tradizionale
Acido fluoridrico
Acido cloridrico
Acido bromidrico
Acido iodidrico
Acido solfidrico
Acido selenidrico
IUPAC
Fluoruro di idrogeno
Cloruro di idrogeno
Bromuro di idrogeno
Ioduro di idrogeno
Solfuro di diidrogeno
Seleniuro di diidrogeno
Altri idracidi sono
HCN (acido cianidrico o cianuro di idrogeno), HN3 acido azotidrico o azoturo di idrogeno
Composti ternari
IDROSSIDI
Hanno formula generale Me(OH)n, dove Me è il simbolo del metallo, n è il suo n° di ossidazione e
OH è il gruppo ossidrile in cui la somma dei numeri di ossidazione vale -1. La loro formula si scrive
facendo seguire al metallo tanti gruppi ossidrili (OH) quanti ne richiede il suo numero di
ossidazione. Si ottengono (in qualche caso solo formalmente) sommando acqua all’ossido del
metallo: ossido basico + H2O
Me(OH)n
es: Al2O3 + 3H2O
2Al(OH)3
Nomenclatura: quella tradizionale adotta lo stesso metodo utilizzato per gli ossidi con la sola
differenza che il termine “ossido di si sostituisce con “idrossido di
composto
NaOH
Fe(OH)2
Fe(OH)3
n° ox Me
+1
+2
+3
tradizionale
Idrossido di sodio
Idrossido ferroso
Idrossido ferrico
IUPAC
Idrossido di sodio
diidrossido di ferro
Triidrossido di ferro
OSSIACIDI
Gli ossiacidi sono composti chimici che si ottengono dalla reazione di un ossido acido con una più
molecole di acqua. Hanno formula generale HmXOn dove X simbolo non-metallo, m numero di
atomi di H, n numero di atomi di O. Per scrivere la formula di un ossiacido è sufficiente sommare
all'anidride 2 atomi di idrogeno e 1 di ossigeno per ogni molecola d'acqua che viene aggiunta,
ovvero contare il numero di atomi di idrogeno, non metallo e ossigeno dei reagenti e semplificando
quando possibile. esempi: a) CO2 + H2O
H2CO3; b) N2O5 + H2O
H2N2O6 = 2HNO3;
c) SO3 + H2O
H2SO4
Nomenclatura tradizionale.
Nella nomenclatura tradizionale il nome dell’ acido si ottiene da quello dell'anidride corrispondente,
sostituendo il termine "acido" al termine "anidride" e mantenendo inalterato il prefisso mentre il
suffisso passa dal femminile al maschile.
Nomenclatura IUPAC.
Prevede per tutti gli acidi la desinenza –ico ed opportuni prefissi moltiplicativi per indicare il
numero di atomi di ossigeno (osso, preferibile ossi), di eventuali altri gruppi e del non metallo. Nel
caso in cui il non metallo presenti più di un numero di ossidazione si fa seguire al nome del non
metallo il suo stato di ossidazione in numero romano racchiuso tra parentesi tonde. Il numero
romano va letto come numero cardinale.
REAZIONE
FORMULA
+4
C O2 + H2O
a n. carbonica
H2CO3
+4
H2S O3
+6
H2S O4
H2 O
2HNO2
acido triossicarbonico ((IV)
acido solforoso
acido triossisolforico (IV)
acido solforico
acido tetraossisolforico (VI)
acido nitroso
acido diossinitrico(III)
H2 O
2HNO3
acido nitrico
acido triossinitrico(V)
+3
+5
N2O5
+
an. nitrica
acido carbonico
+6
H2 O
+3
N2O3
+
an.nitrosa
NOME IUPAC
+4
S O2
+
H2 O
an. solforosa
S O3
+
an. solforica
NOME TRADIZIONALE
+4
+5
In alcuni casi l’anidride può sommare una o più molecole d’acqua, per esempio:
P2O5 + H2O
2HPO3
P2O5 + 2 H2O
H4P2O7
P2O5 + 3 H2O
2H3PO4
con la nomenclatura tradizionale, il nome dell’acido formatosi per somma di una molecola d’acqua
si ottiene aggiungendo il prefisso meta al suo nome tradizionale, con due molecole d’acqua si usa il
prefisso piro e con tre orto, nel nostro esempio avremo gli acidi meta fosforico, piro fosforico e
orto fosforico (generalmente solo fosforico). Ricava gli ossiacidi corrispondenti all’anidride
fosforosa. Presentano acidi meta piro e orto gli elementi P (n° ox 5 e 3) As (n° ox 5 e 3) e Sb (n° ox
5 e 3)
Per la nomenclatura IUPAC non cambia nulla [qualche integrazione: H4P2O7 si chiama acido
eptaossidifosforico (V)]
SALI
La formula del sale si costruisce dal metallo (Me) di n° ox noto (+z) e dal radicale dell’acido (XOm)
di cui conosciamo la somma algebrica dei numeri di ossidazione degli elementi presenti (-n);
Mez+ XOmn-
Men(XOm)z (formula generale)
es: Fe3+ + SO42Nomenclatura tradizionale
Fe2(SO4)3
Si ottiene a partire dal nome dell’ossiacido modificandone il suffisso nel modo seguente:
suffisso dell’acido
diventa
ico
ato
oso
ito
senza premettere acido e aggiungendo il nome del metallo, per esempio Fe2(SO4)3 si chiamo solfato
ferrico
Nomenclatura IUPAC
Per ricavare il nome IUPAC del sale ci serve anche il n° di ox del non metallo (X) che si ottiene da
m∙2-n. (vedi formula generale) dopo di che si può seguire lo schema seguente:
m - ossi - nome di X troncato con l’aggiunta del suffisso ato (m∙2-n, n° numero romano) di – nome
del metallo (z in numero romano se > 1)
applicato a Fe2(SO4)3 ci da:
tetraossisolfato (VI) di ferro (III)
sale
tradizionale
IUPAC
Na3PO4
ortofosfato o fosfato di sodio
tetraossifosfato (V) di sodio
CaSO3
solfito di calcio
triossisolfato (IV) di calcio
CuSO4
solfato rameico
tetraossisolfato (VI) di rame (II)
Fe(NO2)2
nitrito ferroso
diossinitrato (III) di ferro (II)
Fe2(SO4)3
Solfato ferrico
Tetrossisolfato (VI) di ferro (III)