Perugia, 22 settembre 2016
PLS
Raimondo Germani
Università degli Studi di Perugia
Dipartimento di Chimica, Biologia e Biotecnologie
Le Biomolecole & La Vita
La vita è una proprietà emergente
Tutti i componenti che permettono l’esistenza come: gli acidi nucleici,
le proteine, i lipidi, i carboidrati, e moltissime altre biomolecole di per
se non costituiscono la vita.
(La loro presenza è una condizione necessaria ma non sufficiente)
Solo quando queste molecole sono assemblate insieme in un
particolari strutture spazio/temporali, allora la vita può emergere.
Dalla Materia Inanimata alla Vita
Gas e Inorganici
autoorganizzazione
Piccole molecole
organiche
Evoluzione Biologica
Macromolecole
autoorganizzazione
Membrana
Aumento della complessità
Evoluzione Chimica
Terra alle origini
Protocellula
Cellula
Fotosintesi
Nuove funzioni
Respirazione aerobica
Auto-Aggregazione & Funzione
Con il termine Auto-Organizzazione si intende la spontanea acquisizione di un
più alto ordine strutturale.
Questo accade poiché l'ordine Gerarchico Superiore è energeticamente più
favorevole.
Dalla auto-aggregazione scaturisce poi la funzione.
Due Punti di Vista
sull’origine della vita
1. Quello Cellulare:
C’è necessità di un confine (membrana semipermeabile) in maniera da ottenere la
necessaria organizzazione spazio-temporale, la locale concentrazione delle sostanze, la
protezione e la selezione dei nutrienti.
2. Replicazione Molecolare:
Servono solo specie molecolari (es. RNA) che sono in grado di auto-repplicarsi e mutare
(evolversi).
Il termine organico suggerisce che questa settore della chimica è correlato con gli
organismi (gli esseri viventi).
I composti organici sono i mattoni delle cose viventi
La Chimica Organica ha come oggetto di studio i composti organici, cioè i
composti del carbonio, non solo quelli provenienti dalla natura ma anche quelli
sintetizzati direttamente dall’uomo.
milioni di composti chimici conosciuti.
Il 95% sono composti del carbonio.
L’American Chemical Society ha un database con più di 108 di
composti di cui il 92% sono organici
Fino al 18 secolo:
Composti da organismi viventi - Organici
Composti da materia inanimata - Inorganici
I composti organici avevano una “forza vitale”
Friedrich Wöhller 1828: sintesi dell’urea da materiali inorganici, prima molecola di origine
animale ottenuta per via sintetica da materiali inorganici.
O
+
NH4
-
O C
N
calore
H2N
NH2
Ammonio cianato
Urea
(da fonti minerali)
“Inorganico”
(dall’urina)
“Organico”
Discreditato il concetto filosofico di “forza vitale” o “vitalismo”
Finalità e Obiettivi
Prerequisiti
Contenuti & Metodologie Didattiche
Tempi
Valutazione e Strumenti di Verifica
Spazi e strumenti dell’azione didattica
Finalità
Apprendere l’importanza degli -amminoacidi e dei processi che li coinvolgono.
Gli amminoacidi come monomeri dei copolimeri proteici.
Obiettivi Specifici
R
H
+
NH3
O
-
O
Struttura degli ammino-acidi
Comportamento anfotero
Stereoisomeria (Chiralità)
Punto isoelettrico (pI)
Sintesi e metabolismo degli -amminoacidi
Monomeri delle Proteine
FASE 1: Brainstorming
FASE 2: Richiamo concetti pregressi
FASE 3: Introduzione concetti portanti
FASE 4: Lavori individuale e/o di gruppo per la costruzione ed
analisi di mappe concettuali.
FASE 5: Lavoro in laboratorio e/o dimostrazioni
Fase 1: Brainstorming
Per contestualizzare l’argomento
e renderlo più interessante
Osservazioni
Curiosità
Considerazioni
Legate alla Vita Quotidiana
Fase di Brainstorming
Quali cibi sono più ricchi di amminoacidi?
Alcuni Integratori alimentari contengono -amminoacidi puri
I legumi contengono amminoacidi?
I cereali contengono amminoacidi?
Gli amminoacidi li prendiamo solo dai cibi?
Gli amminoacidi sono presenti nell’universo: tracce sono state
trovate nella comete (sonda spaziale Rosetta).
L’esperimento di Miller-Urey induce a pensare che queste
molecole potevano formarsi sulla terra prebiotica.
Fase di Brainstorming
L'esperimento di Miller-Urey è la prima dimostrazione che
le molecole organiche di semplice struttura, come gli
amminoacidi, si possono formare spontaneamente, nelle
giuste condizioni ambientali, a partire da sostanze
inorganiche ed organiche più semplici (CH4, H2, NH3, H2O)
che erano presenti sulla terra ai suoi primordi.
Cellule
Rete metaboliche
Complessi polimerici
BioMacromolecole
Bio-monomeri
Molecole
Anche se i chimici riuscissero ad ottenere tutti i
monomeri prebiotici, non avrebbero comunque la
soluzione dell’origine della vita.
Atomi
Fase di Brainstorming
La vita, cosi come noi la conosciamo e la definiamo, è determinata
da specifiche sequenze macromolecolari come quelle degli acidi
nucleici e delle proteine.
A
F
P
H
Y
Z
Fase 2: Richiamo Concetti Pregressi
Conoscere la struttura e il
comportamento chimico del gruppo
amminico e di quello carbossilico.
Conoscere i principali
meccanismi di reazione dei
composti organici
precedentemente affrontati
Conoscere la finizione di isomero ,
riconoscere gli isomeri costituzionali e
gli stereoisomeri
Conoscere e saper utilizzare la
definizione di specie
nucleofila e elettrofila, di
specie basica e acida secondo
le definizioni di Brønsted e
Lewis.
Conoscere e saper applicare il
significato di ibridizzazione,
conoscere il significato di orbitale
molecolare e i vari tipi di legame.
(enantiomeri e diasteroisomeri).
Conoscere il significato di gruppo funzionale come
atomo o gruppo di atomi che caratterizzano le varie
classi di composti organici in termini di
comportamento fisico e chimico.
Fase 3: Introduzione Concetti Portanti
Ibridizzazione
Struttura
…………………………
Configurazione
Elettronica
Siti reattivi
………………………..
……………………
Tipo Reazioni
…………………………
…………………………
…………………………
………………..
Acido-base
……………………
…………………..
Proprietà fisiche
Fase 5: Costruzione Mappe Concettuali
Strumento
grafico
per
informazione e conoscenza.
La struttura complessiva è di tipo
reticolare, quindi potrebbe non
presentare necessariamente un
"preciso punto di partenza".
rappresentare
Serve per rappresentare in un grafico le
proprie conoscenze centrate su un
argomento.
Costituita da interconnessioni concettuali,
ciascuno dei quali rappresenta un
concetto elementare.
I nodi concettuali sono collegati mediante
delle relazioni di connessione.
Gli ammino acidi sono composti bifunzionali:
Contengono sia un gruppo amminico che uno carbossilico nella stessa molecola
-NH2
5
4
-COOH
2
3
1
-ammino acido
-ammino acido
La presenza contemporanea di un gruppo basico (amminico) ed un gruppo
acido (carbossilico) determina il comportamento anfotero di queste molecole.
Equilibrio acido-base intermolecolare
O
O
R
O
H
H2N
R
R
-
O
pKa ~ 4,5
+
H3N
pKa ~ 9
Equilibrio acido-base intramolecolare
R
O
H2N
O
R
H
+
H3N
O
O
-
Sale interno
Struttura zwitterionica
R
-ammino
Residuo alchilico-
(Catena laterale variabile)
carbossile
carbonio
Sono 20 (23) gli amminoacidi di tipo proteico (stadard): di cui 19 sono ammine
primarie e 1 è un’ammina secondaria endociclica (L-Prolina).
Possono essere neutri, acidi o basici, contenere residui aromatici ed alifatici.
Alcuni sono detti Essenziali (n. 10) perché non sono sintetizzabili direttamente
dall’organismo umano e quindi devono essere introdotti tramite l’assunzione del cibo.
Il primo -amminoacido individuato (1806) è stato l’asparigina isolata dagli asparagi.
Oltre costituire i mattoni delle proteine gli -amminoacidi svolgono altri ruoli come
intermedi di biosintesi.
Oltre ai 20 α-amminoacidi (proteici), esistono in natura più di 700 amminoacidi non
proteici, che esplicano diverse funzioni negli organismi in cui vengono prodotti.
Alcuni esempi sono:
I
-
O
SH
HO
O
I
O
+
NH3
I
I
O
Omocisteina
O
È presente nel sangue per
l’instaurarsi di affezioni
cardiache
-
+
Tiroxina
NH3
Prodotta nella ghiandola tiroidea
agisce come ormone
H3C
O
+
N
H3C
CH3 O
-
Betaina (N,N,N-trimetilglicina)
È un agente metilante biologico
è presente in tutti i tessuti
La selenocisteina e la pirrololisina sono altri due esempi di amminoacidi trovati in
alcuni organismi:
CH3
O
H
HSe
O
+
-
H
H3N
H
O
N
+
N
H
O
H
+
O
H
H3N
Selenocisteina
Pirrolisina
Individuata nel 1986
Individuata nel 2004
L’acido -amminobutirrico (GABA) è un altro
esempio di amminoacido naturale non proteico,
esso è presente nel cervello ed agisce come
neurotrasmettitore di tipo inibitorio. (droga degli stupri)
-
-
O
+
O
NH3
Acido--amminobutirrico (GABA)
neurotrasmettitore
Il Carbonio α dell’ammino acido è un centro chirale (carbonio legato a 4 gruppi differenti)
(eccetto nella glicina H2NCH2CO2H)
• La Natura usa solitamente solo un enantiomero per costruire le proteine (L-ammino
acidi). In peptidi naturali non ribosomiali si osservano anche amminoacidi della serie D
O
O
H3C
-
O
H
+
H3N
+
H3N
-
H
H3C
L-Alanina
(S)-Alanina
O
O
D-Alanina
(R)-Alanina
-
O
O
O
-
HO
HS
H
H
+
H3N
L-Cisteina
(R)-Cisteina
+
H3N
L-Serina
(S)-Serina
Centro Stereogenico
Centro Stereogenico
Proiezione di Fischer della L-alanina = S-alanina
priorità
I 20 ammino acidi, in base alla natura dei sostituenti presenti sul gruppo R,
possono essere: acidi, basici e neutri:
•
2 Acidi: acido aspartico e glutammico, contengono un ulteriore gruppo carbossilico.
•
3 Basici: lisina, arginina e istidina hanno un ulteriore gruppo amminico basico.
•
15 Neutri, non hanno gruppi nettamente acidi o basici
– La Cisteina, avente un gruppo tiolico (-SH) e la tirosina avente un gruppo
fenolico (Ar-OH) possono essere deprotonate in soluzione fortemente alcalina,
formando un tiolato ed un fenato rispettivamente.
O
HS
O
O
OH-
-
S
+
NH3
O
-
NH2
O
O
-
O
OH-
O
+
HO
-
NH3
O
-
NH2
-
Gli ammino acidi sono sali interni (reazione acido base intramolecolare):
Alto momento di dipolo () due cariche nette separate;
Relativamente solubili in acqua (alcuni) ed insolubili in solventi organici;
Sostanze cristalline con un alto punto di fusione.
Gli -Ammino acidi esistono in soluzione acquosa principalmente in forma di ione
dipolare, o zwitterione, a seguito della neutralizzazione interna tra il gruppo acido e
quello basico.
Zwitterione
Dal tedesco zwitter, significa “ibrido”
Possono reagire come acidi
di Brønsted con una specie
basica.
Forma anionica
Possono reagire come basi
di Brønsted con una specie
acida.
Forma cationica
In soluzione acida, un ammino acido è protonato ed esiste principalmente come
catione (ione ammonio).
In soluzione basica, un ammino acido è deprotonato ed esiste principalmente come
anione (ione carbossilato).
Punto Isoelettrico, pI
– É il pH a cui il numero di cariche positive e il numero di cariche negative
presenti in soluzione sono uguali (massima quantità della forma zwitterionica).
– Il suo valore dipende dalla struttura dell’ammino acido (quindi da R)
Forma cationica
zwitterionica
O
H3C
O
OH
CH3
+
NH3
pH = 2,1
anionica
H3C
O
O
CH3
-
+
NH3
pH = 5,9
pH acido
H3C
O
CH3
NH2
pH = 9,7
pH basico
La solubilità e le proprietà (esempio nucleofilicità dell’azoto) sono fortemente
influenzate dal pH del mezzo
-
Il pI di ogni ammino acido è ottenuto come media di due valori di pKa dei gruppi.
Per gli ammino acidi con R acido, il pI è la media dei due valori di pKa
più bassi.
Per gli ammino acidi con R neutro, il pI è la media di pKa1 e pKa2
Per gli ammino acidi con R basico il pI è la media dei due valori di pKa
più alti.
Acido aspartico
Alanina
Lisina
L’elettroforesi è una potente tecnica per separare miscele di A.A., che sfrutta i
diversi valori dei punti isoelettrici degli amminoacidi (o delle proteine).
Quando è applicato un potenziale elettrico gli amminoacidi migrano in base alla loro
carica netta (determinata dal pH del tampone):
Ammino acidi aventi carica negativa migrano lentamente verso l’elettrodo
positivo.
Ammino acidi con carica positiva verso l’elettrodo negativo.
In condizioni fisiologiche (pH = 7.3):
I gruppi carbossilici in catena laterale degli amminoacidi acidi, Aspartico e Glutammico
sono in forma deprotonata sono quindi presenti come carbossilati (–COO-).
Gli azoti basici in catena laterale della Lisina ed Arginina sono in forma protonata come
gruppi ammonio (-NH3+).
L’anello imidazolinico dell’istidina in queste condizioni non è sufficientemente basico da
essere completamente protonato.
L’azoto piridinico è basico (ma non a sufficienza)
L’azoto pirrolico non è basico
Azoto non basico
di natura pirrolica
O
H
N
O
+
N
Azoto basico
di natura piridinica
NH3
L-Istidina
-
Questi sono alcuni esempi di reazioni che permettono di ottenere gli -amminoacidi
Reazione di SN2 di -Aloacidi con NH3
O
O
1. Br2, PBr3
OH
excess
OH
2. H2O
Reazione di Hell-Volhard-Zelinskii
Per ottenere gli -alogeno acidi
Br
O
OH
NH3
NH2
(R,S)-Leucine (45%)
Reazione di Amminazione riduttiva
Acido piruvico
(L,D)-Alanina
Intermedio Imminico
Reazione di Strecker
O
NH3
R
+
NH2
H
KCN
R
H
CN
Aldeide
-Ammino nitrile
H 3O
H 2O
NH3
+
R
H
COOH
(L,D)-Amminoacido
Reazione di Strecker
esempio:
Tutte le procedure di sintesi qui illustrate portano sempre a miscele racemiche.
Si ottengono i due enantiomeri L & D nella stessa quantità.
Dei 20 -Ammino acidi 10 vengono considerati non essenziali per l’uomo, e vengono sintetizzati
all’interno del nostro organismo gli altri 10 devono essere introdotti tramite il cibo.
Tuttavia la distinzione tra i due tipi non è ben definita. Per esempio la maggior parte dell’arginina
viene introdotta con il cibo ma una piccola parte è anche prodotta dall’organismo.
I 10 considerati essenziali sono:
CH3
O
H3C
H3C
OH
NH2
Isoleucina
S
H3C
OH
CH3
Metionina
+
NH3
+
-
HN
NH
-
N
CH3
O
-
-
O
+
+
NH3
Istidina
O
O
NH3
N
H
NH3
O
-
+
Arginina
H3C
Valina
O
O
+
NH3
CH3
Fenilalanina
O
+
Lisina
NH2
NH2
O
O
OH
OH
NH2
Leucina
H3N
O
O
O
NH
NH3
Triptofano
HO
O
+
NH3
Treonina
-
O
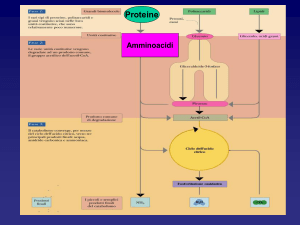
La biochimica degli -amminoacidi, se paragonata a quella dei trigliceridi e dei carboidrati è
più complessa, infatti, le vie sintetiche sono caratteristiche per ogni -amminoacido.
La loro degradazione (metabolismo) segue invece dei passaggi comuni.
La degradazione metabolica segue fondamentalmente tre stadi.
I. La deamminazione (trans-amminazione), rimozione del gruppo amminico in
II. La conversione dell’ammoniaca o dell’aspartato in urea
III. Trasformazione dello scheletro rimanente in un intermedio che entra poi nel
ciclo dell’acido citrico.
O
Ciclo acido citrico
R
CO2
+
H
NH3
R
CO2
-
-cheto acido
-
H
NH3
o
CO2
-
+
NH3
CO2
L-Aspartato
O
-
H2N
NH2
urea
Deamminazione: trasformazione del legame C-N in un carbonile C=O.
H
R
+
NH3
CO 2
O
-
+
CO2
-
O
PLP
CO2
R
- Amminotrasferasi
CO2
-
+
NH3
H
+
CO2
-
CO2
-chetoglutarrato
L-Glutammato
Ogni -ammino acido ha il suo enzima amminotrasferasi
Gruppo formilico
O
O
-
P
O
-
O
HO
H
OH
PLP = Piridossale fosfato agisce da coenzima
O
+
H
+
H
N
OH
CH3
PLP
N
OH
CH3
Piridossina
Vitamina B6
-
Deamminazione: 1 step.
O
O
O
-
P
O
-
-
O
O
H
H
N
+
H
NH2
N
O
Lisina
R
CO 2
-
P
O
H
O
H
-
+
H
H
N
N
Lisina
R
+
N
H
H
H CO 2
O
CH3
CH3
PLP legato all’enzima via
legame imminico tramite un
residuo di lisina della catena
peptidica.
Equilibrio acido-base
O
-
O
immine
-
P
O
+
H
O
O
+
-
P
O
O
-Lisina-NH2
H
-
+
R
N
+
H
O
CH3
N
Lisina
R
N
H
- H
O
CH3
H
N
N
CO 2
H
H
O
-
H
H
Immina del PLP del generico
-ammino acido
CO2
-
Deamminazione: 2 step.
O
O
-
O
P
O
-
O
O
R
CO 2
N
+
H
O
O
+
H
H
O
-
N
O
P
O
R
CO2
- chetoacido
+
H
N
O
-
CH3
Piridossamina fosfato
(PMP)
H2O
H2N-Lisina
R
H
H
N
H
+
H
-
H
+
-
O
O
-
CO 2
-
O
H
R
CH3
O
O
H
N
Idrogeno
acido
O
-
H
-
P
O
-
H
CH3
O
P
O
H
N
-
+
N
H
H
+
H
N
O
CH3
-
P
O
-
O
H
O
H
H
CO2
H
O
-
-
Equilibrio
acido-base
+
H
N
O
CH3
-
N
H
R
H
O
+
H
CO2
-
Deamminazione: 3 step, ripristino del PLP-enzima
O
O
-
P
O
O
-
H2N-Lisina-
O
H
H
P
O
-
O
H
H
+
N
O
-
O
-
N
H
H
CH3
N
+
+
O
H
CO2
-
CO2
Piridossamina fosfato
(PMP)
-
N
O
Lisina
+
H
O
H
-
CO2
Assalacetato
-
CO2
-
+
NH3
CO2
CH3
Immina PLP-enzima)
CO2
H
CO2
-
L-Glutammato
+
NH3
CO2
Aspartato
-
-
Deamminazione: 4 step, deamminazione ossidativa del glutammato
Cofattore ossidante
+
N
NAD+
Glutammato
deidrogenasi
NH2
H
O
H
His
CO2
H
H
CO2
-
H
N
+
N
H
CO2
NH
-
+
N
H
N
CO2
+
-
NH2
H
-imminioglutarato
H
NADH
-
H2O
O
CO2
-
CO2
-
-chetoglutarato
+
NH4+
O
L’ammoniaca (NH3) prodotta viene eliminata secondo tre meccanismi
che sono dipendenti dal tipo di organismo:
1. Pesci e animali acquatici la disperdono come tale nell’ambiente acquoso esterno
2. Organismi terrestri la smaltiscono sotto forma di urea
3. Gli uccelli la smaltiscono come acido urico
O
H2N
NH2
O
Urea
H
N
HN
O
O
N
H
N
H
Acido urico
NH3
Ammoniaca
Il primo passo è la trasformazione dell’ammoniaca in carbamoil fosfato, il quale viene poi convertito in
urea. La reazione inizia con l’attivazione del Bicarbonato da parte del Guanosintrifosfato (GTP), tutta la
sequenza è catalizzata dall’enzima fosfato sintetasi I.
HO
O
O
-
O
Legame anidride mista
NH
N
O
-
O
O
P
O
-
O
P
O
O
-
O
P
N
N
O
O
-
NH2
-GDP
O
-
O
P
O
Mg++
OH
O
O
-
O
OH
Carbossilfosfato
OH
:NH3
-Pi
Ciclo
dell’urea
O
H2N
O
O
O
-
P
O
+GTP
H2N
-
O
Carboamoilfosfato
-GDP
-
O
Carboammato
Esempio di Mappa Concettuale
Composti
zwitterionici anfoteri
sono
-Amminoacidi
Composti
otticamente attivi
solo
sono
Determinano la
sono
Sono costituiti da
Solidi con
alti p.f.
Presenza di
un pI
(L)-Amminoacidi
sono presenti nelle
proteine
Gruppo carbossile
(-COO-) in
Gruppo Ammino
(-NH3+) in
Gruppo R in
sono
20 tipi di R
con
R non polare
Alanina
Glicina
Isoleucina
Metionina
Fenilalanina
Prolina
Triptofano
Valina
con
R polare non
carico
Asparigina
Cisteina
Glutammina
Serina
Treonina
Tirosina
con
R acido
Acido aspartico
Acido glutammico
per cui
Gruppo R carico (-)
a pH fisiologico
con
R basico
Arginina
(Istidina)
Lisina
per cui
Gruppo R carico (+)
a pH fisiologico
Dalla unione di più -amminoacidi tramite legame ammidico (peptidico)
si possono formare copolimeri come:
– Peptidi contenenti 40-50 unità amminoacidiche.
– Proteine polimeri con un più elevato numero di monomeri
amminoacidi.
Legame ammidico
O
n
R
R
O
+
NH3
O
-
NH
HN
O
R
O
NH
NH
R
O
R
NH
R
O