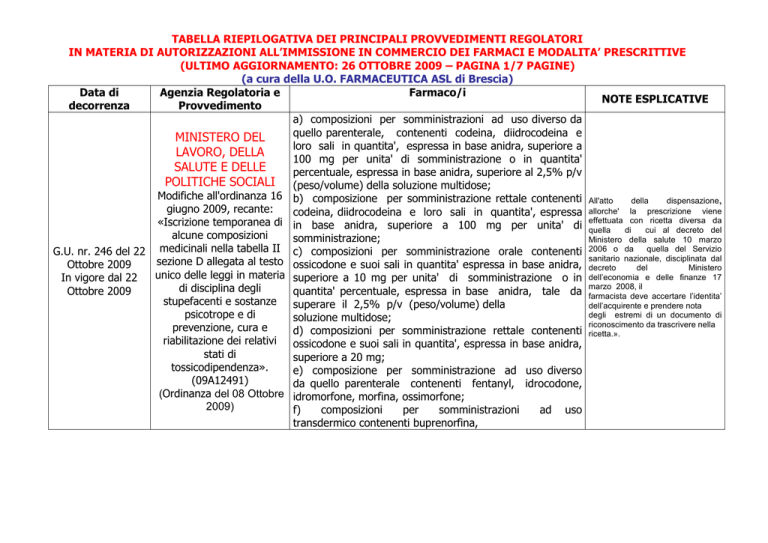
TABELLA RIEPILOGATIVA DEI PRINCIPALI PROVVEDIMENTI REGOLATORI
IN MATERIA DI AUTORIZZAZIONI ALL’IMMISSIONE IN COMMERCIO DEI FARMACI E MODALITA’ PRESCRITTIVE
(ULTIMO AGGIORNAMENTO: 26 OTTOBRE 2009 – PAGINA 1/7 PAGINE)
(a cura della U.O. FARMACEUTICA ASL di Brescia)
Data di
Agenzia Regolatoria e
Farmaco/i
NOTE ESPLICATIVE
decorrenza
Provvedimento
a) composizioni per somministrazioni ad uso diverso da
quello parenterale, contenenti codeina, diidrocodeina e
MINISTERO DEL
loro sali in quantita', espressa in base anidra, superiore a
LAVORO, DELLA
100 mg per unita' di somministrazione o in quantita'
SALUTE E DELLE
percentuale, espressa in base anidra, superiore al 2,5% p/v
POLITICHE SOCIALI (peso/volume) della soluzione multidose;
Modifiche all'ordinanza 16 b) composizione per somministrazione rettale contenenti All'atto
della
dispensazione,
giugno 2009, recante:
allorche'
la
prescrizione
viene
codeina, diidrocodeina e loro sali in quantita', espressa
«Iscrizione temporanea di in base anidra, superiore a 100 mg per unita' di effettuata con ricetta diversa da
quella
di
cui al decreto del
alcune composizioni
somministrazione;
Ministero della salute 10 marzo
G.U. nr. 246 del 22 medicinali nella tabella II c) composizioni per somministrazione orale contenenti 2006 o da quella del Servizio
nazionale, disciplinata dal
sezione D allegata al testo ossicodone e suoi sali in quantita' espressa in base anidra, sanitario
Ottobre 2009
decreto
del
Ministero
unico delle leggi in materia superiore a 10 mg per unita' di somministrazione o in dell’economia e delle finanze 17
In vigore dal 22
2008, il
di disciplina degli
Ottobre 2009
quantita' percentuale, espressa in base anidra, tale da marzo
farmacista deve accertare l’identita’
stupefacenti e sostanze
superare il 2,5% p/v (peso/volume) della
dell’acquirente e prendere nota
degli estremi di un documento di
psicotrope e di
soluzione multidose;
riconoscimento da trascrivere nella
prevenzione, cura e
d) composizioni per somministrazione rettale contenenti ricetta.».
riabilitazione dei relativi ossicodone e suoi sali in quantita', espressa in base anidra,
stati di
superiore a 20 mg;
tossicodipendenza».
e) composizione per somministrazione ad uso diverso
(09A12491)
da quello parenterale contenenti fentanyl, idrocodone,
(Ordinanza del 08 Ottobre idromorfone, morfina, ossimorfone;
2009)
f)
composizioni
per
somministrazioni
ad uso
transdermico contenenti buprenorfina,
TABELLA RIEPILOGATIVA DEI PRINCIPALI PROVVEDIMENTI REGOLATORI
IN MATERIA DI AUTORIZZAZIONI ALL’IMMISSIONE IN COMMERCIO DEI FARMACI E MODALITA’ PRESCRITTIVE
(ULTIMO AGGIORNAMENTO: 26 OTTOBRE 2009 – PAGINA 2/7 PAGINE)
(a cura della U.O. FARMACEUTICA ASL di Brescia)
1. composizioni, per somministrazioni ad uso diverso da
quello
parenterale,
contenenti
codeina
e
diidrocodeina in quantità superiore (espressa in base
anidra) a 10 mg/unità posologica per le forme Le categorie di farmaci indicate,
MINISTERO DEL
oggetto del Provvedimento, a
farmaceutiche monodose;
LAVORO, DELLA
decorrere dal 20 giugno c.a. sono
2. composizioni, per somministrazioni ad uso diverso da collocate nella tabella
IID e
SALUTE E DELLE
quello parenterale, contenenti codeina e diidrocodeina pertanto:
POLITICHE SOCIALI
in quantità superiore (espressa in base anidra) all'1% -non richiedono il buono acquisto;
Iscrizione temporanea di
p/v per le forme farmaceutiche multidose;
alcune composizioni
3. composizioni, per somministrazione rettale, contenenti -la dispensazione avviene con
non ripetibile; per la
medicinali
nella
tabella
II,
G.U. nr. 141 del 20
codeina, diidrocodeina e loro sali in quantità superiore ricetta
prescrizione in regime SSR si
sezione D, allegata al testo
(espressa in base anidra) a 20 mg/unità posologica ;
giugno 2009
utilizza il ricettario regionale. In
unico delle leggi in materia 4. composizioni, per somministrazioni ad uso diverso da assenza di esenzioni specifiche va
In vigore dal 20
indicato il codice TDL per la
di disciplina degli
quello parenterale, contenenti fentanyl, idrocodone, prescrizione SSR della terapia del
giugno 2009
stupefacenti e sostanze
idromorfone, morfina, ossicodone e ossimorfone;
dolore (non superiore a 30 giorni).
psicotrope e di
5. composizioni,
per
somministrazioni
ad
uso
-non richiedono la trascrizione su
transdermico, contenenti buprenorfina.
prevenzione, cura e
registro stupefacenti (per lo scarico
dal Registro utilizzare la causale
riabilitazione dei relativi
ministeriale
16
stati di tossicodipendenza Sono escluse tutte le forme farmaceutiche per “Ordinanza
giugno 2009”).
(Ordinanza del 16 giugno somministrazione parenterale, nonchè le composizioni
a
base
di
metadone
e
buprenorfina
per
2009)
somministrazione orale.
ALLEGATO: ELENCO MEDICINALI
G.U. nr. 43 del 21
febbraio 2009
In vigore dal 23
marzo 2009
AIFA
Modifica delle Modalita' di
Prescrizione
(Determinazione 12
febbraio 2009)
Medicinali
ad Uso Sistemico
Contenenti
Isotretinoina
La determina AIFA 12.02.2009 (in
G.U. n. 43 del 21.02.2009) ha
nuovamente
modificato
la
classificazione del regime di fornitura
dei medicinali contenenti isotretinoina
ad uso sistemico, stabilendo che gli
stessi siano soggetti a prescrizione
medica da rinnovare volta per volta.
Alla prescrizione deve essere allegato
il modulo AIFA per la prescrizione di
isotretinoina ad uso sistemico di cui
all'allegato 1alla Determinazione AIFA.
TABELLA RIEPILOGATIVA DEI PRINCIPALI PROVVEDIMENTI REGOLATORI
IN MATERIA DI AUTORIZZAZIONI ALL’IMMISSIONE IN COMMERCIO DEI FARMACI E MODALITA’ PRESCRITTIVE
(ULTIMO AGGIORNAMENTO: 26 OTTOBRE 2009 – PAGINA 3/7 PAGINE)
(a cura della U.O. FARMACEUTICA ASL di Brescia)
La prima prescrizione deve essere
effettuata da parte dello specialista
dermatologo, quelle successive anche
da parte del medico di medicina
generale.
Le confezioni non ancora aggiornate
con la dicitura «Da vendersi dietro
presentazione
di
ricetta
medica
utilizzabile una sola volta» possono
essere dispensate fino ad esaurimento
delle scorte. Con nota 9725 del
16/03/2009 la Regione Lombardia
evidenzia
che
il
modulo
AIFA
compilato debba essere conservato
dal medico di medicina generale
allegato alla scheda sanitaria del
paziente
e
debba
rimanere
a
disposizione per eventuali controlli.
Con nota 11010 del 25/03/2009 la
Regione Lombardia precisa che, se lo
specialista dermatologo appartiene a
Strutture private accreditate col SSR,
la ricetta sul modulo del SSR (ricetta
rossa), in entrambi i casi, potrà
essere redatta dal medico di medicina
generale,
purchè
in
presenza
dell'apposito modulo AIFA compilato
dallo
specialista
dermatologo.Il
modulo AIFA dovrà venire conservato
dal medico di medicina generale,
allegato alla cartella sanitaria del
paziente e reso disponibile per
eventuali verifiche da parte dell'ASL".
TABELLA RIEPILOGATIVA DEI PRINCIPALI PROVVEDIMENTI REGOLATORI
IN MATERIA DI AUTORIZZAZIONI ALL’IMMISSIONE IN COMMERCIO DEI FARMACI E MODALITA’ PRESCRITTIVE
(ULTIMO AGGIORNAMENTO: 26 OTTOBRE 2009 – PAGINA 4/7 PAGINE)
(a cura della U.O. FARMACEUTICA ASL di Brescia)
Data di
Agenzia Regolatoria e
Farmaco/i
NOTE ESPLICATIVE
decorrenza
Provvedimento
AIFA
Agenzia Italiana del
Farmaco
Determinazione AIFA 4
marzo 2009
Gazzetta Ufficiale
Modifica della
n.62 Del 16 Marzo
Determinazione AIFA 23
2009 in vigore dal
maggio 2007, relativa
17 marzo 2009
all’inserimento del
medicinale “Bevacizumab
(Avastin)” nell’elenco dei
medicinali erogabili a totale
carico del Servizio Sanitario
Nazionale
AIFA
Agenzia Italiana del
Farmaco
Gazzetta Ufficiale
n.54 Del 06 Marzo Provvedimenti di Revoca su
Rinuncia di Autorizzazioni
2009
all'Immissione in
Commercio di Specialita'
Medicinali per Uso Umano
BEVACIZUMAB (AVASTIN)
GEREF, SERMORELINA ,026976011, 50 mcg/ml uso iniettabile;
ENULID, MOEXIPRIL, 033908017, 14 cpr film-rivestite 7,5, mg;
ZENODIAN, SUCRALFATO:
032884013, 40 CPR MASTICABILI 1 gr.;
032884025, bustine 1 gr.;
032884037, bustine 2 gr.;
IMPROMEN DECANOAS, BROMPERIDOLO DECANOATO:
029272010 3 fiale 68.35 mg./ml.
029272022 1 fiala 205,05 mg/3 ml.
029272034 2 fiale 205,05 mg./3 ml.
AIFA ha disposto che, in base alla
norma, il farmaco non possa più
essere inserito nella lista L.648/96,
relativamente ad
indicazioni
terapeutiche per le quali esistono
farmaci approvati.
Pertanto l’AIFA ha disposto che , a
decorrere dal 17 marzo 2009, il
medicinale
Bevacizumab
(AVASTIN)
rimanga
inserito
nell’elenco dei medicinali erogabili a
totale carico del Servizio Sanitario
nazionale ai sensi della L.648/96,
esclusivamente per le seguenti
indicazioni terapeutiche:
Trattamento delle maculopatie
essudative
non
correlate
all’età;
Trattamento delle maculopatie
essudative correlate all’età, già
in
trattamento
con
Bevacizumab;
Trattamento
del
glaucoma
neovascolare.
TABELLA RIEPILOGATIVA DEI PRINCIPALI PROVVEDIMENTI REGOLATORI
IN MATERIA DI AUTORIZZAZIONI ALL’IMMISSIONE IN COMMERCIO DEI FARMACI E MODALITA’ PRESCRITTIVE
(ULTIMO AGGIORNAMENTO: 26 OTTOBRE 2009 – PAGINA 5/7 PAGINE)
(a cura della U.O. FARMACEUTICA ASL di Brescia)
Data di
Agenzia Regolatoria e
Farmaco/i
NOTE ESPLICATIVE
decorrenza
Provvedimento
AIFA
G.U. nr. 43 del 21
febbraio 2009
In vigore dal 08
marzo 2009
Modifica stampati
(Determinazione 12
febbraio 2009)
G.U. nr. 43 del 21
febbraio 2009
In vigore dal 08
marzo 2009
Modifica stampati
(Determinazione 12
febbraio 2009)
AIFA
Medicinali
Contenenti
il
Principio
Attivo
Acido
Acetilsalicilico, come Monocomponente, a Basso Dosaggio
(Inferiore o Uguale a 300 mg) e di Medicinali
Contenenti Acido Acetilsalicilico in Associazione con
Dipiridamolo
Medicinali Contenenti i Principi Attivi Ibuprofene
e Dexibuprofene e Loro Salificazioni, in Formulazioni ad
Uso Sistemico
Aggiornamento
RCP
e
foglio
illustrativo.
Le confezioni in commercio potranno
andare ad esaurimento scorte.
Le confezioni di medicinali non
soggetti
a
prescrizione
medica,
prodotte prima dell’entrata in vigore
della Determinazione AIFA, dovranno
riportare
in
modo
evidente
e
indelebile, con etichetta adesiva sul
confezionamento esterno, la seguente
frase:
“Avvertenza:
se
si
usa
ibuprofene
consultare
il
medico/farmacista”.
Gli stampati dei medicinali autorizzati
con
procedura
nazionale
successivamente all’entrata in vigore
della Determinazione AIFA, dovranno
riportare quanto indicato nell’Allegato
1 alla Determinazione stessa.
Aggiornamento
RCP
e
foglio
illustrativo.
Le confezioni in commercio potranno
andare ad esaurimento scorte.
Le confezioni di medicinali non
soggetti
a
prescrizione
medica,
prodotte prima dell’entrata in vigore
della Determinazione AIFA, dovranno
riportare
in
modo
evidente
e
indelebile, con etichetta adesiva sul
confezionamento esterno, la seguente
frase: “Avvertenza: se si usa acido
acetilsalicilico
consultare
il
medico/farmacista”.
Gli stampati dei medicinali autorizzati
con
procedura
nazionale
successivamente all’entrata in vigore
della Determinazione AIFA, dovranno
riportare quanto indicato nell’Allegato
1 alla Determinazione stessa.
TABELLA RIEPILOGATIVA DEI PRINCIPALI PROVVEDIMENTI REGOLATORI
IN MATERIA DI AUTORIZZAZIONI ALL’IMMISSIONE IN COMMERCIO DEI FARMACI E MODALITA’ PRESCRITTIVE
(ULTIMO AGGIORNAMENTO: 26 OTTOBRE 2009 – PAGINA 6/7 PAGINE)
(a cura della U.O. FARMACEUTICA ASL di Brescia)
Data di
Agenzia Regolatoria e
Farmaco/i
NOTE ESPLICATIVE
decorrenza
Provvedimento
- Farmaci : Efficib - Janumet - Velmetia (Compresse
Rivestite con Film)
- Principio Attivo : Sitagliptin - Metformina
- ATC : A10BD07
- Categoria Farmacoterapeutica : Associazione di Farmaci
AIFA
Ipoglicemizzanti Orali
Autorizzazione
- Indicazione Terapeutica : In aggiunta alla dieta e all'esercizio
G.U. nr. 35 del 12
all'Immissione in
fisico per migliorare il controllo glicemico in pazienti che non
febbraio 2009
Commercio di nuovi
hanno
un
adeguato
controllo
della
s.o. nr. 23
farmaci
glicemia con il loro dosaggio massimo tollerato di metformina da
(Deliberazioni AIFA del 27 sola o in quei pazienti gia' in trattamento con l'associazione
di
sitagliptin
e
metformina
e 19 gennaio 2009)
e' anche indicato in associazione con una sulfonilurea (es.
triplice terapia di associazione) in aggiunta alla dieta e
all'esercizio fisico in pazienti che non hanno un adeguato
controllo della glicemia con il loro dosaggio massimo
tollerato di metformina ed una sulfonilurea
AIFA
G.U. nr. 35 del 12
febbraio 2009
s.o. nr. 23
Autorizzazione
all'Immissione in
Commercio di nuovi
farmaci
(Deliberazioni AIFA del 27
e 19 gennaio 2009)
-
Farmaco : Volibris (Compresse Rivestite con Film)
Principio Attivo : Ambrisentan
ATC : C03KX02
Categoria Farmacoterapeutica : Altri Antipertensivi
Indicazione Terapeutica : Trattamento dei pazienti con
ipertensione polmonare arteriosa (PAH) classificata in base alla
classificazione funzionale dell' oms in classe II e III, per
migliorare la capacita' di esercizio. la sua efficacia e' stata
dimostrata nei pazienti con PAH idiopatica (IPAH) e nella
IPAH associata a malattia del tessuto connettivo
TABELLA RIEPILOGATIVA DEI PRINCIPALI PROVVEDIMENTI REGOLATORI
IN MATERIA DI AUTORIZZAZIONI ALL’IMMISSIONE IN COMMERCIO DEI FARMACI E MODALITA’ PRESCRITTIVE
(ULTIMO AGGIORNAMENTO: 26 OTTOBRE 2009 – PAGINA 7/7 PAGINE)
(a cura della U.O. FARMACEUTICA ASL di Brescia)
Data di
Agenzia Regolatoria e
Farmaco/i
NOTE ESPLICATIVE
decorrenza
Provvedimento
AIFA
G.U. nr. 35 del 12
febbraio 2009
s.o. nr. 23
Autorizzazione
all'Immissione in
Commercio di nuovi
farmaci
(Deliberazioni AIFA del 27
e 19 gennaio 2009)
- Farmaco : Cyanokit (Polvere per Soluzione per Infusione)
- Principio Attivo : Idrossicobalamina
Autorizzazione
- ATC : V03AB33
all'Immissione in
- Categoria Farmacoterapeutica : Antidoto
Commercio di nuovi
- Indicazione Terapeutica : Trattamento dell'avvelenamento
farmaci
da cianuro accertato o
presunto. deve
essere
(Deliberazioni AIFA del 27
somministrato insieme ad appropriate misure
di
e 19 gennaio 2009)
decontaminazione e di supporto
AIFA
G.U. nr. 35 del 12
febbraio 2009
s.o. nr. 23
- Farmaco : Rasilez (Compresse Rivestite con Film)
- Principio Attivo : Aliskiren
- ATC : C09XA02
- Categoria Farmacoterapeutica : Inibitore della Renina
- Indicazione Terapeutica : Trattamento dell'Ipertensione
Essenziale












