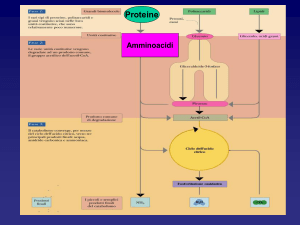
Il metabolismo degli amminoacidi
La degradazione delle proteine dell’organismo
Concetti chiave
• Le proteine extracellulari e intracellulari possono essere digerite dalle proteasi
lisosomiali.
• Le altre proteine che devono essere degradate sono prima coniugate alla
proteina ubiquitina.
• Il proteasoma, un complesso proteico a forma di barile, srotola la struttura delle
proteine ubiquitinate con un processo ATP-dipendente e le degrada
proteoliticamente.
Struttura dell’ubiquitina
Ubiquitina
umana
PDBid 1UBO
Emivita di alcuni enzimi
Le reazioni di ubiquitinazione
Alcuni amminoacidi devono essere assunti con
la dieta
La digestione delle proteine della dieta
La deaminazione degli amminoacidi
Concetti chiave
• La transaminazione interconverte tra loro un amminoacido e un a-cheto acido.
• La deaminazione ossidativa del glutammato rilascia ammoniaca da eliminare.
Il catabolismo degli amminoacidi
Transaminazione
Transaminazione
Piridossal-5’-fosfato
Piridossal-5’-fosfato
Piridossal-5’-fosfato
Piridossal-5’-fosfato
Piridossal-5’-fosfato
Deaminazione ossidativa del glutammato
La deaminazione degli amminoacidi
Punto di verifica
• Descrivete il modo in cui l’a-chetoglutarato e l’ossalacetato partecipano al
catabolismo degli amminoacidi.
• Qual è il ruolo del PLP nella transaminazione?
• Riassumete le reazioni che rilasciano un gruppo amminico di un amminoacido
sotto forma di ammoniaca.
Il ciclo dell’urea
Concetti chiave
• Cinque reazioni incorporano l’ammoniaca e un gruppo amminico nell’urea.
• La velocità del ciclo dell’urea cambia in funzione della velocità di degradazione
degli amminoacidi.
L’ammoniaca e i prodotti di scarto
meno tossici
Reazione complessiva del ciclo dell’urea
Il ciclo dell’urea
Il ciclo dell’urea
Il ciclo dell’urea
Il meccanismo di reazione della CPS I
Il meccanismo di reazione della CPS I
Il meccanismo di reazione della CPS I
Il meccanismo di reazione della CPS I
Il ciclo dell’urea
Punto di verifica
• Riassumete le tappe del ciclo dell’urea. In che modo i gruppi amminici degli
amminoacidi entrano nel ciclo?
• Quali sono i vantaggi dell’incanalamento?
• In che modo la velocità di deaminazione degli amminoacidi è correlata alla
velocità del ciclo dell’urea?
La degradazione degli amminoacidi
Concetti chiave
• L’alanina, la cisteina, la glicina, la serina e la treonina sono degradate a piruvato.
• L’asparagina e l’aspartato sono degradati a ossalacetato.
• L’a-chetoglutarato è prodotto dalla degradazione dell’arginina, del glutammato,
della glutammina, dell’istidina e della prolina.
• L’isoleucina, la metionina, la treonina e la valina sono convertite in succinil-CoA.
• La degradazione della leucina e della lisina forma acetil-CoA e acetoacetato.
• Il triptofano viene degradato ad acetoacetato.
• La fenilalanina e la tirosina formano fumarato e acetoacetato.
I 7 prodotti comuni di degradazione
degli amminoacidi
La degradazione degli amminoacidi
Punto di verifica
• Descrivete i due destini generali degli scheletri carboniosi degli amminoacidi.
• Elencate i sette metaboliti che rappresentano i prodotti terminali del
catabolismo degli amminoacidi. Quali di questi sono gluconeogenici? Quali invece
sono chetogenici?
Integrazione del metabolismo:
ruolo della biosegnalazione
Gli ormoni
Concetti chiave
• Gli ormoni endocrini regolano molti processi fisiologici.
• Gli ormoni pancreatici insulina e glucagone controllano il metabolismo
energetico.
• Le catecolamine prodotte dalla midollare del surrene si legano ai recettori a- e
b-adrenergici presenti sulle cellule bersaglio.
• Gli ormoni steroidei regolano il metabolismo delle fonti energetiche, il
bilanciamento idrosalino nonché la differenziazione e la funzione sessuale.
Caratteristiche generale della biosegnalazione
Tipologie di recettori
La segnalazione endocrina
Le ghiandole principali
del sistema endocrino
Ormoni circolanti e a effetto locale (o messaggeri locali)
La midollare del surrene sintetizza due
catecolammine attive come ormoni
L’insulina è un ormone di natura proteica
I recettori e la cascata di segnalazione
Il recettore dell'insulina è un recettore ad
attività tirosin-chinasica
Il recettore dell’adrenalina (come pure quello del glucagone) è un recettore
accoppiato a proteine G (GPCR)
Esempio di integrazione/interazione recettoriale
Gli ormoni tiroidei
Gli ormoni delle ghiandole surrenali
Gli ormoni prodotti dalle ovaie e dai testicoli
Gli ormoni
Punto di verifica
• Spiegate perché solamente alcune cellule rispondono agli
ormoni, anche se tutte le cellule del corpo sono esposte a essi.
• Elencate alcuni ormoni prodotti dal pancreas, dalla midollare del
surrene e dalla corticale del surrene. Quali tipi di molecole sono
questi ormoni?
• Riassumete gli effetti biologici dell'insulina, del glucagone,
dell'adrenalina, degli androgeni e degli estrogeni
Le proteine G eterotrimeriche
Punto di verifica
• Riassumete le tappe della trasduzione del segnale da un GPCR
alla fosforilazione di proteine bersaglio da parte della PKA.
• Spiegate perché un GPCR può essere considerato essere una
proteina allosterica.
• Descrivete in che modo le proteine G vengono attivate e
inattivate.
• Qual è la funzione di un secondo messaggero quale il cAMP?
• Come è regolata l’attività della PKA?
• In che modo l’attività della PKA influenza la cellula?
• Perché il sistema di segnalazione dell'adenilato ciclasi
comprende le fosfodiesterasi?
• Quali altri fattori limitano o terminano la segnalazione attraverso
i GPCR?
Ruolo metabolico dei principali organi
CICLO DI CORI
Biochimica del sangue
Effetti della glicemia
La glicemia influenza le cellule alfa e beta del pancreas esocrino che
sintetizzano e rilasciano, rispettivamente, glucagone e insulina
Meccanismi molecolare e cellulare
responsabili della risposta all’iperglicemia
delle cellule beta
Biochimica postprandiale
Biochimica del digiuno
Adattamenti metabolici al digiuno: il ruolo del fegato
Biochimica dello stress