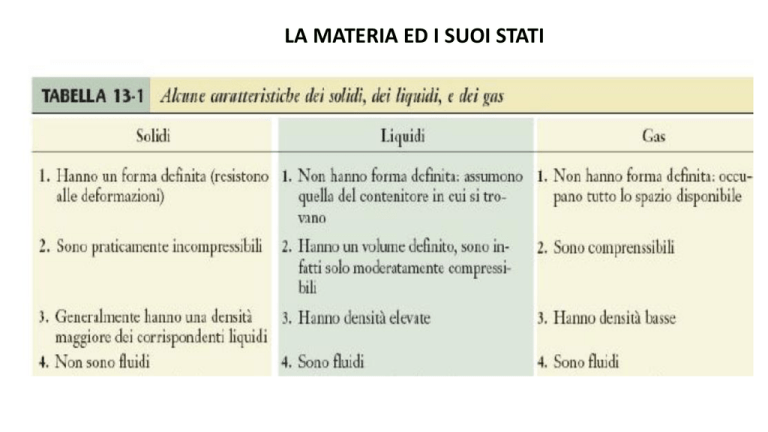
LA MATERIA ED I SUOI STATI
GAS
COMPOSIZIONE DELL’ ARIA
1. I gas ideali e la teoria cineticomolecolare
Nel modello del gas ideale le particelle
1. l’energia cinetica media delle particelle è proporzionale alla
temperatura assoluta;
2. non si attraggono reciprocamente;
3. sono puntiformi e il loro volume è trascurabile;
4. si muovono a grande velocità in tutte le direzioni con un
movimento disordinato.
I gas non hanno forma propria, ma occupano quella del recipiente che li contiene: le
particelle, quando sono lontane le une dalle altre, non risentono delle forze attrattive.
In generale, la pressione p è data dal rapporto tra la forza F, che agisce perpendicolarmente
a una superficie, e l’area s della superficie stessa.
L'unità di misura della pressione nel Sistema Internazionale è il pascal (Pa), pari a un
newton (N) per metro quadrato (m2).
1 Pa = 1N / m2
1 atm = 760 mm Hg = 760 Torr = 101325 Pascal (Pa)
1 bar = 105 Pascal = 0,987 atm
La legge di Boyle
Sperimentalmente,
Boyle
ha
dimostrato che, a temperatura
costante, la pressione di una
data
quantità
di
gas
è
inversamente proporzionale al
suo volume.
p V = k
con T costante.
Questa è la legge di Boyle.
Legge di CHARLES
–273,15 °C è lo zero
assoluto (0 K), ovvero
la temperatura alla
quale il volume dei
gas si annulla.
Charles dimostrò sperimentalmente che, a pressione costante, il volume di una data
quantità di gas è direttamente proporzionale alla sua temperatura assoluta.
V/T = k con T temperatura assoluta e p costante
Questa è la legge di Charles.
Conversione Celsius/ Kelvin
Tk = TC + 273,15
Conversione Celsius Fahrenheit
TF = 32 + 1,8 TC
Legge di Gay Lussac
Sperimentalmente Gay-Lussac ha dimostrato che, a volume costante, la pressione di una data
quantità di gas è direttamente proporzionale alla sua temperatura assoluta.
p/T = k
con V costante.
principio di Avogadro.
Volumi uguali di gas diversi, alla stessa pressione e temperatura, contengono
lo stesso numero di molecole.
Il principio di Avogadro può essere formulato matematicamente.
A pressione e temperatura costanti, il volume di un gas è direttamente proporzionale al
suo numero di molecole.
•A STP (0 °C e 1 atm) il volume molare dei gas è 22,4
L, ovvero una mole di qualsiasi gas occupa 22,4 L di
volume.
Dalla combinazione delle 3 leggi si ottiene la legge generale dei gas
(p V)/ T = k
•Equazione di stato dei gas ideali
pV=n R T
•
•p = pressione (in atm)
•V = volume (in L)
•n = numero di moli
•T = temperatura assoluta (in K)
•R = costante universale dei gas
= 0,082 (in L atm mol-1 K-1)
Costante di Boltzmann
MISCELE di GAS
•La pressione parziale è la pressione esercitata da ciascun gas costituente una
miscela, in assenza degli altri.
•Questa legge è definita legge delle pressioni parziali di Dalton.
•Data una miscela di gas in un recipiente, le particelle di ciascun gas urtano
le pareti e producono una pressione identica a quella che generano quando
si trovano da sole nel medesimo recipiente.
GAS REALI
repulsione
attrazione
IL COVOLUME
CORREZIONE del termine P
ESERCIZIO
Una bombola della capacità di 20.0 L contiene 102.3 moli di CO2 . La pressione
segnata dal manometro della bombola è di 78.1 atm a 25.0 °C. Paragonare la
pressione osservata con quella calcolata assumendo che il gas abbia
comportamento ideale e con quella calcolata applicando l’equazione di van
der Waals sapendo che a = 3.59 e b = 0.0430
Dall’equazione di stato dei gas ideali : p = nRT/V = 102.3 x 0.08206 x 298 K/ 20.0= 125.1 atm
Dall’equazione di van der Waals : P = nRT/ (V-nb) – (n2a/V2) =
= 102.3 x 0.08206 x 298/ 20.0 – ( 102.3 x 0.0430) – ( 102.3)2 x 3.59/ (20.0)2 = 66.5 atm
Confrontando:
Posservata = 78.1 atm
Pideale = 125.1 atm
Preale = 66.5 atm
Si può concludere che tramite l’equazione di van der Waals si ottiene una pressione del gas
reale molto più vicina al valore osservato rispetto a quella che si può calcolare tramite
l’equazione dei gas reali.
ESERCIZIO
Una bombola della capacità di 50.0 L collaudata per sostenere la pressione
massima di 200 atm contiene 250 moli di idrogeno. Calcolare, applicando
l’equazione di van der Waals e quella dei gas perfetti la temperatura massima cui
può essere sottoposta la bombola senza pericolo di esplosione sapendo che a =
0.244 e b = 0.0266
Risolvendo l’equazione di van der Waals rispetto a T si ha: T = (P + n2a/V2) (V-nb) / nR da cui, sostituendo i
valori noti si ha:
T = (200 + 2502 x 0.244/ 50.02)( 50.0 – 250 x 0.0266) / 250 . 0.08206= 435.8 K
Applicando, invece, l’equazione di stato dei gas ideali si ha: T = PV/nR = 200 x 50.0/ 250 x 0.08206 = 487.2 K
DIAGRAMMI DI STATO
DIAGRAMMI DI STATO
Il diagramma di stato (o delle fasi ) di una specie chimica permette:
di conoscere, in funzione della temperatura e della pressione, i
campi di esistenza di ciascun stato di aggregazione della specie
chimica considerata.
di definire le condizioni necessarie alla coesistenza in equilibrio di
più stati di aggregazione di detta specie
Fase F = porzione uniforme di materia, non solo per composizione
chimica ma anche nello stato fisico.
Componenti C = numero di specie chimiche presenti diminuito
del numero di eventuali relazioni indipendenti tra di esse
Nel caso, ad esempio di due specie chimiche A e B che reagiscano
a dare un composto AB, si è in presenza di tre specie chimiche, ma,
esistendo una relazione di equilibrio relativo alla reazione A + B =
AB, i componenti indipendenti sono solo due
Varianza V = o gradi di libertà del sistema, è il numero di variabili
(temperatura, pressione e composizione) le cui variazioni possono
aver luogo indipendentemente senza che cambi il numero delle fasi
in equilibrio.
Si deve notare che se i valori delle variabili indipendenti variano in
un intervallo troppo grande si ha ugualmente cambiamento del
numero delle fasi presenti.
REGOLA DELLE FASI
In base a considerazioni termodinamiche Gibbs è arrivato ad una
semplice formulazione che lega il numero delle fasi e dei componenti
al numero dei gradi di libertà del sistema:
V+F =C+2
Tale relazione è detta “regola delle fasi di Gibbs”
Nel caso di sistemi condensati, cioè allo stato solido, poiché le
proprietà termodinamiche sono poco influenzate dalla pressione si
ipotizza di considerare gli equilibri alla pressione costante di una
atmosfera. Questo riduce il numero delle variabili indipendenti e la
regola delle fasi diventa:
V+F =C+1
Diagrammi a un componente
In Fig. è riportato il diagramma delle
fasi per la CO2.
S
L
V
I campi S, L e V rappresentano le
condizioni di esistenza del solo
solido, liquido e vapore con varianza
(V+F = C+2) uguale a 2
Le linee AO, CO e BO rappresentano
rispettivamente le condizioni per
l’equilibrio tra le fasi solido-vapore,
solido-liquido e liquido-vapore, e su
di esse la varianza è 1
Nel punto O , definito punto triplo,
coesistono le tre fasi e la varianza
risulta 0 .
Diagramma di stato per l’acqua
Da notare che per l’acqua,
come poche altre sostanze, la
linea di equilibrio tra liquido e
solido è inclinata verso sinistra:
ciò significa che un aumento di
pressione favorisce la fusione.