LE SOLUZIONI
Una soluzione è un sistema (o miscela) omogenea costituito da due o più componenti.
Un sistema è omogeneo quando presenta in ogni suo punto le stesse proprietà e i componenti non sono
più distinguibili. Il componente più abbondante è chiamato solvente, quello (o quelli) meno abbondanti si
chiama soluto.
I solventi possono essere polari (es. acqua) o apolari (es. benzene C6H6 ). Anche i soluti possono essere
di vari tipi: ionici (es. NH3) o molecolari (es. glucosio, saccarosio, etanolo, I2, Br2, O2).
La formazione di una soluzione comporta la solubilizzazione o dissoluzione di un soluto in un solvente e
di conseguenza il sistema diventa più disordinato. La solubilizzazione di un solvente in un soluto
comporta l’aumento dell’entropia, cioè del grado di disordine del sistema. La solubilizzazione di un
solvente in un soluto è descritto dal motto latino “ similia similibus solvuntur” (il simile scioglie il
simile).
In base a tale detto risulta che i soluti ionici sono solubili in solventi polari, con la formazione di legami
dipolo-dipolo; i soluti covalenti polari sono solubili in solventi polari e formano legami dipolo-dipolo o
legami idrogeno; i soluti covalenti apolari sono solubili in solventi apolari e formano forze di London.
La solubilità è la quantità massima di soluto che si può sciogliere con una data quantità di solvente.
Questa grandezza dipende dalla temperatura e possiamo quindi definire una soluzione insatura se
contiene una quantità di soluto inferiore al valore di solubilità, satura se contiene invece una quantità di
soluto uguale al valore di solubilità.
TIPI DI SOLUZIONE
Le soluzioni si distinguono in:
GASSOSE → gas in un gas;
SOLIDE → solido in un solido (leghe);
LIQUIDE → gas in un liquido, liquido in un liquido, solido in un liquido.
SOLUZIONI GASSOSE
Consideriamo un sistema costituito da molecole di azoto (N2) all’interno del quale introduciamo molecole
di ossigeno (O2). Le molecole di ossigeno diffonderanno in tutto il sistema mescolandosi con quelle di N2
costituendo un sistema omogeneo. La formazione di questa soluzione non richiede energia perché non si
rompono i legami chimici ed è quindi rapidissima. Dato che le molecole del occupano solo una piccola
parte del volume a loro disposizione, i gas sono completamente miscibili.
LEGGE DI DALTON o DELLE PRESSIONI PARZIALI
Le leggi dei gas sono applicabili anche alle soluzioni. Consideriamo una soluzione gassosa costituita da
uno,due,tre..n gas all’interno di un recipiente dal volume V e alla temperatura T. La soluzione è costituita
da un numero di moli (ntot) che è dato da n1,n2,n3...nn. Si può dimostrare sperimentalmente che la
pressione esercitata dalla soluzione gassosa è direttamente proporzionale al numero di molecole (ntot):
R *T
R *T
Ptot ntot *
Ptot n1 n2 n3 ...... nn *
ovvero
da cui si ricava che
V
V
R *T
R *T
R *T
R *T
R *T
R *T
Ptot n1 *
n2 *
n3 *
......... nn *
in cui n1 *
, n2 *
, ecc..
V
V
V
V
V
V
rappresentano la pressione esercitata da ciascun gas della soluzione ovvero la pressione parziale.
La pressione parziale di un gas è la pressione che il gas eserciterebbe nel caso fosse presente da solo
nel recipiente dal volume V che lo contiene.
Indicando con p1 n1 *
R *T
R *T
e con p 2 n2 *
avremo che Ptot = p1 + p2 +……+ pn.
V
V
Da qui la legge di Dalton: la pressione totale esercitata da una soluzione gassosa a temperatura e
volume costante è uguale alla somma delle pressioni esercitate dai gas che compongono la miscela.
SOLUZIONI SOLIDE
Analizziamo un sistema chiuso costituito da un liquido (H2O) e da ossigeno O2. Si tratta di un sistema
ordinato ma dato che un sistema ordinato tende a diventare disordinato per aumentare la sua entropia, le
molecole del gas tenderanno a diffondere nell’acqua.
La diffusione di un gas in un liquido è molto più lenta di quella di un gas in un gas in quanto le molecole
di acqua sono legate tra di loro e, per il verificarsi della diffusione, si devono rompere i legami
intermolecolari dell’acqua e formarsi nuovi legami tra liquido e gas.
Naturalmente le molecole del gas disciolte nel liquido possono ritornare alla stato di gas raggiungendo nel
tempo un condizione di equilibrio dinamico in cui il numero di molecole di gas che passa in soluzione è
uguale al numero di molecole che ritornano allo stato di gas: la soluzione è satura di gas.
SOLUBILITA’ DI UN GAS IN UN LIQUIDO
La solubilità di un gas in un liquido è la concentrazione massima espressa in moli in 1L di soluzione
(S = mol/L) e dipende da:
1. Pressione esercitata dal gas: aumentando la pressione del gas aumenta il numero di molecole per
unità di volume e quindi la quantità di gas che può diffondere nel liquido. La relazione che lega la
solubilità e la pressione si chiama legge di Henry: la solubilità di un gas in un liquido a una data
temperatura è direttamente proporzionale alla pressione parziale (p) che il gas esercita sulla
soluzione:
(con k = costante che dipende dal gas).
S k* p
I valori di solubilità sono calcolate in condizioni standard (TPS), cioè con t = 25°C e P = 1 atm.
2. Temperatura: quando le molecole del gas si sciolgono in un liquido si formano delle interazioni
gas-liquido. Aumentando al temperatura, aumenta l’energia cinetica delle molecole, i legami si
possono rompere, le molecole ritornano allo stato di gas e la solubilità diminuisce. La solubilità di
un gas in un liquido diminuisce all’aumentare della temperatura.
3. Tipo di gas: le molecole di alcuni gas (es. CO2, SO2, HCl, NH3) diffondendo nell’acqua possono
reagire con l’acqua in misura tanto maggiore quanto maggiore è la polarità:
CO2 + H2O → H2CO3
NH3 + H2O → NH4OH
HCl + H2O → H3O+ + ClIn tal caso nell’acqua possono diffondere più molecole di gas e l’equilibrio si formerà più tardi.
La solubilità di un gas dipende dalla natura chimica del liquido (polare o apolare) ed è maggiore
per quelli che possono reagire con l’acqua.
SOLUZIONI LIQUIDO-LIQUIDO
La solubilità di un liquido in un liquido è la quantità massima di liquido che si può sciogliere in un altro
liquido e dipende dalla sua natura chimica (polare o apolare):
a. L’acqua e l’alcol etilico (CH3-CH2-OH) sono due liquidi polari e possono formare legami
idrogeno; di conseguenza aggiungendo alcool etilico all’acqua si rompono i legami idrogeno tra le
molecole di acqua e di alcool e si formano nuovi legami idrogeno tra l’alcol e l’acqua.
I due liquidi sono miscibili in tutte le proporzioni e quindi si formano soluzioni omogenee.
b. Il benzene (C6H6) e il talmene (C6H8) sono entrambi apolari e tra questi due liquidi si formano
legami intermolecolari (interazioni di Van der Waals). Aggiungendo il benzene al talmene si
rompono i legami intermolecolari del benzene e del talmente e si formano nuovi legami tra i due
liquidi. Si tratta di una soluzione omogenea in cui gli elementi sono miscibili in tutte le
proporzioni.
I liquidi polari si sciolgono in soluzioni polari, quelli apolari in soluzioni apolari.
Da tener presente che i volumi di liquidi miscibili non sono additivi, cioè il volume che si ottiene
è leggermente inferiore perché tra i due liquidi si formano legami intermolecolari che determinano
una contrazione del volume.
c. Esaminiamo un liquido polare (es. H2O) e un liquido poco polare (es. etere di etilico CH3–CH2–
O–CH2–CH3). Aggiungendo etere all’acqua si ha che solo una piccola quantità di etere va in
soluzione (7%): superato questo valore l’etere non si scioglie più nell’acqua e quindi si avrà uno
strato inferiore di acqua satura di etere e uno stato superiore di etere saturo di acqua. I due liquidi
sono parzialmente miscibili.
SOLUZIONI DI UN SOLIDO IN UN LIQUIDO
MECCANISMO DI DISSOLUZIONE DI UN SOLIDO IN UN LIQUIDO
I solidi solubili in liquidi sono i solidi ionici e quelli molecolari (polari o apolari):
Dissoluzione di un solido ionico: consideriamo un solido ionico (NaCl) che è costituito da ioni
Na+ e Cl- tenuti insieme da legami ionici. Immergendo il solido cristallino in acqua (polare) si ha
che ogni ione Na+ attira, orienta e si lega con l’atomo di ossigeno dell’acqua che ha una parziale
carica negativa, mentre lo ione Cl- attira, orienta e si lega con gli atomi di idrogeno che hanno
parziale carica positiva. Il legame elettrostatico che si stabilisce tra uno ione e una molecola
polare si chiama ione-dipolo.
Se le forze di attrazione elettrostatica che si stabiliscono tra gli ioni e l’acqua superano le forze di
attrazione elettrostatica tra gli ioni, il legame ionico si rompe e gli ioni Na+ e Cl- vanno in
soluzione sotto forma di ioni idrati (se il solvente è diverso dall’acqua si parla di ioni solvatati).
Lo stato di idratazione degli ioni è specificato dal simbolo “aq”.
2O
NaCl( S ) H
Na ( aq) Cl ( aq)
2O
K 2 SO4 ( S ) H
2 K ( aq) SO4
2
( aq )
I cationi (ioni positivi) di alcuni sali, in genere gli ioni dei metalli di transizione, non solo si
idratano, ma addirittura reagiscono con l’acqua formando uno ione complesso.
Cu 2 ( aq) 4H 2O CuH 2O4 ione tetraquorame (II)
2
Non tutti i composti ionici sono solubili in acqua. In diversi composti infatti le forze di attrazione
che si instaurano tra gli ioni del composto e l’acqua non sono sufficienti per vincere le forze di
attrazione tra gli ioni del solido. In tal caso solo una piccola quantità di composto passa in
soluzione. Consideriamo:
a. Un solido molecolare polare (saccarosio) le cui molecole sono legate da legami ad
idrogeno: introducendo il solido in acqua si ha che i legami tra le molecole del saccarosio
si rompono e si formano nuovi legami ad idrogeno tra l’acqua e le molecole che vanno in
soluzione.
b. I solidi covalenti e metallici sono completamente insolubili in qualsiasi soluzione perché il
legame metallico è più forte dell’interazione soluto/solvente.
VELOCITÀ DEL PROCESSO DI DISSOLUZIONE
I fattori che influiscono sulla velocità di dissoluzione sono:
1. Estensione della superficie di contatto: aumentando la superficie esposta, aumentano le
interazioni tra soluto e solvente e quindi aumenta la velocità del processo di dissoluzione.
2. Agitazione della soluzione: aumentando l’agitazione della soluzione, le particelle vicino al soluto
si allontanano e così aumenta la possibilità che le particelle vadano in soluzione e quindi aumenta
la velocità di dissoluzione.
3. Temperatura: aumentando la temperatura ovvero fornendo calore aumenta l’energia cinetica
delle particelle del solido e i legami tra le particelle si possono rompere più facilmente e la
velocità del processo di dissoluzione aumenta.
VARIAZIONI DI ENRGIA NEL PROCESSO DI DISSOLUZIONE
Il processo di solubilizzazione di un soluto (solido o liquido) in una soluzione comporta la librazione o
l’assorbimento di calore. Il calore liberato o assorbito si chiama calore di soluzione ma più correttamente
si parla di entalpia di soluzione (Δh) e si esprime in KJ/K.
Alcuni soluti si sciolgono liberando calore, mentre altri si sciolgono assorbendo calore. Questo diverso
comportamento di un soluto in acqua dipende dal risultato delle variazioni energetiche legate alle
interazioni:
1. Solvente-solvente: per vincere le forze intermolecolari tra le molecole del solvente occorre
energia (E1). Il processo è endotermico.
2. Soluto-soluto: per vincere le forze tra le particelle di soluto è assorbita energia (E2). Il processo è
endotermico.
3. Solvente-soluto: quando le molecole di solvente circondano le particelle del soluto e lo idratano
(o lo solvatano), si formano nuovi legami, si libera energia (E3). Il processo è esotermico.
Da tener presente che per i composti ionici in acqua, le quantità di energia liberata è maggiore per i
cationi più piccoli che per quelli più grandi perché nei cationi più piccoli l’acqua si può avvicinare di più,
formare legami più forti liberando energia. L’energia che si libera aumenta all’aumentare della carica
dello ione.
La risultante dei tre tipi di interazione determina se il processo di solubilizzazione è endotermico (calore
di soluzione positivo) o esotermico (calore di soluzione negativo). Se la risultante è uguale a zero il
processo è atermico.
a. Se (E1 + E2) > E3 il processo è endotermico: l’energia assorbita è maggiore di quella
liberata. Il calore di soluzione è positivo e la soluzione si raffredda.
b. Se (E1 + E2) < E3 il processo è esotermico: l’energia assorbita è minore di quella liberata. Il
calore di soluzione è negativo e la soluzione si riscalda.
c. Se (E1 + E2) = E3 il processo è atermico: l’energia assorbita è uguale a quella liberata. Il
calore di soluzione è zero.
SOLUBILITÀ DI UN SOLIDO IN UN LIQUIDO
La solubilità di un solido in un liquido è la quantità massima di soluto espressa in grammi ad una data
temperatura in 100 g di solvente.
Una soluzione ad una data temperatura si chiama:
-
Insatura – se contiene una quantità di soluto inferiore al valore di solubilità;
-
Satura – se contiene una quantità di soluto uguale al valore di solubilità;
-
Satura con corpo di fondo – se contiene una quantità di soluto maggiore del livello di solubilità.
In una soluzione satura con corpo di fondo si stabilisce un equilibrio tra le particelle del soluto e quelle
presenti nella soluzione, cioè il numero di particelle che va in soluzione è uguale al numero di particelle
del soluto.
Se forniamo calore ad una soluzione satura con corpo di fondo aumenta anche l’energia cinetica delle
particelle del soluto disciolto. Di conseguenza più particelle di soluto vanno in soluzione aumentando la
solubilità. Si forma una soluzione sovrasatura, ovvero una soluzione che ad una data temperatura
contiene una quantità di soluto maggiore al valore della solubilità senza avere corpo di fondo.
Naturalmente se la soluzione si raffredda la solubilità diminuisce e il soluto in eccesso ritorna come corpo
di fondo.
FATTORI CHE INFLUENZANO LA SOLUBILITÀ DI UN SOLIDO IN UN LIQUIDO
Natura del solido - La diversa natura del solido, ovvero la diversa forza tra le particelle del soluto è
all’origine della diversa solubilità di sostanze diverse nello stesso solvente alla diversa temperatura.
Es -
La solubilità del PbCl2 alla temperatura di 25 °C è di 1 g in 100 g di H2O
La solubilità del ZnCl è di 20 g nelle stesse condizioni
I nitrati sono composti molto solubili, mentre i solfati lo sono poco solubili e i fosfati sono insolubili.
Temperatura - Per quanto riguarda la temperatura, la solubilità della maggior parte dei solidi molecolari
è maggiore quanto più grande è essa.
Si può verificare che per alcuni solidi la solubilità rimanga inalterata (es. NaCl), per altri diminuisce
(solfato di cesio).
L’aumento e la diminuzione della solubilità con l’aumento della temperatura dipende dal processo di
solubilizzazione (che può essere esotermico, endotermico e atermico)
La solubilità di un solido che in soluzione dà origine ad un processo esotermico, diminuisce con
l’aumento della temperatura., mentre uno che dà origine a un processo endotermico aumenta
all’aumentare della temperatura..
Quei soluti che quando si sciolgono non liberano energia (processo atermico) non sono influenzati da
temperatura.
Conoscendo la solubilità di un solido alle diverse temperature è possibile costruire la curva di solubilità.
SOLUZIONI DI UN SOLIDO IN UN SOLIDO
Fondendo due solidi e lasciando raffreddare si ha la formazione di una soluzione di due solidi che si
chiama lega, con proprietà fisiche diverse da quelle dei solidi di partenza.
La lega è quindi una soluzione omogenea formata da atomi di un metallo (base) e da atomi di una
elemento metallico o non metallico che viene detto alligante. Il tenore (concentrazione) degli elementi
alliganti è sempre inferiore alla quantità della base.
La formazione di cationi presuppone la sostituzione di alcuni atomi del metallo sotto forma di cationi nel
reticolo cristallino della base, con alcuni atomi dell’alligante. La sostituzione è possibile se i due elementi
hanno raggio atomico simile.
Alcuni metalli (es. oro e argento) possono formare leghe in tutte le proporzioni, in quanto, oltre ad avere
raggio atomico simile, hanno anche lo stesso reticolo cristallino.
Altri elementi possono formare leghe con proporzioni tra di loro ben definite:
bronzo = rame + stagno;
ottone = rame + zinco;
Ghisa e acciaio = carbonio + ferro
L’oro puro (24 carati) non è quasi mai usato perché troppo tenero: in genere si usa a 18 carati o a 12 (che
contiene rispettivamente il 66% e il 60% di oro) in lega con argento e rame.
TITOLAZIONE DELLE SOLUZIONI
La concentrazione (o titolo) di una soluzione, è la quantità di soluto in una data quantità di solvente o di
soluto.
Dal punto di vista qualitativo una soluzione si dice diluita quando la quantità di soluto è molto inferiore a
quella di saturazione, mentre concentrata quando la quantità di soluto è molto vicina a quella di
saturazione.
Dal punto di vista quantitativo, ovvero dal modo in cui si può esprimere la concentrazione, essa si può
indicare seguenti modi:
1. Percentuale massa-massa (%m/m) - Indica la massa di soluto presente in 100 g di soluzione;
2. Percentuale massa-volume (%m/v) - Indica la massa di soluto presente in 100 ml di soluzione.
E’ possibile passare dalla %m/m alla %m/v conoscendo la densità della soluzione: %m/v=%m/m
* d;
3. Frazione molare (X) - Indica i rapporto tra il numero delle moli di un componente della
soluzione e quello totale dei composti che costituiscono la soluzione. XA=nA/(nA+nB+nC) XA+
XB+XC=1;
4. Molarità (M) - Indica il numero di moli di soluto in 1L di soluzione e si esprime con il rapporto
n/V;
5. Molalità (m) - Indica il numero di moli in 1 Kg di soluzione e si esprime con il rapporto n/massa
PROPRIETÀ COLLIGATIVE DI UNA SOLUZIONE
Le proprietà colligative sono proprietà fisiche che non dipendono dalla natura chimica del soluto ma che
dipendono dalla sua concentrazione. Esse sono:
1.
2.
3.
4.
Abbassamento della tensione di vapore;
Innalzamento della temperatura di ebollizione (innalzamento ebullioscopico);
Abbassamento del punto di congelamento(abbassamento crioscopico);
Pressione osmotica.
Abbassamento della tensione di vapore
La tensione di vapore di una soluzione (P0), quando in un solvente A volatile, viene sciolto un soluto
B non volatile e non elettrolita (composto che non si dissocia in ioni in soluzione), alla stessa
temperatura diminuisce rispetto a quella del solvente puro, perché, data la presenza del soluto, è
minore il numero di molecole volatili in superficie (quelle del solvente), e quindi quello di molecole
che possono evaporare.
Maggiore è la concentrazione, minore sarà la tensione di vapore. La relazione che lega le due
grandezze è la legge di Reoult, che è così definita: la tensione di vapore di una soluzione di un soluto
non volatile e non elettrolita è proporzionale alla concentrazione del solvente espresso in frazione
molare(XA):
p=pAXA.
Da questa relazione si può calcolare che l’abbassamento di tensione di vapore di una soluzione è Δp=
pAXB. Quindi se il soluto presente nella soluzione è un elettrolita, dovendo tenere conto del numero di
ioni in cui si dissocia (è come se ci fossero più soluti disciolti), la relazione cambia in questo modo
Δp= pAXB i, dove i è il coefficiente di Van Thoff, ed è pari al numero di ioni in cui si dissocia il
soluto.
Innalzamento della temperatura di ebollizione
La temperatura di ebollizione di un solvente puro è la temperatura alla quale la tensione di vapore
delle bolle formate all’interno del liquido, diventa pari alla pressione atmosferica.
Poiché la tensione di vapore dipende dalla concentrazione di soluto in una soluzione, e diminuisce con
l’aumentare di essa, la temperatura di ebollizione aumenterà in modo che la tensione di vapore
raggiunga il valore tipico dell’ebollizione. Così il punto di ebollizione di un solvente puro è minore di
quello di una sua soluzione.
L’aumento del punto di ebollizione di una soluzione si chiama innalzamento ebullioscopico (ΔTe) e
corrisponde alla differenza tra le temperatura di ebollizione con e senza soluto. L’innalzamento
ebullioscopico è direttamente proporzionale alla molalità e alla costante ebullioscopica molale, che
corrisponde all’aumento della temperatura di ebollizione di una soluzione 1m di un qualsiasi soluto in
un dato solvente:
ΔTe = Ke m
dove Ke è la costante ebullioscopia molale e m è la
molalità. Il valore risulta così indipendente dal soluto, mentre dipende dal solvente: per l’acqua è
0,512 °C Kg/mol. Questo vale per soluti che non siano elettroliti forti, per cui si deve moltiplicare il
tutto per il coefficiente di Van Thoff, modificando l’equazione in:
ΔTe = Ke m i
Abbassamento del punto di congelamento
La temperatura di congelamento è la temperatura alla quale un liquido diventa solido.
Quando la temperatura del liquido si abbassa fino al punto di congelamento le particelle del liquido
interagiscono tra di loro formando un reticolo cristallino.
In una soluzione la presenza di particelle di soluto tra quelle del solvente rende più deboli le
interazioni tra le particelle del solvente e, affinché le interazioni diventino tanto forti da formare il
reticolo cristallino, è necessario che la temperatura sia minore. Tale abbassamento è detto
abbassamento crioscopico (ΔTc), ed è direttamente proporzionale alla concentrazione della
soluzione espressa in molalità, secondo la relazione:
ΔTc = Kc m
dove Kc è la costante
crioscopica molale che corrisponde alla diminuzione della temperatura di congelamento di una
soluzione 1m di un qualsiasi soluto in un dato solvente. Come per quella ebullioscopica, la costante
dipende solo dal solvente, e per l’acqua è apri a 1,86.
Anche in questo caso si è esaminata una soluzione con un soluto non elettrolitico, perché in caso
contrario è necessario moltiplicare il ΔTc per il coefficiente di Van Thoff: ΔTc = Kc m i
DETERMINAZIONE DELLA MASSA MOLARE
L’innalzamento ebullioscopico o l’abbassamento crioscopico forniscono un metodo per calcolare la
massa molare di un soluto. Il procedimento è il seguente:
1) Si scioglie in un solvente una quantità del soluto in esame nota
2)
3)
4)
5)
Si determina l’innalzamento ebullioscopico o l’abbassamento crioscopico.
Nota la costante ad essi associata si calcola la molalità
Da essa si ricava il numero di moli in soluzione
Si conosce così la massa molare (massa del soluto fratto numero di moli)
DIAGRAMMA DI FASE O DI STATO DI UNA SOLUZIONE
Riportando in un grafico i valori della tensione di vapore e della temperatura di ebollizione, di
congelamento di un solvente puro in funzione della temperatura e della pressione, si costruisce un
diagramma di stato o di fase del solvente.
Se ad esso aggiungiamo un soluto non volatile si ha una diminuzione della P0 e quindi del punto di
congelamento e un innalzamento della temperatura di ebollizione.
Il diagramma di fase della soluzione può essere dedotto da quello del solvente puro: la linea di
vaporizzazione/liquefazione diminuisce la propria ordinata di ΔP0, e aumenta l’ascissa di ΔTe, mentre la
linea di solidificazione/fusione riduce la sua ascissa di ΔTc.
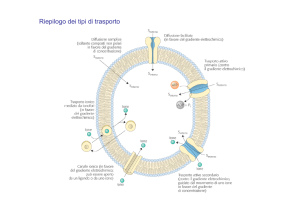
OSMOSI
Considerando un tubo di vetro a U, in cui siano presenti due soluzioni con lo stesso solvente (o una
soluzione e il suo solvente puro), separati da una membrana semipermeabile (cioè che permette il
passaggio in entrambi i sensi solo alle particelle di solvente), si osserva che, dopo un po’ di tempo, il
livello della soluzione che prima era meno concentrata è calato, mentre l’altro è aumentato della stessa
quantità: ciò avviene perché nella soluzione meno concentrata ci sono più molecole di solvente nell’unità
di volume, e quindi ci sono più probabilità che, nel loro movimento caotico passino dall’altra parte,
mentre nella soluzione più concentrata avverrà l’opposto.
Così si ha uno spostamento netto dalla soluzione ipotonica (con concentrazione minore), a quella
ipertonica (con concentrazione maggiore). Se le due soluzioni sono isotoniche (uguale concentrazione)
non avverrà alcuno spostamento.
Si definisce osmosi il processo che porta alla migrazione spontanea della particelle di solvente da una
soluzione meno concentrata a una più concentrata.
Pressione osmotica
L’innalzamento del livello della soluzione che si ha nel tubo dopo un dato tempo si arresta: infatti il
passaggio preferenziale di particelle di solvente verso la soluzione più concentrata attraverso la membrana
continua fino a che la pressione in più che tale soluzione esercita in virtù del fatto che c’è un dislivello del
liquido, non lo arresta, o meglio, fino a che il numero di particelle che vanno nelle due direzioni è uguale
e si stabilisce una condizione di equilibrio.
Quindi la colonna di liquido in più in una parte del tubo esercita una pressione (idrostatica nel caso
dell’acqua) che rallenta il flusso di solvente fino a fermarlo.
Se quindi si esercita sulla soluzione ipertonica una pressione pari a quella di tale colonna, si avrà che il
flusso di solvente si arresterà: tale pressione è detta pressione osmotica (π) e si definisce come quella
pressione che è necessario esercitare su una soluzione ipertonica rispetto a una ad essa collegata con una
membrana semipermeabile per impedire la sua diluizione. Anche questa è una proprietà colligativa.
Tra la pressione osmotica di una soluzione e il suo volume, il numero di moli di soluto in essa disciolti e
la temperatura, c’è la seguente relazione (valida solo per soluzione diluite), analoga all’equazione di stato
dei gas ideali:
πV = nRT → π = (n/V)RT → π = MRT (dove M è la molarità)
Tali relazioni si modificano in caso che il soluto sia un elettrolita forte moltiplicando il secondo termine
per il coefficiente di Van Thoff:
πV = nRT i → π = MRT i