2. La Mole
• Misure e Unità di Misura
• L’Incertezza delle Misure
- come utilizzare le cifre significative nel calcolo
• Le Quantità Chimiche
- la MOLE
- la MASSA MOLARE
- la misura dei composti
• La Determinazione della Formula Chimica
- composizione percentuale in massa
- formula empirica
- formula molecolare
• Le Soluzioni
- concentrazioni
Misure e Unità di Misura
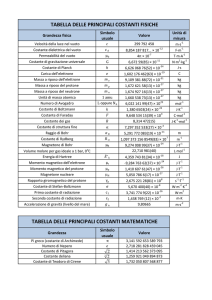
Sistema Internazionale di unità (SI)
Grandezza fisica
Unità di misura
Grandezza fisica
Unità di misura
Lunghezza
metro
m
Area
metro quadrato
m2
Massa
chilogrammo
kg
Volume
metro cubo
m3
Tempo
secondo
s
Velocità
m·s-1
Intensità di corrente elettrica
ampere
A
metro per
secondo
Temperatura
kelvin
K
Densità
chilogrammo per
metro cubo
kg ·m-3
Intensità luminosa
candela
cd
Potenziale elettrico
coulomb, C
A ·s
Quantità di materia
mole
mol
Risultato della misura = numero x UNITÀ DI MISURA
Prefisso
Nome
Significato
Prefisso
Nome
Significato
G
giga -
109
m
milli -
10-3
M
mega -
106
µ
micro -
10-6
k
kilo -
103
n
nano -
10-9
d
deci -
10-1
p
pico -
10-12
c
centi -
10-2
Misure e Unità di Misura
Fattore di Conversione
Fattore di Conversione =
unità richieste
unità date
X
ESEMPIO 1
X
Convertire in metri quadrati (m2) un’area di
256 cm2.
1m
unità richieste
=
10 2 cm
unità date
2
2
2
1
m
(256 cm ) × m
2
2
−2
2
Area (m ) = (256 cm ) × 2
=
2
.
56
×
10
m
=
10 4 cm2
10 cm
ESEMPIO 2
Convertire una velocità di 1.5 km·s-1 in km·h-1
1h
unità richieste
=
3600 s
unità date
−1
1
h
1.5 km 3600 s
×
= 5.4 × 10 3 km ⋅ h−1
Velocita (km ⋅ h-1 ) = (1.5 km ⋅ s -1 ) ×
=
s
1h
3600 s
L’Incertezza delle Misure
Le cifre riportate nella misura si intendono come cifre significative.
Es.: In 1.2 cm3 compaiono 2 cifre significative.
•Incertezza delle misure (l’ultima cifra è imprecisa entro ±0.5 di quella cifra
stessa).
- 1.2 cm3 indica che il volume si colloca tra 1.15 e 1.25 cm3.
•Significatività dello zero, 0.
- 22.0 L
significativo → 3 cs.
- 22.05 ml
significativo → 4 cs.
- 0.0025 kg = 2.5x10-3 kg non significativo → 2 cs
Come riportare le cifre significative:
1. I risultati delle misure sono sempre incerti, mentre quelli del computo
sono sempre esatti.
2. Nell’addizione e sottrazione, il numero delle cifre decimali del risultato
è identico a quello del dato con minor numero di cifre decimali.
3. Nella moltiplicazione e divisione, il numero di cifre significative del
risultato è uguale al minimo numero di cifre significative che compare
nei dati.
4. Arrotondamento: per eccesso se >5, per difetto se <5, cifra pari se =5.
La Mole
Unità fondamentale del SI. Misura la Quantità di Materia
Def. Una MOLE (1 mol) è il numero di atomi presenti in 12 g esatti di 12C .
m(12C) = 1.9926x10-23 g (massa assoluta di 1 atomo di 12C)
1 mole =
12g
= 6.022x1023, Numero di Avogadro, NA
- 23
1.9926 × 10 g
Def. Una MOLE (1 mol) di una sostanza qualsiasi è la quantità di materia
che contiene SEMPRE un numero di Avogadro, NA, di particelle di quella
sostanza (atomi, molecole, ioni).
12 g
GRAFITE
12 g
DIAMANTE
La Mole
C3H8(g) + 5O2(g)
3CO2(g) + 4H2O(l)
2x
C3H8(g) + 5O2(g)
3CO2(g) + 4H2O(l)
4x
C3H8(g) + 5O2(g)
3CO2(g) + 4H2O(l)
NA=6.022x1023x
C3H8(g) + 5O2(g)
3CO2(g) + 4H2O(l)
Una MOLE (1 mol) di
una sostanza
qualsiasi è la
quantità di materia
che contiene
SEMPRE un numero
di Avogadro, NA, di
particelle di quella
sostanza
1 mol C3H8(g) + 5 mol O2(g) → 3 mol CO2(g) + 4 mol H2O (l)
MICROSCOPICO
1 molecola
6.022x1023
MACROSCOPICO
1 mol di molecole
La Mole
PM(C3H8)= 3xPA(C)+8PA(H)
44.097 u
Massa di 1 mol di C3H8= MM(C3H8)=Massa Molare=PM(C3H8)xNAxFC
44.097 u x 6.022x1023 x 1.661x10-24 g/u
MICROSCOPICO
Peso Atomico/
Molecolare/ Formula (u)
PESO DI UNA PARTICELLA
44.097 g·mol-1
PM(C3H8) = 44.097 u
6.022x1023
MACROSCOPICO
Massa Molare (g·mol-1)
PESO DI UNA MOLE DI
PARTICELLE
MM(C3H8) = 44.097 g·mol-1
La Mole
6.022x1023
1 atomo H
PA = 1.008 u
1 mol di H
MM = 1.008 g·mol-1
La Massa Molare di una mole di atomi è uguale
al Peso Atomico espresso in grammi (g).
La Mole
6.022x1023
1 molecola H2
PM = 2.016 u
1 mol di H2
MM = 2.016 g·mol-1
La Massa Molare di una mole di molecole è
uguale al Peso Molecolare espresso in
grammi (g).
La Mole
6.022x1023
1 Unità Formula NaCl
PF = 58.44 u
1 Mole NaCl
MM = 58.44 g·mol-1
La Massa Molare di una mole di un composto
ionico è uguale al Peso Formula espresso in
grammi (g).
Dalle Definizioni ai Problemi
Def. Una MOLE (1 mol) di una sostanza qualsiasi è la quantità di materia
che contiene SEMPRE un numero di Avogadro, NA, di particelle di quella
sostanza (atomi, molecole, ioni).
Numero di Particelle = Numero di Moli x NA
Esercizio. Un campione di vitamina C contiene 1.29x1024 atomi di idrogeno
(insieme con altri tipi di atomi). Si esprima tale numero come numero di
moli di atomi di idrogeno.
Strategia. Abbiamo il numero di atomi di H e conosciamo NA. Dalla formula,
possiamo ricavare il dato che ci è richiesto, utilizzando la formula inversa:
Numero di Atomi di H
Numero di Moli =
NA
1.29 × 10 24 particelle
=
6.022 × 10 23 particelle ⋅ mol-1
= 2.14 mol
Dalle Definizioni ai Problemi
Def. La MASSA MOLARE di una mole di atomi, molecole, composti ionici
è uguale al PESO ATOMICO, MOLECOLARE, FORMULA, rispettivamente,
espresso in grammi (g).
Massa del Campione = Numero di Moli x Massa Molare, MM
Esercizio. Calcolare il numero di moli di molecole OC(NH2)2 presenti in 2.3
kg del composto.
Strategia. Abbiamo la massa del campione e, dalla formula chimica,
ricaviamo la massa molare. Dalla formula, possiamo ricavare il dato che ci
è richiesto, utilizzando la formula inversa:
PM = PA(O) + PA(C) + 2xPA(N) + 4PA(H) = 60.03 u
MM = 60.03 g·mol-1
Massa del Campione
Numero di Moli =
MM
2.3 × 10 3 g
=
60.03 g ⋅ mol-1
= 38.31 mol
La Determinazione della Formula Chimica
1. FORMULA EMPIRICA: proporzione numerica tra gli atomi dei vari
elementi.
Si deduce dalla composizione percentuale in massa.
massa percentuale C/H/O =
Campione di 8.00 g → Carbonio 3.27 g
Idrogeno 0.366 g
Ossigeno 4.36 g
massa di C/H/O nel campione
× 100
massa totale campione
40.9%
4.58%
54.5%
Ipotizziamo che il campione abbia massa totale di 100 g, da cui possiamo
ottenere il Numero delle Moli, con la MM.
Numero di Moli C/H/O =
Campione di 100 g → Carbonio 40.9 g
Idrogeno 4.58 g
Ossigeno 54.5 g
Divido x 3.41
C3.41H4.54O3.41
massa di C/H/O
MM(C/H/O )
3.41 mol
4.54 mol
3.41 mol
C1H1.33O1
Moltiplico x 3
2. FORMULA MOLECOLARE.
Si ottiene conoscendo la massa molare del campione.
C3H4O3
Per questo campione, MM = 176.14 g·mol-1
MM(C3H4O3) = 3 x (12.011 g·mol-1) + 4 x (1.008 g·mol-1) + 3 x (16.00 g·mol-1) = 88.06 g·mol-1
176.14 g ⋅ mol-1
= 2.000
C6H8O6
88.06 g ⋅ mol-1
Le Soluzioni
Def. Una SOLUZIONE è una classe speciale di miscele omogenee costituita
da un SOLUTO, ciò che è sciolto, e un SOLVENTE, ciò che scioglie.
DETERMINAZIONE DELLA CONCENTRAZIONE
1. MOLARITÀ, M [mol·L-1]
M=
numero moli SOLUTO (mol)
volume SOLUZIONE (L)
2. MOLALITÀ, m [mol ·kg-1]
m=
numero moli SOLUTO (mol)
massa SOLVENTE (kg)
5. FRAZIONE MOLARE, X
moli SOLUTO (mol)
moli (SOLUTO + SOLVENTE) (mol)
moli SOLVENTE (mol)
X(SOLVENTE ) =
moli (SOLUTO + SOLVENTE) (mol)
X(SOLUTO) =
X(SOLUTO) + X(SOLVENTE) = 1
3. PERCENTUALE PESO/PESO, %(w/w)
%(m / m) =
massa SOLUTO (kg)
× 100
massa (SOLUTO + SOLVENTE) (kg)
4. PERCENTUALE VOLUME/VOLUME, %(v/v)
%(v / v) =
volume SOLUTO (L)
× 100
volume (SOLUTO + SOLVENTE) (L)
Esercizi
Esercizio. Calcolare MOLARITÀ e MOLALITÀ di una soluzione di H2SO4 al
62% (w/w), sapendo che la densità, d = 1.52 g·mL-1.
M=
moli SOLUTO (mol)
volume SOLUZIONE (L)
m=
moli SOLUTO (mol)
massa SOLVENTE (kg)
1 L = 1000 mL → dalla densità, 1000 mL · 1.52 g·mL-1 = 1520 g
→ dalla %(w/w)
H2 SO 4 puro = 1520
62
= 942.4 g
100
PM(H2SO4) = 2xPA(H) + PA(S) + 4xPA(O) = 98.09 u
MM (H2SO4) = 98.09 g·mol-1
massa H2 SO 4
942.4 g
moli H2 SO 4 =
=
= 9.613 mol
MM
98.09 g ⋅ mol-1
(100 − 62)
massa H2O = 1520
= 577.6 g = 0.5776 kg
100
moli SOLUTO (mol)
9.613
m=
=
=
16.64 mol ·kg-1
massa SOLVENTE (kg) 0.5776
9.613 M
Esercizi
Esercizio. Quanto H2SO4 al 62%, 9.613 M, e quanta H2O sono necessari
per ottenere 1.5 L di soluzione 2.0 M?
Vin x Min = Vfin x Mfin
Mfin × Vfin 2.0 mol ⋅ L-1 × 1.5 L
Vin =
=
= 0.312 L
-1
Min
9.613 mol ⋅ L
V (H2O) = 1.5 L - 0.312 L = 1.188 L
Litri soluzione H2SO4 iniziale
Litri H2O