PROTOCOLLO PER LA
DIAGNOSI
ED IL
FOLLOW-UP
DELLA MALATTIA CELIACA
a cura del Comitato Scientifico Nazionale (CSN)
dell’Associazione Nazionale Celiachia (AIC)
(A. Calabrò, C. Catassi, I. De Vitis, L. Greco, P. Lionetti, S. Martelossi,
A. Picarelli, R. Troncone, U. Volta)
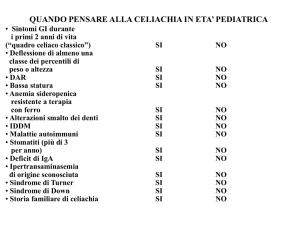
Introduzione
La malattia celiaca è un’intolleranza alimentare permanente nei confronti del glutine,
contenuto in alcuni cereali (in particolare frumento, segale, orzo), in grado di determinare, in
soggetti geneticamente predisposti, un danno della mucosa dell’intestino tenue sotto forma di
atrofia dei villi, iperplasia delle cripte ed infiltrato linfocitario intraepiteliale (1). Tali alterazioni
determinano la comparsa di malassorbimento, che può essere manifesto con la tipica diarrea e
perdita di peso, subclinico con sintomi atipici (fra cui stipsi e dispepsia) ed extraintestinali (anemia
sideropenica o da carenza di acido folico, osteoporosi, poliabortività) e sempre più spesso del tutto
silente sul piano clinico. La dieta senza glutine porta alla normalizzazione della mucosa intestinale
consentendo un regolare assorbimento dei nutrienti e la maggior parte dei celiaci, a patto di
osservare strettamente tale dieta, possono condurre una vita regolare senza alcun tipo di
complicanze. Peraltro, la mancata diagnosi o la diagnosi tardiva espongono i pazienti al rischio di
sviluppare patologia autoimmune ed idiopatica a carico del sistema nervoso centrale e periferico,
dell’apparato cardiocircolatorio, del sistema endocrino, del fegato e della cute, nonché complicanze
quali severe alterazioni della parete intestinale (digiunoileite ulcerativa e sprue collagenosica) o
quadri di scarsa o assente risposta alla dieta (celiachia refrattaria) ed insorgenza di neoplasie, in
particolare linfoma non Hodgkin a livello intestinale e varie forme di eteroplasia epiteliale
dell’apparato gastroenterico. Sebbene sia stata inclusa dalla legislazione italiana fra le malattie rare,
la celiachia è una malattia molto frequente con una prevalenza negli studi su popolazione generale
di 1 caso ogni 100-150 abitanti (2, 3), ma purtroppo ancora poco diagnosticata dal momento che in
Italia il numero di casi identificati si aggira sui 50.000 a fronte di una stima almeno 7 volte
superiore. Alla luce di questi dati è evidente l’importanza di incrementare il trend diagnostico e
soprattutto la diagnosi precoce che è in grado di prevenire ogni tipo di complicanza.
Protocollo diagnostico
Predisporre un protocollo diagnostico per la malattia celiaca non è certo un compito
semplice, proprio perché vi sono diverse opzioni molte delle quali altrettanto valide e la cui scelta ci
obbliga a fare comunque alcune rinunce. E’ d’altra parte indispensabile stabilire le linee-guida che
ci consentano di poter disporre di un protocollo semplice, basato su pochi test essenziali, un
protocollo che sia applicabile su tutto il territorio nazionale e che sia al tempo stesso, pur nella sua
semplicità ed universalità di esecuzione, in grado di identificare il maggior numero di celiaci
riducendo al minimo le mancate diagnosi e soprattutto le diagnosi sbagliate (Tab. 1).
Tabella 1
Criteri Protocollo Diagnostico
• Semplice (pochi test essenziali)
• App licabile in tutti i centri sul territorio
nazionale
• In grado di identificare il maggior numero
di
celiaci
(riduzione
numero
diagnosi
mancate) e di evitare le false diagnosi
(ancora molto elevate)
Quest’ultimo fenomeno è andato aumentando negli ultimi tempi con riscontro nella pratica
clinica di pazienti diagnosticati come celiaci o sulla base della positività per marcatori anticorpali
aspecifici o di un aplotipo genetico compatibile con celiachia (HLA-DQ2), presente peraltro anche
nel 30% della popolazione sana, o sulla base di una scarsa tolleranza al glutine sul piano clinico. E’
venuto pertanto il momento di dare un taglio netto a questa situazione e di stabilire delle regole
fisse.
E’ possibile individuare 3 diversi percorsi diagnostici a seconda che ci si ritrovi di fronte ad
un forte sospetto clinico di celiachia (malassorbimento franco, caratterizzato da significativo calo
ponderale, diarrea ed astenia severa), a pazienti con bassa probabilità di celiachia (casi monopaucisintomatici) e a familiari di I° grado di celiaci (Tab.2).
Tabella 2
Protocollo Diagnostico
• Elevato sospetto clinico di celiachia
(malassorbimento franco)
• Moderata-bassa probabilità di celiachia
(casi mono-paucisintomatici)
• Familiari di 1° grado di celiaci
I test da utilizzare per fare diagnosi di celiachia sono i marker anticorpali e la biopsia
intestinale (Tab. 3).
Tabella 3
TEST DI I LIVELLO
ANTICORPI*
• A. ANTI tTG UMANA IgA (IgG nei deficit
di IgA)
BIOPSIA DUODENALE
• Classificazione di Marsh, modificata da
Oberhuber, da inquadrare nel contesto
clinico, anticorpale e genetico
*
EmA come test di conferma da eseguirsi in centri di riferimento nei
casi dubbi; AGA da ricercarsi solo nei bambini con età < 2 anni
La diagnosi di celiachia dovrebbe sempre passare attraverso queste due indagini, perché, se
è vero che la biopsia intestinale rimane il “gold standard”, la sierologia è altrettanto importante sia
in funzione della conferma diagnostica che del follow-up del paziente. La scelta del test anticorpale
per il protocollo è il primo punto critico da affrontare. In laboratori di immunologia dedicati
all’esecuzione dell’immunofluorescenza (IFL) la ricerca degli anticorpi antiendomisio (EmA) di
classe IgA è sicuramente da considerarsi il test di eccellenza per la diagnostica della celiachia. In
questi ultimi anni, però, l’esperienza pratica ci ha insegnato che i risultati ottenuti con l’impiego
degli anticorpi anti transglutaminasi umana (anti tTG) di classe IgA sono praticamente
sovrapponibili in termini di sensibilità, con un livello di specificità lievemente inferiore agli EmA
(dal 2 al 5% di falsi positivi in pazienti con infezioni intestinali – in particolare giardiasi-, malattie
infiammatorie croniche intestinali, patologia autoimmune). Inoltre, se dobbiamo identificare un test
riproducibile su tutto il territorio nazionale in qualsiasi tipologia di laboratorio, la scelta è
obbligatoriamente quella degli anti tTG, dal momento che la lettura in IFL degli EmA è soggetta ad
una forte variabilità interobserver con evidenti problemi di attendibilità e riproducibilità di risultati.
Il test anticorpale da eseguire è stato pertanto identificato nella ricerca degli anticorpi anti tTG di
classe IgA (se i valori delle IgA totali sieriche sono nella norma) e di classe IgG (in caso di deficit
di IgA (IgA sieriche < 5 mg/dl). Gli EmA devono essere utilizzati come test di conferma da
eseguirsi in laboratori di riferimento con elevata esperienza nella lettura dell’immunofluorescenza.
Inoltre, nei pazienti di età < 2 anni è consigliabile aggiungere alla ricerca degli anti tTG quella degli
anticorpi antigliadina (AGA) di classe IgA (se le IgA sieriche sono normali) ed IgG (se le IgA
sieriche sono < 5 mg/dl), dal momento che la risposta anticorpale verso la gliadina è la prima a
comparire in ordine di tempo dopo l’introduzione del glutine e, pertanto, nei bambini piccoli gli
AGA presentano una elevata sensibilità diagnostica, probabilmente superiore a quella degli anti
tTG.
Il secondo punto è quello della biopsia intestinale. La classificazione di Marsh, modificata
da Oberhuber (4), è accettata ed utilizzata universalmente nell’interpretazione delle alterazioni
istologiche dell’intestino tenue (Tab.4).
Tabella 4
Classificazione istologica delle lesioni
intestinali nella celiachia
•Aumento IEL (>40/100 ce)
•Iperplasia delle cripte
•Atrofia lieve dei villi
•Atrofia subtotale dei villi
•Atrofia totale dei villi
(tipo 1)
(tipo 2)
(tipo 3a)
(tipo 3b)
(tipo 3c)
IEL: linfociti intraepiteliali, ce: cellule epiteliali
Classificazione di Marsh, modificata da Oberhuber, Eur J Gastroenterol
Hepatol 1999
E’ venuto il momento di applicarla su tutto il territorio nazionale, considerando anche quei
parametri, che pur non essendo diagnostici presi singolarmente, possono in caso di positività
sierologica e di quadro clinico di malassorbimento conclamato autorizzare il sospetto di malattia
celiaca. In questa ottica acquista naturalmente valore anche la conta dei linfociti intraepiteliali
(IEL), il cui livello è da considerarsi patologico quando IEL>40, anche se lavori recenti hanno
abbassato il cut-off di IEL a 25/100 (5).
L’HLA è un test di secondo livello con finalità ben precise, da eseguirsi quando né i test
anticorpali né la biopsia intestinale hanno portato ad una diagnosi certa (Tab. 5).
Tabella 5
TEST DI II LIVELLO: HLA
(dopo anticorpi e/o biopsia non diagnostici)
Test eseguito per escludere celiachia
Negatività DQ2/ DQ8
bassissima probabilità di celiachia
Positività DQ2 o DQ8
predisposizione alla malattia
nei familiari di 1° grado
Il presente protocollo ribadisce che la funzione degli HLA è innanzitutto quella di escludere
con elevata probabilità la diagnosi di celiachia quando non vi è presenza né di DQ2 né di DQ8 (i
casi di celiachia DQ2, DQ8 negativi sono estremamente rari 6); in secondo luogo che la positività
per DQ2 o DQ8 in soggetti definiti a rischio di celiachia (quadro clinico suggestivo di malattia) e
nei familiari di I grado, ancorchè presenti in alta percentuale nella popolazione sana, deve indurci
ad un’attenta sorveglianza e monitoraggio di questi soggetti, ed a controllo periodico dei test
anticorpali.
Veniamo all’analisi dettagliata dei vari percorsi del protocollo diagnostico:
Fig.1. Soggetti ad elevato rischio di celiachia (forme di malassorbimento franco con calo ponderale,
astenia e diarrea).
ALGORITMOPERLADIAGNOSI DI CELIACHIA
ELEVATOSOSPETTOCLINICODI CELIACHIA
Biopsiaduodenale+IgAsieriche+anti tTG*
IgAanti tTG
(seIgA normali)
IgGanti tTG
(sedeficit di IgA)
Sierologiapositiva+biopsianormale
Sierologiapositiva+biopsiapositiva
Sierologianegativa+biopsiapositiva
DeterminazioneHLADQ2DQ8
CELIACHIA
Esclusionedi altrecausedi mucosapiatta
Sepositivi, monitoraggio
anti tTGeripeterebiopsia
otrial conGFDper verificare
rispostaclinico-anticorpale
DeterminazioneHLADQ2DQ8
Senegativi,
anti tTGfalsi positivi^
Sepositivi, CELIACHIA
daconfermareconGFDechallenge
*istologiatipo1-2monitoraggio
eripetizionebiopsia
Senegativi, bassaprobabilitàdi celiachia^
ulteriorericercadi altrecause
di dannomucosale
*Nei soggetti di età < 2 anni ricerca anche di AGA oltre ad anti tTG ^rari casi di celiachia non DQ2, DQ8 positivi
Casi particolari discordanti per istologia e sierologia da inviare a Centri di alta specializzazione
Figura 1
Si procede di pari passo con l’esecuzione della biopsia intestinale e con il dosaggio degli anticorpi
anti tTG di classe IgA (se il dosaggio delle IgA totali sieriche risulta nella norma ) o di classe IgG
(se è presente deficit di IgA – IgA < 5 mg/dl). Nei soggetti di età < 2 anni, come già illustrato, si
esegue anche la ricerca degli AGA IgA o IgG (in caso di deficit di IgA).
Se vi è concordanza fra positività anticorpale e quadro istologico (atrofia dei villi: lesione
tipo 3a-3c) la diagnosi è di celiachia;
Se la sierologia è positiva e la biopsia normale, si procede alla determinazione dell’HLA:
1) in caso di DQ2 o DQ8 positività, sono previste due opzioni, che consistono o nel
monitoraggio anticorpale con ripetizione della biopsia duodenale a distanza di tempo o, in
qualche raro caso fortemente sintomatico, in un trial con dieta aglutinata (gluten free diet –
GFD) per valutare l’impatto della GFD sul quadro clinico-anticorpale;
2) in caso di DQ2 e DQ8 negativi, gli anti tTG sono verosimilmente da considerarsi falsi
positivi, e la diagnosi di celiachia è quasi certamente da escludere anche se è noto dalla
letteratura, come già detto, che rari casi di intolleranza al glutine non presentano l’aplotipo
DQ2, DQ8;
Se la sierologia è negativa e la biopsia positiva, la prima cosa da fare è escludere altre cause
di atrofia della mucosa intestinale, dopodichè si procede alla ricerca dell’HLA:
1) in caso di positività per DQ2 o DQ8, la diagnosi è di celiachia da confermarsi con un iter
diagnostico completo basato su controlli bioptici dopo dieta aglutinata e dopo challenge
con glutine. Nei pazienti HLA DQ2 o DQ8 positivi con lesioni istologiche minime (tipo 1-2),
è consigliabile il monitoraggio clinico-anticorpale del paziente con ripetizione della biopsia
duodenale a distanza di tempo.
2) in caso di negatività per DQ2 e DQ8, la diagnosi di celiachia è da escludersi quasi
completamente, fermo restando che una piccola parte di celiaci non condivide, come già
sottolineato, l’aplotipo classico. In questi casi sarà opportuno ricercare nuovamente altre
patologie in grado di determinare atrofia della mucosa intestinale non-glutine dipendente
(giardiasi, enteropatia autoimmune, linfangectasia intestinale, etc..).
Fig. 2. Soggetti a moderato-basso rischio di celiachia: casi mono-paucisintomatici
ALGORITMO PER LA DIAGNOSI DI CELIACHIA
CASI MONO-PAUCISINTOMATICI
IgA sieriche+anti-tTG*
IgA anti tTG
(se IgA normali)
IgG antitTG
(se deficit IgA)
Sierologia negativa
Sierologia positiva
Diagnosi di celiachia esclusa
Biopsia duodenale
Istologia positiva
(tipo 3a-3c)
Istologia negativa
o tipo 1-2
CELIACHIA
Determinazione HLA DQ2 DQ8
Se positivi, monitoraggio anti tTG
e ripetere biopsia
Se negativi, anti tTG
falsi positivi
*Nei casi di età <2anni ricerca AGA oltre agli anti tTG ^rari casi di celiachia non DQ2, DQ8 positivi
Figura 2
Davanti ad un paziente con moderata-bassa probabilità di celiachia (casi mono-paucisintomatici),
si esegue la ricerca degli anti tTG IgA (se non deficit IgA) o IgG (se deficit IgA), associata alla
ricerca degli AGA nei bambini di età < 2 anni.
Se la sierologia è negativa, si esclude diagnosi di celiachia almeno al momento (è noto infatti
che la malattia celiaca può manifestarsi in qualsiasi momento della vita a seguito di eventi
scatenanti, per cui ogni situazione anticorpale è in pratica solo la fotografia del momento).
Se la sierologia è positiva, si procede alla biopsia duodenale:
1) in caso di istologia positiva (lesione tipo 3a-3c) diagnosi di celiachia;
2) in caso di istologia negativa o con lesioni minime (tipo 1-2), determinazione HLA:
a) se DQ2 o DQ8 sono positivi, monitoraggio e ripetizione biopsia;
b) se DQ2 o DQ8 sono negativi, anti-tTG da considerarsi verosimilmente falsi positivi .
Fig.3. Familiari di 1° grado
ALGORITMO PER LA DIAGNOSI DI CELIACHIA
FAMILIARI DI 1° GRADO
IgA sieriche + anti tTG*
IgG anti tTG
(se deficit di IgA)
IgA anti tTG
(se IgA normali)
Sierologia negativa
Sierologia positiva
Determinazione HLA DQ2 DQ8
Biopsia duodenale
Se pos., predisposizione
a celiachia
Monitoraggio con anti tTG
Se negativi,
diagnosi di celiachia
esclusa
Istologia positiva
(tipo 3a-3c)
Istologia negativa
o tipo 1-2
CELIACHIA
Determinazione HLA DQ2 DQ8
Se positivi e isto normale,
monitoraggio
Se positivi e tipo 1-2
valutare caso per caso
Se negativi, anti tTG
falsi positivi^
Controllo anti tTG
*Nei soggetti di età < 2 anni ricerca di AGA oltre ad anti tTG ^rari casi di celiachia non DQ2, DQ8 positivi Figura 3
Nei familiari di 1° grado si esegue la ricerca degli anti tTG IgA (se non deficit IgA) o IgG (se
deficit IgA), associata alla ricerca degli AGA nei bambini di età < 2 anni.
Se la sierologia è negativa, dato che i familiari di 1° grado hanno una elevata predisposizione
alla malattia, è consigliabile eseguire la ricerca degli HLA:
1) in caso di aplotipo compatibile (DQ2 o DQ8), è opportuno programmare nel tempo
controlli degli anti tTG;
2) in caso di aplotipo non compatibile (assenza di DQ2 e DQ8), basso rischio di malattia e
non indicazione a monitoraggio anticorpale.
Se la sierologia è positiva, si procede alla biopsia duodenale:
1) in caso di istologia positiva (lesione tipo 3a-3c) diagnosi di celiachia;
2) in caso di istologia negativa o con lesioni minime (tipo 1-2), determinazione HLA:
a) se DQ2 o DQ8 sono positivi con istologia normale, monitoraggio e ripetizione
biopsia; se DQ2 o DQ8 sono positivi con lesione istologica tipo 1-2, decidere caso per
caso, in base al quadro clinico ed ai sintomi, se iniziare dieta aglutinata o se effettuare
semplice monitoraggio;
b) se DQ2 e DQ8 negativi, anti tTG da considerarsi verosimilmente falsi positivi ed
eventualmente da controllare a distanza.Commento conclusivo applicabile a tutti e tre i
livelli del protocollo diagnostico
Quando ci si trova di fronte a casi particolari con discordanza fra istologia e sierologia
sarebbe opportuno sottoporli all’attenzione dei Centri di alta specializzazione con
particolare esperienza nella diagnosi di celiachia.
Allegato al protocollo per la diagnosi
Come risulta dal protocollo sopraesposto, l’iter diagnostico corretto per giungere alla diagnosi di
malattia celiaca prevede sempre, ove possibile, l’esecuzione della biopsia intestinale e delle indagini
sierologiche. Esistono alcune condizioni particolari in cui non è possibile sottoporre il paziente ad
indagini invasive, ragion per cui non si riesce ad effettuare la biopsia intestinale. Un esempio di tale
evenienza è rappresentato da Pazienti con severa malnutrizione, con severi deficit coagulativi, con
grave cardiopatia o insufficienza respiratoria in ossigenoterapia continua, con morbo di Parkinson o
altra patologia neurologica fortemente invalidante, con sindrome di Down (che di per sé non
rappresenta una controindicazione, ma che in alcuni casi porta ad un rifiuto dei familiari
all’esecuzione di indagini invasive), o da donne in stato di gravidanza (in cui peraltro l’iter
diagnostico può essere completato dopo il parto con un challenge con glutine seguito
dall’accertamento bioptico) o da altre situazioni cliniche che vanno valutate caso per caso. In queste
circostanze si può giungere ad una diagnosi di malattia celiaca solo sulla base dei criteri sierologici
e clinici, ma la diagnosi dovrebbe essere sempre validata da un Centro di Riferimento accreditato
dal Ministero della Salute o dalle Regioni sulla base di una documentata esperienza nel settore.
Protocollo per il Follow-up
Attualmente non esistono regole ben definite per il monitoraggio della celiachia. Alcuni centri
eseguono controlli molto ravvicinati (anche ogni 3-6 mesi) che talvolta creano disagio e problemi
psicologici ai pazienti ed alle loro famiglie, altri non effettuano alcun follow-up. L’indicazione ad
eseguire periodici controlli nei pazienti celiaci viene dalla letteratura che sottolinea la possibilità di
insorgenza di patologie associate e di complicanze neoplastiche e non, soprattutto nei soggetti che
non rispettano correttamente la dieta o sono stati diagnosticati in età avanzata (1).
Scopi principali del follow-up, riassunti nella tabella 6,
Tabella 6
Indicazioni al follow-up
•
•
•
•
verifica della compliance alla dieta
sviluppo di patologia autoimmune associata nonostante la
dieta aglutinata (per es. tiroidite autoimmune)
alterazioni metaboliche
(dislipidemia, steatoepatite non
alcoolica)
possibile sviluppo di complicanze neoplastiche (linfoma) e
non- (malattia celiaca refrattaria, digiunoileite ulcerativa,
sprue collagenosica) in particolare nei casi diagnosticati in
età avanzata
Scopi principali del follow-up, riassunti nella tabella 6, sono:
a) la verifica di una stretta aderenza alla dieta aglutinata, che tenga conto anche delle introduzioni
involontarie di glutine per scarsa od errata informazione del paziente sulle misure dietetiche;
b) l’identificazione di patologie autoimmuni associate, in modo particolare la tiroidite autoimmune
di Hashimoto sia in forma clinica che subclinica (con positività isolata per anticorpi antitiroidei,
presenti fino al 25% dei celiaci);
c) lo sviluppo di alterazioni metaboliche (dislipidemia, iperglicemia, steatoepatite non alcoolica),
in particolare nei soggetti che aumentano significativamente di peso con la dieta senza glutine
sia in relazione al miglioramento della funzione assorbente intestinale che al ricco contenuto
lipidico dei prodotti dietoterapeutici
d) la diagnosi precoce dell’insorgenza di complicanze neoplastiche (linfoma, carcinomi
gastrointestinali, etc.) e non- (malattia celiaca refrattaria, digiunoileite ulcerativa, sprue
collagenosica), in particolare negli adulti diagnosticati dopo i 50 anni con ricaduta positiva sulle
prospettive prognostiche grazie ad un rapido trattamento chirurgico e di terapia medica.
Controlli raccomandati in tutti i celiaci (tabella 7)
Tabella 7
Follow-up della malattia celiaca
Si suggerisce di eseguire un primo controllo a 6 mesi dalla
diagnosi e i successivisi ogni 1-2 anni mediante:
•Visita medica con intervista dietetica c/o centro specialistico
•Esami bioumorali
- assorbimento
ferritina, emocromo
• marker immunologici e di autoimmunità
tTGA IgA (di classe IgG se vi è deficit di IgA)
TSH, anti-TPO, anti-TG (non nel primo controllo)
Motivazione: valutazione della funzione assorbente intestinale, della compliance alla
dieta aglutinata e dello sviluppo della più frequente complicanza autoimmune correlata
(tiroidite autoimmune)
Per quanto riguarda il timing del monitoraggio si suggerisce di eseguire un primo controllo a 6
mesi dalla diagnosi e successivamente ogni 1-2 anni presso un centro specialistico per malattia.
In tale occasione tutti i celiaci dovranno sottoporsi a visita medica con un’accurata intervista
dietetica ed ad esami bioumorali (emocromo e ferritina). Per il monitoraggio anticorpale della
compliance alla dieta aglutinata si consiglia la determinazione degli anticorpi anti
transglutaminasi tissutale umana di classe IgA (di classe IgG nei soggetti con deficit selettivo di
IgA), mentre per verificare lo sviluppo di distiroidismo la determinazione del TSH e degli
anticorpi anti tiroidei (anti perossidasi ed anti tireoglobulina) (da non eseguirsi nel primo
controllo a 6 mesi dalla diagnosi).
Esami da eseguirsi in casi selezionati (Tabella 8)
Tabella 8
Follow-up della malattia celiaca
Esami bioumorali utili in casi selezionati
-metabolici
colesterolo, HDL, trigliceridi, glicemia, transaminasi
-immunologici
autoanticorpi organo e non organo specifici
Motivazione: valutazione dello stato metabolico (in relazione al possibile aumento
ponderale favorito dalla ripresa dell’assorbimento e dalla dieta aglutinata, sbilanciata in
senso iperlipidico) e del possibile sviluppo di complicanze autoimmuni tanto più elevato
quanto maggiore il numero di anni trascorsi dal celiaco a dieta libera
Nei soggetti che alla visita medica programmata presentano un marcato aumento ponderale è
indicata la determinazione di esami bioumorali nell’ambito metabolico (colesterolo, HDL,
trigliceridi, glicemia). Si suggerisce di eseguire anche la determinazione delle transaminasi in
quanto il celiaco a dieta aglutinata può sviluppare una steatoepatite non alcoolica. Le cause di
tali alterazioni vanno soprattutto ricercate, come già detto nella migliorata funzione assorbente
intestinale dopo dieta e nella stessa dieta aglutinata, sbilanciata in senso iperlipidico.
Inoltre, nei casi in cui è già stata accertata alla diagnosi o si sospetta l’insorgenza di patologia
autoimmune associata alla celiachia è opportuna la ricerca degli autoanticorpi organo e non
organo specifici (ICA, GAD, anti surrene, anti cellule parietali gastriche, autoanticorpi non
organo specifici, ANA, ENA, etc..). E’ noto che il rischio di patologia autoimmune associata
aumenta in rapporto al numero di anni trascorsi dal celiaco a dieta libera.
Esami strumentali da eseguirsi in base ad indicazione clinica (Tabella 9)
Tabella 9
Follow-up della malattia celiaca
Esami strumentali
•EGDS con biopsia duodenale
•DENSITOMETRIA OSSEA
(se patologica alla diagnosi da controllare
ogni 12-18 mesi)
•ECOGRAFIA ADDOMINALE E TIROIDEA
(se clinicamente
indicate)
•RxCLISMA TENUE, ENTEROSCOPIA, VIDEOCAPSULA,
HRTC ADDOMINALE (utili negli adulti per la definizione delle complicanze
neoplastiche e non-)
•CONSULENZE SPECIALISTICHE
(solo in caso di sospetto clinico di
patologia associata)
Fra gli esami strumentali del follow-up della celiachia un posto di primo piano spetta alla
biopsia duodenale in corso di EGDS. Pur non essendo più tale esame indispensabile per la
conferma diagnostica dal momento che anche per l’adulto, così come già stabilito da tempo per
il bambino (criteri ESPGHAN 1990), il miglioramento clinico e la negativizzazione degli
anticorpi sono criteri più che sufficienti, l’indicazione al controllo istologico andrà posta in tutti
quei casi in cui rimangono incertezze sulla compliance alla dieta o sulla risposta alla sottrazione
del glutine dalla dieta. Pertanto, il timing e la necessità del controllo bioptico andranno decisi in
funzione del singolo caso, tenendo presente che nel dubbio è sempre meglio procedere a tale
accertamento.
La densitometria ossea, se patologica alla diagnosi, va programmata ogni 12-18 mesi. E’ nota
la maggior rilevanza di tale problema negli adulti, anche se sono riportati casi di severa
osteopenia ed osteoporosi anche in età pediatrica, ove in genere la dieta aglutinata porta a
significativi miglioramenti entro il primo anno di esclusione del glutine dalla dieta.
L’ecografia addominale e tiroidea andranno eseguite solo se clinicamente opportuno, così
come, limitatamente agli adulti, sono indicate, in caso di sospetta complicanza neoplastica (in
particolare linfoma intestinale) o non neoplastica (digiunoileite ulcerativa, sprue collagenosica,
malattia celiaca refrattaria), indagini strumentali “vecchie” e “nuove” fra cui l’ rx clisma del
tenue, l’enteroscopia, la videocapsula, la tomografia assiale computerizzata ad alta risoluzione.
Per quanto riguarda le consulenze specialistiche, non bisogna esitare a ricorrervi se subentrano
problemi clinici rilevanti. Infatti, anche se è ampiamente documentato che oltre l’80% dei
celiaci non presenterà altri problemi al di fuori dell’intolleranza cronica al glutine, i restanti
casi possono lamentare problematiche neurologiche, psichiatriche, reumatologiche,
odontostomatologiche, cardiologiche ed immunologiche, che andranno inquadrate con le
relative consulenze da parti di esperti di questi settori.
I criteri che hanno ispirato il protocollo per il follow-up sono stati la semplicità e l’inclusione degli
esami strettamente necessari al fine di contenere anche la spesa sanitaria, senza peraltro venire
meno alla esigenza di un attento monitoraggio della celiachia.
In conclusione, questo protocollo ribadisce la necessità di eseguire un follow-up della malattia
celiaca, suggerendone la tempistica e le modalità e fornendo ai celiaci quelle indicazioni da tempo
richieste al fine di poter affrontare con maggiore serenità il dopo diagnosi.
E’ inteso che gli esami contenuti nel suddetto protocollo, sia quelli consigliati per tutti i celiaci, sia
quelli da eseguirsi in casi selezionati e su indicazione clinica, dovranno essere esenti dal pagamento
del ticket.
Bibliografia
1) Trier JS. Celiac sprue. N Eng J Med 1991; 325:1709-1718
2) Catassi C, Ratsch IM, Fabiani E, et al. High prevalence of undiagnosed coeliac disease in
5280 Italian students screened by antigliadin antibodies. . Acta Paediatr 1995; 84:672-676
3) Volta U, Bellentani S, Bianchi FB, et al. High prevalence of celiac disease in Italian general
population. Dig Dis Sci 2001; 46:1500-1505
4) Oberhuber G, Granditsch G, Vogelsang H. The histopathology of coeliac disease: time for a
standardized report schemefor pathologists Eur J Gastroenterol Hepatol 1999; 11:1185-1194
5) Chiarelli S, Villanacci V. Celiachia: requisiti minimi per la diagnosi istopatologica.
Pathologica 1998; 90:809-813
6) Karell K, Louka AS, Moodie SJ, et al. HLA types in celiac disease patients not carrying the
DQA1*05-DQB1*02 (DQ2) heterodimer: results from the European genetics cluster on
celiac disease. Hum Immunol 2003; 64:469-477