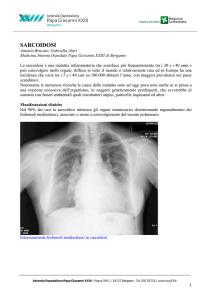
Sarcoidosi
Definizione
La sarcoidosi è una malattia multisistemica ad eziologia sconosciuta caratterizzata dalla presenza
di granulomi tipici non caseosi negli organi colpiti, secondari ad un’alterata risposta immunitaria
cellulo-mediata.
Cenni storici
1877 Hutchinson descrive le lesioni cutanee tipiche
1889 Bernier le definisce come “lupus pernio”
1899 Boeck utilizza il termine “sarcoide benigno”
1914 Shaumman sostiene che “lupus pernio” e sarcoidi benigni sono
manifestazioni della stessa malattia
1946 Löfgren descrive il quadro di esordio della malattia con:
eritema nodoso, adenopatia ilare bilaterale, febbre e poliartrite
1951 I corticosteroidi vengono usati con successo nel trattamento
della sarcoidosi
1958 Wurm propone la stadiazione radiologica
1961 Siltzbach perfeziona il test di Kveim utilizzando tessuto
splenico (test di Kveim-Siltzbach)
1970 si diffonde l’uso del BAL e della scintigrafia con Gallio-67 per
valutare l’attività della malattia
Epidemiologia
Prevalenza:
10-40/100000 abitanti in Nord America. Europa e
Giappone
64/100000 in Svezia
Negli USA prevalenza 10-17 volte maggiore negli Afro-americani rispetto ai Caucasoamericani.
Insorgenza nell’80% dei casi tra i 20 e i 45 anni
Etiologia
L’agente etiologico è sconosciuto. Sono comunque state formulate diverse ipotesi sull’eziologia
della sarcoidosi.
1) Ipotesi ambientale
2) Ipotesi immunologica
3) Ipotesi genetica
4) Ipotesi infettiva
Ipotesi ambientale
Pollini, polveri ed altre sostanze sono state chiamate in causa come responsabili.
PRO
- Maggiore incidenza nei mesi invernali-primaverili
- Maggiore prevalenza in regioni geografiche con caratteristiche ambientali specifiche (polline
di pino)
- Sarcoidosi più frequente in alcune categorie prefessionali
CONTRO
- Nessun agente organico e/o inorganico è stato costantemente identificato all’interno del
tessuto sarcoideo
- Nessuno studio su modelli animali ha provato questa ipotesi
- Nessuno studio clinico-epidemiologico ha fornito evidenze in tal senso
Ipotesi immunologia
Nella sarcoidosi nella sede delle lesioni è presente un accumulo di cellule immunocompetenti
che presentano importanti alterazioni immunologiche.
-Accumulo di macrofagi attivati, esprimono markers di attivazione (HLA-DR, HLA-DQ) e
molecole di adesione (CD54,CD49)
-aumentato rilascio di citochine macrofagiche (IL-1, IL-6, IL-8, TNF-α, TNF-γ, GM-CSF) e
chemochine (IP-10, RANTES, MIP-1)
-aumentata produzione macrofagica di citochine ad azione fibrogenica (TGF-β, PDGF, IGF)
-Accumulo interstiziale ed intraalveolare di cellule CD4+ attivate, rilascio di IL-2
-Aumento produzione citochine Th1 (IL-2 e IFN-γ)
-Aumentata espressione sulle cellule T di recettori per il TNF
-Aumento proliferazione cellule immunocompetenti
-Linfociti B attivati
PRO
- Il granuloma potrebbe formarsi in risposta alla presenza di complessi antigene-anticorpo
(spesso presenti nei pazienti con sarcoidosi)
- Diversi agenti (es. virus) potrebbero innescare una risposta immune cronica in individui
predisposti
CONTRO
- Le anomalie immunologiche non avrebbero rilievo eziologico, ma rappresenterebbero un
epifenomeno della risposta immune nel corso della malattia
- Non esistono evidenze per una eziologia autoimmune, né il paziente con sarcoidosi può essere
considerato immunocompromesso
Ipotesi genetica
Le differenze razziali nella prevalenza della sarcoidosi suggeriscono una predisposizione
genetica.
- Sono stati descritti casi di familiarità
- Aplotipo HLA B8 frequente eritema nodoso
prognosi favorevole
- Aplotipo HLA B27 frequente uveite
- Aplotipo HLA B13 frequente cronicizzazione
Allo stato attuale non si conosce un chiaro pattern genetico per la sarcoidosi che è probabilmente
una malattia associata comunque a fattori ambientali.
Ipotesi infettiva
PRO
- Insorgenza della malattia in trapiantati che hanno ricevuto organi da soggetti con sarcoidosi
- Induzione di granulomi sarcoidei in animali da esperimento dopo inoculazione di tessuto
sarcoideo
- Il “T Cell Receptor” (TCR) dei linfociti del granuloma sarcoideo è molto specifico, suggerendo
una proliferazione di cloni di linfociti T specifici
CONTRO
- Nessuna chiara evidenza sperimentale di un agente infettivo responsabile.
Numerosi microrganismi sono stati di volta in volta ritenuti responsabili:
Virus: Epstein-Barr, Herpes virus, Coxsakie, ecc…
Batteri: Borrelia burgdorferi, Mycoplasma, Micobatteri
Sarcoidosi e Micobatteri
- Anticorpi anti micobatteri nel siero di pazienti con sarcoidosi (50-80% dei casi)
- Presenza di componenti della parete dei micobatteri (acido tubercolostearico) nei noduli
sarcoidei
- Aumento linfociti / circolanti in alcuni pazienti con sarcoidosi
- rilievo, in alcuni pazienti con sarcoidosi, di DNA micobatterico rilevato con PCR (Polymerase
chain reaction)
Patogenesi
Stimolazione antigenica
Attivazione cellule immuno-competenti polmonari
Rilascio di citochine
Alveolite
Formazione del granuloma
Danno polmonare
Fibrosi
Anatomia patologica
La lesione patognomica è il granuloma sarcoideo, costituito da una zona centrale (core) ricca di
macrofagi, cellule epitelioidi e cellule giganti multinucleate, e da un mantello di linfociti,
monociti e fibroblasti.
Cellule epitelioidi: derivano dal sistema fagocitico-macrofagico e probabilmente sono le
progenitrici della cellule giganti.
Cellule giganti: possono contenere inclusioni citolasmatiche comunque non specifiche.
Linfociti T: rapporto CD4/CD8 3-20:1 nella regione centrale, si abbassa verso la periferia.
Monociti: provengono dalla circolazione periferica. Sono i precursori dei macrofagi, delle cellule
epitelioidi e delle cellule giganti.
Fibroblasti.
Diagnosi
La diagnosi di sarcoidosi si basa su:
1) Quadro clinico-radiologico-funzionale compatibile
2) Dimostrazione istologica di granuloma non caseoso
3) Esclusione di altre malattie capaci di produrre quadri clinico-istologici simili (TBC, linfoma,
reazioni a farmaci, reazioni locali simil-sarcoidee).
Iter diagnostico
1) Anamnesi
2) Esame obiettivo
3) Rx torace
4) Test di funzionalità polmonare
5) Biopsia
6) Analisi di laboratorio di routine + calcio
7) Lavaggio bronco-alveolare
8) Tubercolina
9) Test per individuare localizzazioni extrapolmonari (visita oculistica, ecoepatica, ECG, etc.)
Quadro clinico
1)Sintomi aspecifici (33%)
Febbre, affaticamento, perdita di peso, sudorazione notturna
2) Manifestazioni polmonari (90%)
Frequenti: tosse secca, dispnea, dolore toracico, rantoli crepitanti
Rare: versamento pleurico, ippocratismo digitale
3) Manifestazioni sistema linfatico (33%)
Frequenti: ingrandimento linfonodi periferici (cervicali, ascellari, inguinali)
Rare: splenomegalia
4) Manifestazioni cutanee (25%)
Frequenti: eritema nodoso, lupus pernio
Rare: eruzioni maculo-papulari, alopecia
5) Manifestazioni oculari (11-83%)
Frequenti: uveite
Rare: cataratta, tumefazione ghiandole lacrimali
6) Manifestazioni epatiche (50-80%)
Frequenti: ridotta funzione epatica, epatomegalia
Rare: ipertensione portale
7) Manifestazioni sistema muscolo-scheletrico (25-39%)
Frequenti: dolori articolari
Rare: miopatia cronica, artrite deformante, cisti ossee
8) Manifestazioni sistema emopoietico (40%)
Frequenti: moderata leucopenia (riduzione CD4+)
Rare: anemia, trombocitopenia
9) Manifestazioni sistema endocrino (10-30%)
Frequenti: ipercalciuria
Rare: ipercalcemia, iper- o ipotiroidismo
10) Manifestazioni cardiache (5%)
Tachicardia ventricolare, blocchi di branca, battiti ectopici
Altri organi o apparati interessati
- Ghiandola parotide (6%)
- Apparato gastroenterico (1%)
- Sistema riproduttivo
- Rene
Diagnosi radiologica
Stadio 0: Rx del torace normale (5-10%)
Stadio I: adenopatia ilare bilaterale (40 %)
Diagnosi differenziale con:- TBC
- linfoma
- leucemia
- berilliosi
Stadio II:adenopatia ilare bilaterale + infiltrati polmonari (30-50%)
Stadio III: infiltrati polmonari senza adenopatia (15%)
Diagnosi differenziale stadi II e III con:
- ipersensibilità
- carcinomatosi
- pneumoconiosi
- TBC miliare
Stadio IV: fibrosi polmonare
HCRT (TAC a strato sottile 1-3 mm): migliore sensibilità per lesioni linfonodali e parenchimali,
utile nell’individuare complicanze (cisti, bronchiectasie…)
Diagnosi: test di funzionalità polmonare
Stadio I alterazioni nel 20% dei casi
Stadio II, III, IV alterazioni nel 40-70% dei casi
Parametri funzionali più comunemente alterati: - DLCO
- CVF
difetto restrittivo-ostruttivo - FEV1
In pazienti con FEV1 e DLCO normali il test da sforzo può mettere in evidenza un’iniziale
alterazione emogasanalitica.
Anche i test di funzionalità polmonare sono utili nel monitoraggio della malattia.
Diagnosi: lavaggio broncoalveolare
- Aumento assoluto e percentuale dei linfociti >15%
- Il 90% dei linfociti T sono attivati (CD25+)
- Rapporto CD4/CD8 >3,5 specificità 94%
CD4/CD8 >1 esclude sarcoidosi
Nel fluido di lavaggio:
immunoglobuline
ACE
procollagene III
acido ialuronico
Diagnosi
- Scintigrafia con gallio 67
- Test di Kveim.Siltzbach
- Anergia cutanea alla tubercolina
- Livelli sierici “Angiotensin Converting Enzyme” (ACE)
- Livelli neopterina
- Lisozima
- β2-microglobulina
- Recettore solubile IL-2
- Fibronectina
- Biopsia cute e linfonodi
- Biopsia transbronchiale: diagnostica nel 40-90% dei
casi
- Mediastinoscopia o “opening biopsy”
Terapia
Terapia corticosteroidea
Remissione
Controlli periodici ogni
3-6 mesi per 3 anni
La malattia persiste
terapia cronica (5-10mg/die)
farmaci immunosoppressori
Pazienti asintomatici non trattati
Controlli periodici ogni 3-6-mesi per due anni
Remissione spontanea
aggravamento
terapia corticosteroidea
- Pazienti stadio I e II asintomatici non richiedono terapia
- Pazienti con manifestazioni extrapolmonari di grado lieve
manifestazioni cutanee, uveitre ant.) steroidi topici
- Manifestazioni extrapolmonari corticosteroidi
- Ipercalcemia corticosteroidi
Nei pazienti in cui la terapia corticosteroidea non è efficace o in cui induce severi effetti
collaterali è possibile usare farmaci immunosoppressori:
- Metotrexate 10-25 mg/settimana
- Azatioprina 50-200 mg/die
- Ciclofosfamide 50-150 mg/die
- Farmaci antimalarici (clorochina, idrossiclorochina)
(lesioni cutanee e ipercalcemia)
- FANS (sintomi muscolo-scheletrici, eritema nodoso)
- Ketoconazolo (ipecalcemia)
- Ciclosporina (neurosarcoidosi)
- Pentossifillina
- Anticorpi anti-TNF-
- Antagonisti recettori TNF-
- Chelanti del calcio (sodium cellulose phosphate)
- Interessamento polmonare di grado lieve-moderato 20-40
mg/die di predmisone
- Interessamento polmonare di grado severo e/o coinvolgimento
extrapolmonare 60 mg/die di predmisone
Dosaggio iniziale per 3-4 mesi
Valutare la risposta del paziente
Riduzione del dosaggio in 4-6 mesi fino a 15 mg/die
Mantenere dosaggio minimo per 4 mesi
Durata totale terapia 12-18 mesi
Monitoraggio paziente
Prognosi
- Remissione spontanea 2/3 dei casi
- Cronicizzazione 1/3 dei casi (4-7% con coinvolgimento
extrapolmonare severo)
Spontanea ricaduta 2-8%
Remissione
Dopo terapia ricaduta 16-74%
Prognosi sulla base del quadro radiologico
Stadio I: miglioramento o remissione 55-90%
Stadio II: miglioramento o remissione 30-60%
Stadio III: miglioramento o remissione 10-20%
Stadio IV: miglioramento o remissione 10-20%
Criteri di selezione per il trapianto polmonare
Indicazioni: - I.R.C
- decadimento qualità di vita
- forte motivazione
Controindicazioni: - instabilità psico-sociale
- infezione da micobatteri o micosi
- grave danno ad altri organi
- malnutrizione
Fattori di rischio: - pleurodesi-lobectomie
- ventilazione meccanica
- insufficienza epatica
- diabete
- infezione da Burkholderia cepacia