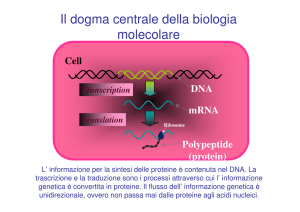
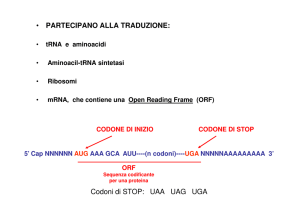
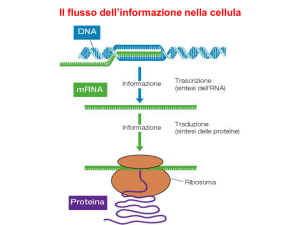
La sintesi proteica
Amminoacido
Sito di legame
dell’amminoacido
Adattatore
Tripletta di nucleotidi
che codifica
un dato amminoacido
Inserzione
Delezione
Inserzione
e delezione
Cornice di
lettura
ripristinata
Codice
non sovrapposto
Codice
sovrapposto
Il codice genetico
Seconda lettera del codone
Prima lettera
del codone
(in direzione 5’)
mRNA
modificato
Modificazione del trascritto di RNA corrispondente al gene per la subunità II della
citocromo ossidasi da parte dei mitocondri di Trypanosoma brucei.
L’inserzione di quattro residui di uridina produce un diverso quadro di lettura.
RNA guida
Probabilmente nei mitocondri di Trypanosoma brucei esiste un particolare tipo di
RNA guida complementare all’RNA modificato che agisce da stampo durante il
processo.
Un processo di deamminazione provoca la trasformazione di un codone.
Il codice genetico è degenerato
Appaiamento di codoni e
anticodoni.
L’allineamento dei due RNA è di
tipo antiparallelo
Appaiamento del codone nel caso che l’anticodone contenga l’inositato
come prima base
Alcuni tRNA contengono in prima posizione il nucleotide inositato (I), che
contiene l’inconsueta base ipoxantina. L’inositato può formare legami idrogeno
con tre diversi nucleotidi U, C e A.
Lo stesso tRNA può riconoscere vari codoni; il numero di tRNA per ciascun
amminoacido non è pertanto necessariamente uguale al numero dei suoi codoni.
Le molecole di tRNA
La molecola di tRNA serve come un adattatore che si lega a ciascun codon e
che trasporta con sé l’amminoacido destinato a essere inserito nella catena
proteica.
tRNA dell’alanina (tRNAAla) di lievito
Sito di attacco
per l’amminoacido
= basi modificate
Ψ = pseudouridina
I = Inosina
T = ribotimidina
D = 5,6-diidrouridina
m1I = 1-metilinosina
m1G = 1-metilguanosina
Tripletta
dell’anticodone
m2G = N2-dimetilguanosina
Le molecole di tRNA hanno una struttura simile
Tutte le molecole di tRNA hanno le seguenti caratteristiche:
Sono costituite da una catena singola e contengono da 73 a 93 ribonucleotidi
Contengono molte basi insolite, in genere da 7 a 15 per molecola. Alcune sono
derivati metilati o demetilati di A, U, C e G, formati da modificazioni
enzimatiche di un tRNA precursore
Circa la metà dei ribonucleotidi sono appaiati tra loro, formando tratti a doppia
elica.
Cinque gruppi di basi non sono appaiati:
1. la regione CCA all’estremità 3’, che fa parte dello stelo accettore;
2. l’ansa TΨC, che prende il nome dalla sequenza ribotimina- pseudouracilecitosina;
3. il “braccio extra” o variabile, che contiene un numero variabile di residui;
4. l’ansa DHU, che contiene numerosi residui di diidrouracile
5. l’ansa dell’anticodon
Le molecole di tRNA hanno una struttura simile
L’estremità 5’ di ogni tRNA è fosforilata; il residuo terminale 5’ è di solito pG
L’amminoacido attivato è legato a un gruppo ossidrilico del residuo di adenosina
che si trova all’estremità 3’ della sequenza terminale CCA dello stelo accettore
L’anticodon si trova in un ansa che si trova in corrispondenza della parte
centrale della sequenza
Struttura generale secondaria a trifoglio di tutti i tRNA
Ansa
dell’amminoacido
Ansa
Ansa D
Ansa extra
con dimensione
variabile,
e presente solo
in alcuni tRNA
Contiene due
tre residui D
in posizioni
differenti
Ansa
dell’anticodone
Posizione
oscillante
Anticodone
Struttura a L del tRNA
Nel 1974 è stata determinata la prima struttura tridimensionale di un tRNA
(Phe-tRNA) (Rich e Klug)
La molecola ha una forma a L
Struttura a L del tRNA
La molecola ha una forma a L
Vi sono due tratti apparentemente
continui a doppia elica (simile al DNA in
forma A).
L’elica contenente le estremità 5’ e 3’
forma insieme all’elica che termina con
l’ansa TΨC il braccio orizzontale della
struttura a L
La maggior parte delle basi delle regioni non
elicoidali formano egualmente legami idrogeno
con appaiamenti diversi da quelli del modello di
Watson e Crick
La regione CCA con il sito di legame dell’amminoacido si trova a un’estremità
della struttura a L
L’ansa dell’anticodone si trova all’estremità opposta della L
Ansa
Ansa
dell’amminoacido
Ansa D
(10-25 residui)
Ansa
dell’anticodone
Anticodone
La struttura dei tRNA è perfettamente
adatta al suo ruolo:
1.
2.
l’anticodon
è
disponibile
per
interagire con il codon appropriato
sull’mRNA;
l’estremità legata all’amminoacido
attivato è in posizione adatta per
formare il legame peptidico
Le amminoacil-tRNA sintetasi leggono il codice genetico
Il legame di un amminoacido e un tRNA è fondamentale:
L’attacco di un dato amminoacido a uno specifico tRNA determina il codice
genetico
La formazione di un legame peptidico tra amminoacidi liberi non è una reazione
termodinamicamente favorita. E’ necessario che l’amminoacido sia attivato
prima di essere legato in una catena polipeptidica.
Nella sintesi proteica gli intermedi attivati sono esteri degli amminoacidi, nei
quali il loro gruppo carbossilico è legato al gruppo -OH 2’ o 3’ dell’unità di
ribosio che si trova all’estremità 3’ del tRNA (amminoacil-tRNA)
Nella prima fase della sintesi proteica i 20 amminoacidi vengono legati mediante
legame estere al loro tRNA ad opera di amminoacil-tRNA sintetasi.
Generalmente esiste un’amminoacil-tRNA sintetasi per ciascun amminoacido.
Per amminoacidi che hanno due o più tRNA corrispondenti, di solito la stessa
amminoacil-tRNA sintetasi provvede alla amminoacilazione di tutti.
Gli amminoacidi sono inizialmente attivati mediante adenilazione
La prima tappa nella formazione di un amminoacil-tRNA è la formazione di un
amminoacil adenilato a partire da un amminoacido e ATP.
L’intermedio amminoacido-AMP non si
dissocia dall’enzima
La tappa successiva è il trasferimento dell’amminoacido a una particolare
molecola di tRNA:
Amminoacil-AMP + tRNA ' amminoacil-tRNA + AMP
La reazione complessiva catalizzata da un’amminoacil-tRNA sintetasi è la
seguente:
Mg2+
Amminoacido + tRNA + ATP
amminoacil-tRNA + AMP + PPi
2Pi
Le amminoacil-tRNA sintetasi hanno siti di attivazione degli amminoacidi
altamente specifici
Una sintetasi aggiunge a un tRNA un amminoacido sbagliato una volta su 104 o
105 reazioni catalitiche.
Ogni sintetasi riconosce specificamente le proprietà dell’amminoacido che funge
da suo substrato
La treonil-tRNA sintetasi ha uno
ione zinco che si coordina alla
treonina tramite il suo gruppo
amminico e il suo gruppo
ossidrilico
La correzione di bozze da parte delle amminoacil-tRNA sintetasi aumenta la
fedeltà della sintesi proteica
Studi strutturali e di mutagenesi hanno
dimostrato che molte sintetasi hanno un
sito di correzione di bozze situato ad
una distanza di circa 20 Å dal sito di
attivazione
In genere il sito del legame acilico
respinge gli amminoacidi più grandi di
quelli
corretti
(non
ha
spazio
sufficiente), il sito di idrolisi scinde le
specie attivate più piccole di quelle
corrette.
La correzione di bozze da parte delle amminoacil-tRNA sintetasi
Il braccio flessibile CCA di un amminoacil tRNA può spostare
l’amminoacido tra il sito di attivazione e il sito di correzione di bozze
Alcune amminoacil-tRNA sintetasi possiedono attività proofreading
Nel caso della Ile-tRNA sintetasi è stato dimostrato che l’enzima presenta un
secondo sito attivo (sito di proofreading) che catalizza la deacilazione degli
amminoacil-AMP sbagliati.
Alcune amminoacil-tRNA sintetasi, che attivano amminoacidi che non
possiedono strette affinità strutturali con altri, sono prive di attività
proofreading.
In che modo le sintetasi riconoscono e scelgono i tRNA?
Questo riconoscimento è responsabile effettivamente della “traduzione”, cioè
della correlazione tra amminoacidi e acidi nucleici
Le sintetasi sono le molecole biologiche che “conoscono” il codice genetico
Le sintetasi riconoscono le anse dell’anticodon e gli steli accettori delle
molecole di tRNA
Poiché ciascun tRNA ha un anticodon diverso, molte sintetasi riconoscono i
rispettivi tRNA soprattutto in base all’anticodon, anche se possono
riconoscere altri aspetti della struttura del tRNA.
Complesso della treonil-tRNA sintetasi
La sintetasi è legata sia allo stelo
accettore sia all’ansa dell’anticodon
Alcune sintetasi riconoscono oltre alle anse dell’anticodon e gli steli accettori
altre regioni delle molecole di tRNA
Complesso della glutammil-tRNA
sintetasi
La sintetasi interagisce non solo con lo
stelo accettore e l’ansa dell’anticodon,
ma anche con la coppia di basi G10:C25
Per alcune sintetasi la formazione specifica di un legame amminoacilico è
possibile anche se manca completamente l’ansa dell’anticodon
Microelica riconosciuta dall’alanil-tRNA
sintetasi
L’alanil-tRNA sintetasi riconosce una
piccola ansa contenente solo 24
nucleotidi, corrispondente allo stelo
accettore
Nucleotidi
mancanti
Gli elementi strutturali del tRNAla riconosciuti dalla Ala-tRNA sintetasi sono insolitamente
semplici
Posizioni del tRNA riconosciute dall’amminoacil-tRNA sintetasi
Ansa
dell’amminoacido
Ansa
Ansa D
Ansa extra
= posizioni uguali in tutti i tRNA
= punti di riconoscimento di
una amminoacil tRNA sintetasi
Ansa
dell’anticodone
= punti di riconoscimento di
più amminoacil tRNA sintetasi
Anticodone
Le amminoacil-tRNA sintetasi sono state divise in due classi in base alle
differenze nella struttura primaria e terziaria e nel meccanismo di azione.
Gli enzimi di classe I formano un legame acilico con il gruppo ossidrilico in
posizione 2’ dell’adenosina terminale del tRNA
Gli enzimi di classe II (eccetto quello per la Phe-tRNA) formano un legame
acilico con il gruppo ossidrilico in posizione 3’.
Le due classi legano l’ATP in conformazioni diverse
Quasi tutti gli enzimi di classe I sono monomerici, mentre quasi tutti quelli di
classe II sono dimerici o multimerici.
Le amminoacil-tRNA sintetasi attaccano il corretto amminoacido ai tRNA
Classe I
Classe II
Gln-tRNA sintetasi di E. coli (enzima monomerico di tipo I)
Asp-tRNA sintetasi di lievito (enzima dimerico di tipo II)
Struttura generale degli amminoacil-tRNA
Ciascuno degli RNA ribosomiali a
singola elica possiede una specifica
conformazione tridimensionale
conferita da appaiamenti delle
basi.
Gli RNA ribosomiali hanno un ruolo centrale nella sintesi proteica
Gli RNA ribosomiali sono ripiegati
in strutture precise, con numerosi
brevi tratti a doppia elica.
Per molti anni si è ritenuto che la
sintesi proteica fosse organizzata e
diretta dalle proteine.
L’opinione attuale è invece opposta.
I siti attivi del ribosoma sono
composti quasi interamente da RNA
16S
Il ribosoma ad alta risoluzione
= RNA 23S
= RNA 5S
= RNA 16S
= proteine della subunità 50S
= proteine della subunità 30S
Struttura del ribosoma batterico
La sintesi proteica inizia all’estremità ammino-terminale e procede verso
l’estremità carbossi-terminale
= residui di leucina radioattivi
Catena α dell’emoglobina
Il codone di inizio AUG specifica
un residuo di metionina amminoterminale
Nei
batteri
il
residuo
amminoacidico di avvio è la NFormilmetionina, che penetra nel
ribosoma associata ad uno
specifico
tRNA
(NFormilmetionina - tRNAfMet).
Formilmetionina
Negli eucarioti tutti i polipeptidi
iniziano con un residuo di
Metionina (invece che fMet), ma
anche in questo caso viene usato
un tRNA specializzato diverso da
quello usato per l’inserimento
della metionina nelle posizioni
interne.
Formilazione del metionil-tRNA
Il tRNA di inizio è prima
caricato con la metionina, poi
viene trasferito un gruppo
formile sul metionil-tRNA
Sequenza Shine-Dalgarno
La sequenza Shine-Dalgarno viene riconosciuta da una sequenza
complementare ricca di pirimidine vicino all’estremità 3’ del’rRNA
16S della subunità 30S.
Questa interazione mRNA-rRNA immobilizza l’mRNA in modo che
l’AUG sia posizionato sulla subunità 30S per l’inizio della traduzione.
I ribosomi hanno 3 siti di legame per il tRNA, localizzati tra le subunità 30S e 50S
Sito A (amminoacidico); Sito P (peptidico) e Sito E (sito di uscita)
Meccanismo della sintesi proteica
Formazione del legame peptidico
Il gruppo amminico dell’amminoacil-tRNA produce un attacco nucleofilo sul gruppo
carbonilico del legame estere del peptidil-tRNA, formando un intermedio tetraedrico.
Il centro della peptidil transferasi contiene basi che favoriscono la reazione aumentando
la reattività del gruppo NH2 sull’aminoacil-tRNA nel sito A e stabilizzando l’intermedio
tetraedico che si produce
L’intermedio si dissocia, generando il legame peptidico e rilasciando il tRNA privo
dell’amminoacido
“Via di fuga” del polipeptide
La subunità 50S è attraversata da un tunnel che inizia nel sito di formazione del
legame peptidico.
La catena polipeptidica nascente passa attraverso il tunnel
Un possibile ruolo della formilazione
Se il gruppo amminoterminale è libero, il dipeptidil-tRNA può formare un
legame interno, ciclizzandosi e separandosi dal tRNA.
La
formilazione
dell’estremità
amminoterminale
blocca
questa
reazione
L’inserimento di uno specifico amminoacido è determinato
esclusivamente dalle interazioni codon-anticodon
Legando a tRNA amminoacidi non
naturali con metodi chimici è
possibile sintetizzare peptidi nei
quali sono presenti tali residui
E’ inserito in corrispondenza
di un codone per la cisteina
Alcune molecole di tRNA riconoscono più di un codon, a causa dell’oscillazione
nell’appaiamento delle basi
Una certa libertà sterica (“oscillazione”) nell’appaiamento della terza base del
codon permette i seguenti appaiamenti:
Prima base dell’anticodon
Terza base del codon
C
G
A
U
U
AoG
G
UoC
I
U, C o A
Possibili appaiamenti dell’inosina
Interazioni codon anticodon
Le prime due basi di un codon si appaiano in modo standard e il
riconoscimento è preciso. I codoni che differiscono in una o l’altra delle prime
due basi devono essere riconosciuti da diversi tRNA.
La prima base di un anticodon determina se una molecola di tRNA è in grado
di leggere uno o più codon.
A o C viene letto 1 codon
U o G 2 codon
I 3 codon
Nella subunità 30S vi sono 2 adenine (A1492 e A1493) che formano legami
idrogeno sul lato del solco minore della doppia elica codon-anticodon: queste
interazioni servono a controllare se sono presenti appaiamenti Watson e
Crick nelle prime due posizioni. Nella terza posizione non esiste un sistema di
rivelazione simile.
L’inizio della sintesi proteica nei batteri
richiede:
a) La subunità ribosomale 30S
b) l’mRNA
c)
l’fMet-tRNAfMet
d) I fattori d’inizio IF-1, IF-2 e IF-3
e) GTP
f)
La subunità ribosomale 50S
g) Mg2+
Il legame di IF-1 e IF-3 alla subunità 30S
impedisce che quest’ultima si leghi
prematuramente alla subunità 50S.
Il fattore IF-2 lega il formil-metionil-tRNAf e
contribuisce al suo corretto posizionamento
I ribosomi batterici hanno tre siti che legano
gli amminoacil-tRNA: il sito amminoacilico o
sito A, il sito peptidilico o sito P e l’uscita o
sito E.
Complesso d’inizio negli eucarioti
no Shine-Dalgarno
L’allungamento
L’allungamento richiede:
a) Il complesso d’inizio
b) Gli amminoacil-tRNA
d) I fattori di allungamento (EF-Tu, EF-Ts
e EF-G nei batteri)
e) GTP
Fase I
Unione del secondo amminoacil-tRNA
Il fattore di allungamento Tu
La molecola di tRNA da inserire nel sito A viene
trasportata da una proteina detta fattore di
allungamento Tu (EF-Tu)
EF-Tu, un membro della famiglia delle proteine G,
lega l’amminoacil-tRNA solo quado ha legato a sé il
GTP
-EF-Tu protegge dall’idrolisi il labile legame estere
dell’amminoacil-tRNA
-Il GTP legato all’EF-Tu è idrolizzato solo quando si
forma una corretta associazione tra il complesso EFTu e il ribosoma (accuratezza della sintesi proteica)
- Il fattore di allungamento Ts si unisce al complesso
EF-Tu.GDP e favorisce la dissociazione del GDP
EF-Tu non interagisce con l’fMet-tRNAf ma riconosce il Met-tRNA. Il tRNA di
inizio non è trasportato sul sito A e i codon AUG interni non sono letti dal tRNA
di inizio. IF2 riconosce solo il l’fMet-tRNAf.
Fase II
Formazione del legame peptidico
Il gruppo α-amminico dell’amminoiacido nel
sito A agisce da nucleofilo, spostando il tRNA
nel sito P per formare un legame peptidico
L’attività enzimatica che catalizza la
formazione del legame peptidico viene chiamata
peptidil transferasi ed è probabilmente il
ribozima dell’rRNA 23S.
Fase III - Traslocazione
Il ribosoma si muove di una lunghezza pari a un
codone verso l’estremità 3’ dell’mRNA.
Il dipeptidil-tRNA si sposta dal sito A al sito P e
il tRNA deacilato viene spostato dall’iniziale
sito P al sito E. Il tRNA verrà poi rilasciato dal
sito E nel citosol.
Lo spostamento del ribosoma richiede EF-G ed
energia fornita dall’idrolisi del GTP.
Mimetismo molecolare
EF-Tu complessato con il tRNA
EF-G complessato con il GTP
La struttura di Ef-G mima la struttura del complesso EF-Tu/tRNA
suggerendo che EF-G possa legarsi al sito A e spostare il peptidil-tRNA.
Meccanismo di traslocazione
1.
Ef-G si lega al sito di legame di EF-Tu sulla subunità 50S
2.
L’idrolisi del GTP induce un cambiamento conformazionale in EF-G che
inserisce lo stelo nel sito A della subunità 30S
3.
I tRNA e l’mRNA si spostano di una distanza corrispondente a un codon
Guanosina 5’-O-(3-tiotrifosfato) (GTPγS)
Fase IV - La terminazione
L’allungamento prosegue finchè il ribosoma
aggiunge l’ultimo amminoacido.
La terminazione è segnalata da uno dei tre
codoni di terminazione dell’ mRNA (UAA,
UAG, UGA), che segue il codone dell’ultimo
amminoacido.
Quando un codone di terminazione occupa
il sito A sul ribosoma, tre fattori di
terminazione, RF1, RF2 e RF3 provvedono
ad effettuare
a) Idrolisi del legame terminale del peptidiltRNA;
b) Rilascio del polipeptide libero e dell’ultimo
tRNA;
c)
Dissociazione del ribosoma 70S nelle sue
subunità 30S e 50S.
Fase IV - La terminazione (b)
RF1 riconosce i codoni UAG e UAA mentre
RF2 riconosce i codoni UGA e UAA
RF1 o RF2 (a seconda di quale codone è
presente) si lega al codone di terminazione e
induce la peptidil transferasi a trasferire la
catena polipeptidica a una molecola d’acqua
invece che a un altro amminoacido
La funzione di RF3 è quella di regolare le
interazioni di RF1 e RF2 con il ribosoma
Negli eucarioti, un unico fattore di rilascio, eRF
riconosce tutti e tre i codoni di terminazione.
Per il rilascio del tRNA e dell’mRNA dal
ribosoma 70S è necessario un ulteriore fattore
proteico detto fattore di rilascio del ribosoma
(RRF) e l’EF-G che richiedono GTP
Struttura di un fattore di rilascio eucariotico
Un fattore di rilascio eucariotico ha una struttura simile a quella del tRNA.
In corrispondenza dell’etremità della struttura che ricorda lo stelo accettore
è presente la sequenza Gly-Gly-Gln che lega una molecola di acqua.
La molecola di acqua è così trasportata in corrispondenza del centro della
peptidil transferasi
Un polisoma
La traduzione simultanea di un
singolo mRNA da parte di numerosi
ribosomi permette di utilizzare
l’mRNA in modo molto efficiente.
Per vedere questa immagine
occorre QuickTime™ e un
decompressore Animation.
Accoppiamento della trascrizione e della traduzione nei batteri
Le catene polipeptidiche neosintetizzate vanno poi incontro a ripiegamenti e
modificazioni
Modificazioni post-traduzionali:
1) Modificazioni ammino-terminali e carbossi-terminali
2) Perdita della sequenza segnale
3) Modificazione di singoli amminoacidi
Fosfoserina
Fosfotreonina
Fosfotirosina
γ-Carbossiglutammato
Metillisina
Trimetillisina
Dimetillisina
Metilglutammato
4) Aggiunta di gruppi isoprenilici
Proteina Ras
Farnesil pirofosfato
Proteina Ras farnesilata
Modificazioni post-traduzionali:
5) Aggiunta di catene laterali di carboidrati a residui di Asn (oligosaccaridi
legati in N) o a residui di Ser e Thr (oligosaccaridi legati in O).
6) Aggiunta di gruppi prostetici
7) Modificazioni proteolitiche
8)Formazione di legami disolfuro.
La sintesi proteica viene inibita da molti antibiotici e tossine
L’antibiotico puromicina, prodotta dalla muffa
Streptomyces alboniger, assomiglia a un’estremità
3’ di un amminoacil-tRNA carico e si può legare al
sito A del ribosoma, dove può partecipare alla
formazione del legame peptidico.
La formazione del legame peptidico porta alla
formazione di peptidil-puromicina, che si dissocia
dal ribosoma, determinando la terminazione
prematura della catena.
Peptidil puromicina
Tetraciclina
Le tetracicline bloccano il sito A del ribosoma
La cicloesimide blocca la
peptidil transferasi
eucariotica, ma non quella
batterica.
Cicloesimide
Cloramfenicolo
Il cloramfenicolo blocca la peptidil transferasi
batterica, ma non quella eucariotica.
Streptomicina
La streptomicina causa l’errata lettura del codice genetico nei batteri a
concentrazioni basse e inibisce l’inizio della sintesi proteica a
concentrazioni più alte.