5. Il lavoro di un gas perfetto
Come si esprime l’energia interna di un gas perfetto?
Un gas perfetto è il sistema più semplice che possiamo immaginare: le
interazioni a distanza fra le molecole sono così deboli da essere inefficaci,
quindi l’energia interna è tutta cinetica. Potendo trascurare il secondo termine,
l’espressione di E int diventa:
E int
gas
perfetto
Energia cinetica
dovuta all'agitazione termica
delle particelle
Energia potenziale
dovuta alle interazioni fra
tutte le possibili coppie
NEc N
dove, supposto il gas monoatomico, l’energia cinetica complessiva è
stata ottenuta moltiplicando il valore medio per molecola
3
Ec kBT dell’energia cinetica dovuta all’agitazione termica, per il
2
R
numero N delle molecole. Ricordando che kB
, risulta:
NA
E int
gas
perfetto
3 R
3
3
N
T nRT PV
2 NA
2
2
con il numero di moli n
3
k T
2 B
ENERGIA INTERNA DEI GAS PERFETTI
MONOATOMICO
E int =
3
3
nRT = PV
2
2
BIATOMICO
E int =
5
5
nRT = PV
2
2
POLIATOMICO
E in t = 3 n R T = 3 P V
N
, ed avendo anche sfruttato anche l’equazione
NA
di stato PV nRT . Espressioni analoghe si ottengono per gas perfetti
biatomici e poliatomici.
Osserviamo infine che la quantità PV ha le dimensioni di un’energia:
N 3
m Nm J
m 2
PV
Se si esprime la pressione in atmosfere ed il volume in litri:
1 l 1 atm 103 1.01 105 101 J
risultato che useremo negli esercizi e da cui si ha anche :
R
8.31
0.0821 l atm / mol×K
101
Esiste un sistema al quale sia semplice applicare il primo principio?
Allo scopo di comprendere i meccanismi energetici del primo principio, si
concepisce un sistema termodinamico molto semplificato, come quello
costituito da un cilindro dotato di un pistone mobile e ripieno di gas perfetto.
Le semplificazioni rispetto ad un sistema reale sono:
13
Pext
delle variazioni di volume del sistema per
effetto dell’apporto di calore, poiché la dilatazione può avvenire
unicamente in una direzione
(2) L’ASSENZA DI UN CONTRIBUTO POTENZIALE NELL’ENERGIA INTERNA come
accade per tutti i gas ideali, dove le interazioni fra le molecole si
possono trascurare
(3) LE GRANDI VARIAZIONI DI VOLUME di cui le sostanze allo stato gassoso sono
capaci e, quindi, la loro abilità nel compiere del lavoro termodinamico in
maniera più agevole che non quando si trovano in fase solida.
(1)
LA FACILITÀ DI CONTROLLO
s
A
P
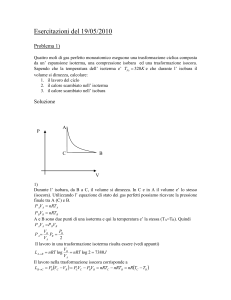
Che tipo di trasformazioni può subire il gas nel cilindro?
Quali che siano le trasformazioni, anche irreversibili, il primo principio ha in
ogni caso piena validità. Tuttavia il calcolo delle grandezze termodinamiche
coinvolte è molto facilitato se durante le variazioni di volume, temperatura o
pressione il sistema segue una successione di stati di equilibrio. Aggiungiamo
quindi come ultima condizione che il gas subisca solamente trasformazioni
reversibili.
Come si calcola il lavoro svolto da questo sistema?
La quantità L che figura nell’espressione del primo principio indica il lavoro
che il sistema in oggetto compie sull’ambiente a spese sia della propria energia
interna sia del calore Q che scambia con l’esterno. Se tuttavia il sistema è
vincolato a rimanere in condizioni quasistatiche, può compiere o subire del
lavoro solamente attraverso variazioni di volume1. Una variazione di volume
implica un moto ordinato delle molecole nella direzione della espansione o
della contrazione, così che forze che il sistema esercita sull’ambiente spostano il
loro punto di applicazione. Per uno spostamento s del pistone così piccolo da
poter considerare costante la forza che il gas esercita su di esso, viene compiuto
dal gas un lavoro elementare L dato da:
L F s Fs s
cioè il lavoro è pari alla lunghezza s dello spostamento del punto di
applicazione della forza, per la componente Fs della forza lungo la direzione
F
F
s
dello spostamento2. Il lavoro eseguito dal gas è positivo se il pistone si muove L POSITIVO
nel verso della forza esercitata dal gas, negativo se lo spostamento è in verso
opposto.
s
L
NEGATIVO
Come possiamo esprimere la forza che il gas esercita sul pistone?
Se il gas sta seguendo una trasformazione reversibile, in ogni istante si trova
sempre in equilibrio e quindi possiamo definirne la pressione interna P . La
forza Fs che il gas esercita nella direzione di s è il prodotto della pressione
per la misura A dell’area a contatto con il gas, e cioè:
Fs PA
1
Se non si dovessero rispettare le condizioni di quasi staticità potremmo far compiere lavoro, ad esempio ad un gas, per effetto
dei moti convettivi al suo interno. Tali moti sarebbero però originati da differenze di T e quindi la trasformazione in oggetto
non sarebbe reversibile in quanto non si potrebbe definire univocamente T
2
Si ricordi che la scrittura di prodotto scalare fra questi due vettori vale F Δs cosα e significa, indifferentemente, o Δs per la
componente di F lungo Δs , oppure F per la componente di Δs lungo F.
14
Per un’espansione irreversibile non possiamo adoperare la formula sopra in
quanto il valore della pressione del gas non è individuabile. Tuttavia, nella
situazione comunemente verificata in cui il gas si espande contro una
pressione costante esterna Pext (che include sia pressione atmosferica sia il
contributo del peso del pistone) poiché la forza che l’ambiente esercita sul gas:
F Pext A
ha la stessa intensità di quella che il gas esercita sull’ambiente, (come previsto
dalla terza legge della dinamica), si può utilizzare questa seconda espressione
per il calcolo del lavoro compiuto dal gas.
Che lavoro compie il gas sull’ambiente se la pressione si mantiene constante?
Il calcolo del lavoro termodinamico, anche nel caso semplice di un cilindro con
gas perfetto che compia trasformazioni reversibili è un procedimento complesso
perché, in generale, il valore della pressione cambia durante la variazione di
volume.
Calcoliamo ora il lavoro termodinamico che il gas compie
sull’ambiente in relazione all’innalzamento di una lunghezza s del pistone,
nel caso più semplice, quello di una trasformazione isòbara, durante la quale la
pressione si mantiene costante. Nel caso di una trasformazione irreversibile, se
Pext costante il lavoro compiuto dal gas vale:
Lirr Fs s Pext A s
Essendo ora V As la variazione di volume subita per lo spostamento del
pistone, otteniamo, in questo semplice caso, l’espressione per il lavoro
termodinamico di un gas:
Lirr Pext V Pext (V2 V1 )
dove con V1 abbiamo indicato il volume iniziale e con V2 quello finale, come in
figura. Se invece la trasformazione è reversibile, si può adoperare la pressione
interna P costante del gas e si ottiene:
Lrev P V P (V2 V1 )
Il lavoro svolto ha una interpretazione geometrica sul piano pressione-volume?
Se la trasformazione è irreversibile la risposta è no, in quanto non è nemmeno
possibile rappresentarla. Nel caso reversibile invece, il lavoro termodinamico si
presta ad una facile interpretazione geometrica sul piano di Clapeyron.
Si abbia un gas perfetto che si espande reversibilmente, a pressione costante, da
un volume V1 ad un volume V2 . Esso compie sull’ambiente un lavoro
L P V P (V2 V1 ) . La quantità P (V2 V1 ) rappresenta l’area compresa
P
TRASFORMAZIONE ISÒBARA
L = P ( V2 - V 1 )
P = costante
fra la retta orizzontale P costante , equazione dell’isobara, l’asse delle ascisse,
e le due rette verticali V V1 e V V2 . Se la trasformazione è percorsa dallo
stato a volume V1 verso lo stato a volumeV2 si tratta di una espansione, ed il gas
compie lavoro sull’ambiente essendo lo spostamento del pistone equiverso alla
forza che il gas esercita sul pistone. In questo caso si avrà:
v
v1
v2
15
L P (V2 V1 ) 0
Se invece si tratta di una compressione, percorsa quindi dallo stato a volume
maggiore V2 verso quello a volume minore V1 , lo spostamento del pistone sarà
in verso contrario alla forza che il gas esercita su di esso e diremo che il gas
compie il lavoro negativo (o resistente)
L P (V2 V1 ) 0
oppure che il sistema compie lavoro sul gas.
E se l’espansione non avviene in una sola direzione?
La formula ricavata ha una validità generale, nel senso che anche per un
contenitore a forma irregolare che subisse una variazione di volume si potrebbe
calcolare il lavoro termodinamico relativo a tale trasformazione dividendo la
superficie che si espande in tanti elementi regolari e calcolando il lavoro
attraverso la sommatoria dei contributi di ciascuno di essi, come schematizzato
in figura.
s
A
Ci sono dei casi in cui non questa formula non vale?
Chiaramente a formula L P V cessa di valere in tutti quei casi in cui non ci
si trovi in condizioni di quasi staticità, perché se così fosse non si potrebbe
nemmeno definire un valore univoco per la pressione da inserire in essa. Val la
pena di rimarcare che in generale il lavoro termodinamico dipende dal percorso
che le variabili fisiche seguono, e che, ad esempio, una espansione turbolenta
che raddoppi il volume di un gas comporta un lavoro molto diverso da quello
di una espansione reversibile che conduca al medesimo stato finale.
Qual è il lavoro del gas sull’ambiente se il volume resta constante?
Nel caso di una trasformazione isocòra, durante la quale il volume non varia, il
lavoro che un gas perfetto compie è, con tutta evidenza, sempre zero, dato che
si ha, per definizione, pari a zero la variazione di volume V . La
rappresentazione di una isocòra reversibile sul piano di Clapeyron è un tratto
verticale.
TRASFORMAZIONE
ISÒBARE
P
P2
ISOTERMA
P1
L=0
ISOCÒRE
TRASFORMAZIONE
P1
PROPORZIONALI A 1/Vi
ISOCÒRA
V
P2
V = costante
V1
Che lavoro compie il gas sull’ambiente se la
temperatura si mantiene constante?
V2
Vi
16
Consideriamo ora il caso di un gas perfetto che esegua una trasformazione
isoterma fra due stati 1 e 2. Sul piano di Clapeyron i punti seguiranno l’arco di
iperbole equilatera PV nRT costante . Il valore della pressione cambia
continuamente durante il processo e in questo caso la formula L P V non
può essere adoperata. Tuttavia, avendo a che fare con una trasformazione
quasistatica, possiamo immaginare di suddividere la variazione di pressione
complessiva in tanti salti elementari durante le quali il suo valore si mantiene
costante. Successivamente raccordiamo queste trasformazioni isòbare con delle
isocòre durante la quali si compie lavoro nullo perché V 0 . In questo modo
abbiamo approssimato la trasformazione con una scaletta di isobare ed isocore,
come illustrato in figura. Il lavoro può essere calcolato come somma dei lavori
di queste trasformazioni elementari e conserva la sua interpretazione
geometrica di area sottesa dalla curva che rappresenta la trasformazione:
PV costante (area evidenziata in figura). Indichiamo con Wi il lavoro
compiuto durante l’ i-esima isobara, ed esprimiamolo, tramite la formula già
trovata, come Li Pi Vi . Il lavoro complessivo si ottiene addizionando i
contributi di tutte le isobare elementari costruite. Tale somma rappresenta l’area
sottesa dal plurirettangolo di basi Vi ed altezze Pi . Sfruttando l’equazione di
nRT
stato Pi
l’espressione Li Pi Vi del lavoro durante ogni isobara
Vi
diviene:
Li nRT
Vi
Vi
Sommando si ottiene il lavoro complessivo:
L
nRT
Vi
Vi
nRT
Vi
Vi
avendo raccolto nRT a fattore comune, in quanto non dipende dall’indice i
ma è solo un prodotto di costanti che moltiplica tutti i termini. Come
Vi
mostriamo nella scheda matematica, la nuova somma ottenuta
è l’area
Vi
sottesa dall’iperbole equilatera y
1
fra il valore iniziale V1 e quello finale
V
V2 , area che si ottiene tramite la funzione logaritmo naturale:
Vi
V
ln 2 . Sostituendo:
Vi
V1
L nRT ln
V2
V1
che è la formula che consente di calcolare il lavoro durante una trasformazione
isoterma.
Qual è il segno del lavoro compiuto da una gas perfetto che segue un’isoterma?
Se si tratta di un’espansione avremo il risultato che il sistema compie un lavoro
positivo. Infatti se si espande il volume finale è maggiore di quello iniziale, cioè
17
V2 V1 e quindi, essendo l’argomento del logaritmo
di 1, risulta ln
V2
un numero maggiore
V1
V2
0 . Se invece si tratta di una compressione il lavoro sarà
V1
negativo essendo in questo caso l’argomento del logaritmo minore di 1.
Esempio 1
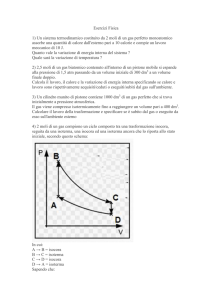
Due moli di gas perfetto compiono il ciclo ABC in figura
dove:
PA 3 atm , PB PC 1 atm ,
A
PA
VA VC 24 l , VB 40 l
Calcolare:
PB = PC
a) Il lavoro eseguito dal sistema durante il ciclo e durante i tre
tratti intermedi
b) Il calore scambiato durante il ciclo stesso
c) La temperatura in C
C
B
VA = VC
VB
Osserviamo che l’energia interna E int di un sistema è una funzione del suo
stato, e quindi in un processo ciclico, dove, partendo dallo stato A si ritorna in
A, e le variabili termodinamiche riassumono i loro valori iniziali, E int non può
essere cambiata. Quindi applicando il primo principio con E int 0 abbiamo
per l’intero ciclo: E int 0 Q L Q L
Il lavoro è svolto unicamente nel tratto isobaro BC ed in quello AB . Si ha:
LBC PB (VC VB ) 1 (24 40) 16 l atm 1616 J
area 1
P P (V V ) 36 l atm 3636 J
LAB
B
B
C
sottesa 2 A
Lciclo Qciclo LAB LBC 3636 J 1616 J 2020 J
Per il calcolo della temperatura applichiamo l’equazione dei gas perfetti nello
stato C ( R 8.32 J/mol K 0.0821 l atm/mol K ):
TC
PCVC
nR
1 40
244 K
2 0.0821
P
Esempio 2
Due moli di gas perfetto compiono il ciclo reversibile ABCD
nel verso indicato in figura. Il ciclo è formato dalle due
isoterme AB e CD e dalle due isocore AD e BC. Essendo:
VA 4.0 l ; VB 8.0 l ;
TA TB 100 °C ;
TC TD 20 °C ;
si calcolino al termine del ciclo:
A
D
B
C
V
18
a) Il lavoro totale fatto dal gas e la sua variazione di
energia interna
b) Il calore scambiato nel tratto AB
c) La variazione di energia interna nel tratto DA
d) La pressione massima che si è avuta durante il ciclo
a) Il lavoro viene svolto solo nei due tratti isotermi, positivo nell’espansione
AB , negativo nella compressione CD . Trasformando in Kelvin le temperature
date si ha:
V
V
8.0
4.0
9.10 l atm 919 J
L LAB LCD nRTA ln B nRTB ln D 2R 373 ln
293 ln
VA
VC
4.0
8.0
Nel tratto AB si ha chiaramente E int
3
Nk T 0 essendo T 0 .
2 B
b) Applicando il primo principio al tratto AB otteniamo:
8.0
E int Q L 0 QAB LAB nRTA ln
4297 J
4.0
un calore positivo, quindi entrante.
c) Dobbiamo applicare la relazione:
3
3
3
3
E int NkB T nRT nR TA TD
2 R 100 20 160R 1330 J
2
2
2
2
d) La massima pressione si ha in A. Dall’equazione di stato:
nRTA
2 0.0821 373
PA
15.3 atm
VA
4.0
Esempio 3
Un gas perfetto può triplicare il proprio volume da VA 2.0 m 3
3
a VC 6.0 m passando per due cammini differenti, ABC oppure
AC, come mostrato in figura. Il calore ceduto al gas lungo il
cammino ABC è QABC 15 105 J . Sapendo inoltre che
5
2
5
PA = PC
A
C
PB
B
2
PA PC 1.0 10 N/m e PB 2.0 10 N/m , calcolare:
a) Il lavoro compiuto dal gas durante il cammino ABC
VA
VC
b) Il calore QAC che il gas ha scambiato se la trasformazione
è avvenuta lungo il cammino AC
Il lavoro svolto lungo AC è l’area del rettangolo compreso fra il
segmento AC e l’asse delle ascisse:
LAC PA(VC VA ) 2.0 105 (6.0 2.0) 8.0 105 J
Il lavoro svolto lungo il camino ABC è dato dall’area sotto alla spezzata ABC,
al
evidenziata in giallo. Questa si ottiene sottraendo l’area del triangolo ABC
lavoro LAC già trovato. Anche se il non è noto il volume VB , l’area del
19
è comunque determinata perché sono date la sua base e la sua
triangolo ABC
altezza. Risulta:
1
1
LABC LAC (PA PB )(VC VA ) 8.0 105 1.0 105 (4.0) 6.0 105 J
2
2
Per trovare QAC applichiamo il primo principio alla trasformazione AC:
E intAC QAC LAC . Essendo l’energia interna una funzione di stato,
E intAC si può calcolare anche al termine del percorso ABC, che ha in comune
con AC gli stati iniziale e finale. Abbiamo:
E intAC QABC LABC 15 105 6.0 105 9.0 105 J
da cui infine:
QAC E intAC LAC 9.0 105 8.0 105 17 105 J
Esempio 4
Un gas perfetto monoatomico si trova ad volume iniziale VA 4.0 l e ad una pressione
iniziale PA 1.0 atm . Esso segue una trasformazione che nel piano di Clapeyron è
rappresentata dal segmento di una retta passante per l’origine, al termine della quale ha
raddoppiato il suo volume.Si calcolino:
a) La variazione di energia interna
b) Il lavoro eseguito dal gas ed il calore scambiato
La conoscenza del coefficiente angolare m
PA
della retta
VA
B
PB
permette di ricavare la pressione finale:
P
P
m A B PB 2PA 2.0 atm
VA
2VA
PA
Per la variazione di energia interna si ha:
3
3
9
E int 2PA 2VA PAVA PAVA 18 l atm 1.8 103 J
2
2
2
L’area sottesa dal segmento AB fornisce il lavoro eseguito dal gas.
Trattandola come un trapezio di basi PA e PB ed altezza 2VA VA si ha:
A
VA
2VA
1
1
(P PB )(2VA VA ) 3.0 atm 4.0 l 6.0 l atm 6.0 102 J
2 A
2
mentre dal primo principio si ha il calore scambiato:
LAB
QAB E intAB LAB 1.8 103 J 6.0 102 J 2.4 103 J
Esempio 5
Si hanno tre moli di gas perfetto che compiono il ciclo
indicato con ABCDBEA in figura, simmetrico rispetto al
punto B. Sapendo che:
PA PD 5.0 atm , PE PC 3.0 atm ,
VA VE 20 l ,VD VC 30 l
Calcolare:
1. Il lavoro eseguito dal sistema durante il ciclo
PA=PD
A
D
B
PC=PE
E
VA=VE
C
VC=VD
20
2. Il calore scambiato durante il ciclo stesso
3. La temperatura degli stati D e B
Il lavoro eseguito durante l’intero ciclo è nullo per la simmetria del percorso.
Durante le due isocore EA e CD non viene compiuto lavoro, mentre il lavoro
positivo svolto nel tratto di espansione AC, è uguale e contrario al lavoro
subito, negativo, nella contrazione DE. Risulta quindi:
E int(ciclo ) Qciclo Lciclo Qciclo
Essendo in qualunque ciclo E int(ciclo ) 0 ne segue anche Qciclo 0 .
Per il calcolo di TD usiamo l’equazione di stato dei gas perfetti:
PDVD
5.0 30
609 K
nR
3 0.0821
Il punto B ha volume e pressione intermedi:
V VD
P PE
20 30
5.0 3.0
VB A
25 l PB A
4.0 atm
2
2
2
2
Per cui dall’equazione di stato:
PV
4.0 25
TB B B
406 K
nR
3 0.0821
TD
Esempio 6
Due moli di gas perfetto si trovano a T0 320 K sono posti in un cilindro dotato di
pistone mobile. Il sistema viene riscaldato finché la lunghezza della parte di cilindro
occupata dal gas non raddoppia, poi viene bloccato il pistone ed il gas è raffreddato
finché la pressione non è ridotta alla metà di quella iniziale. Si calcoli la variazione di
energia interna del gas ed il calore complessivamente scambiato con l’ambiente.
Raddoppio della lunghezza del cilindro significa raddoppio del volume
occupato, visto che la superficie di base non cambia. Osserviamo che, se
1
indichiamo lo stato iniziale con P0 , V0 e T0 , quello finale sarà P0 , 2V0 e Tf .
2
Dalla formula per l’energia interna di un gas perfetto mono-atomico si vede che
il contenuto energetico non è cambiato:
3
3 1
P0V0 P0 2V0
2
2 2
Ed il risultato è analogo se si tratta di gas bi-atomico o poli-atomico.
Dall’equazione di stato si ricava inoltre che la temperatura finale è uguale a
quella iniziale:
1 P 2V
PV
0 0
T0 0 0
Tf 2
T0
nR
nR
Dal primo principio otteniamo che il calore scambiato è pari al lavoro compiuto
E int Q L 0 Q L P0 (2V0 V0 ) P0V0
P0
1
2
P0
V0
2V0
Q P0V0 nRT0 2 8.31 320 5318 J
calore positivo quindi assorbito dal gas.
21
Pex
Esempio 7
7.0 mol di gas perfetto sono contenute in un cilindro dotato di pistone scorrevole sul
quale è posta una massa m , e tutto il sistema si trova in equilibrio alla temperatura di
27 °C . Un certo quantitativo di calore Q viene fornito al gas finché questo non
raddoppia il proprio volume. Relativamente a questa trasformazione si trovino il calore
ricevuto dal gas, il lavoro che il gas ha svolto e la sua variazione di energia interna.
m
s
m
In mancanza di altre specificazioni dobbiamo ritenere che si tratti di una
trasformazione irreversibile, quindi non rappresentabile sul piano P-V se non
per gli stati iniziale e finale. Il lavoro sarà calcolabile grazie alla pressione
dall’esterno. Risulta quindi:
L Pe V
Durante la trasformazione, date le turbolenze, non esiste un valore di pressione
interna, tuttavia negli stati di equilibrio iniziale e finale la pressione interna si
sarà stabilizzata attorno al valore esterno quindi possiamo applicare
l’equazione dei gas perfetti:
PV
nRTi
PV
Pe 2Vi nRTf
e i
e f
Sottraendo membro a membro:
Pe 2Vi PV
PV
nR Tf Ti nRT
e i
e i
E ricordando che è pure PV
nRTi si trova:
e i
nRTi nR T
T Ti 300 K
Il lavoro compiuto sarà:
Tf Ti T 600 K
L Pe V Pe Vf Vi PV
nRTi 7 8.31 300 17451 J
e i
la variazione di energia interna:
5
E int nRT 2.5 7 8.31 300 43628 J
2
da cui si ricava subito il calore scambiato dal gas:
E int Q L Q E int L 43628 J 17451 J 61079 J
positivo in quanto ricevuto dal gas.
Esempio 8
8.0 mol di gas perfetto sono contenute in un cilindro in
equilibrio alla temperatura dell’ambiente T 300 K . Sul
pistone gravano sia la pressione atmosferica che il proprio
peso. Un filo tira lentamente il pistone verso l’alto, in modo
che la trasformazione sia isoterma reversibile, fino a che il
volume del gas non è raddoppiato. Si calcoli il lavoro svolto
dalla tensione del filo.
h
Il sistema segue una trasformazione reversibile, quindi
è sempre in equilibrio durante il processo, che consiste
di una espansione isoterma. Il pistone non varia la
propria energia cinetica essendo fermo in equilibrio sia all’inizio che alla fine,
quindi deve essere nullo il lavoro complessivamente svolto su di esso.
Esplicitando i segni negativi dei lavori resistenti, quelli cioè in cui le forze
22
contrastano lo spostamento del punto di applicazione dovuto al movimento del
pistone:
Lgas Lfilo Lpeso LPatm 0 Lfilo Lpeso LPatm Lgas
Per il lavoro del gas si può far uso della formula per l’isoterma reversibile:
Vf
Lgas nRT ln
8.0 8.31 300 ln 2 13824 J
Vi
Indicando con m la massa del pistone, con A la sua superficie e con h lo
spostamento verticale, il lavoro della forza peso e quello della forza dovuta alla
pressione atmosferica si scrivono complessivamente:
Lpeso LPatm mgh Patm Ah mg Patm A h
Tenendo conto che il pistone è inizialmente in equilibrio, la forza risultante
esercitata su di esso deve essere nulla:
Pgas A mg Patm A 0 Pgas A mg Patm A
da cui, essendo V Vin poiché il volume raddoppia:
Lpeso LPatm Pgas Ah Pgas V PgasVin nRT 8.0 8.31 300 19944 J
Facendo la differenza si ottiene il lavoro della tensione del filo:
Lfilo Lpeso LPatm Lgas 19944 J 13824 J 6120 J
Esempio 9
Alcune moli di gas perfetto sono contenute in un cilindro
dotato di pistone scorrevole sul quale è posta una coppia di
masse uguali m 25 Kg . Al di sopra delle masse c’è il
Vuoto
Vuoto
vuoto, e tutto il sistema si trova in equilibrio alla
temperatura dell’ambiente, essendo h 0.40 m l’altezza del
cilindro occupata. Levando una delle masse il gas si espande
a temperatura costante. Relativamente a questa
trasformazione si trovino il calore scambiato dal gas, il lavoro
che il gas ha svolto e la sua variazione di energia interna.
m
m
m
h
In assenza di indicazioni, dobbiamo ritenere che si
tratti di una trasformazione irreversibile, quindi non rappresentabile sul piano
P-V. Non è quindi lecito usare l’equazione dell’isoterma reversibile, ma il lavoro
sarà calcolabile grazie alla conoscenza della pressione dall’esterno, che, detta A
mg
la superficie del pistone, è sempre uguale a
durante la trasformazione.
A
Risulta quindi:
mg
L Pe V
V Vi
A f
Per trovare Vf Vi osserviamo che sebbene durante la trasformazione, date le
turbolenze, non esista un valore di pressione interna, negli stati di equilibrio
iniziale e finale la pressione interna si sarà stabilizzata attorno al valore esterno
quindi possiamo applicare l’equazione dei gas perfetti:
PV
nRTi nRTf PfVf
i i
Riguardo alle pressioni iniziale e finale , si ha:
23
mg
1
Pi
A
2
Pi
da cui si ricava Vf Vi 2Vi . Il lavoro compiuto vale dunque:
Pf
Pi
2mg
A
Pf
mg
mg
Vi
Ah mgh 25 Kg 9.8 m/s2 0.40 m 98 J
A
A
Allo stesso risultato si perviene applicando il teorema dell’energia cinetica ed
osservando che il lavoro sul pistone deve essere uguale e contrario a quello
mgh svolto dalla gravità, visto che il corpo non varia la sua energia cinetica
nel processo, essendo fermo all’inizio ed alla fine.
L Pe Vf Vi
Esempio 10
Alcune moli di gas perfetto biatomico seguono le trasformazione reversibili in figura.
Prima lungo AB dimezzano il proprio volume a pressione costante, poi lungo BC,
triplicano il volume a temperatura costante, ed infine lungo CD raddoppiano la
3P0
B
A
2P0
D
P0
C
pressione a volume costante. Sapendo che V0 10 m 3 e P0 2.5 105 Pa si dica
quanto valgono il lavoro complessivamente svolto, il calore complessivamente
scambiato e la variazione totale di energia interna.
V0
2V0
Il lavoro viene svolto soltanto lungo l’isobara AB e l’isoterma BC, mentre
durante l’isocòra si ha LCD 0 . Per l’isobara abbiamo:
LAB PA (VB VA ) 3P0 (V0 2V0 ) 3P0V0 3 2.5 105 10 7.5 106 J
lavoro negativo, subito dal gas, che infatti si contrae dimezzando il proprio
volume. Lungo l’isoterma invece si ha invece:
V
LBC nRTB ln C
VB
occorre quindi calcolare la temperatura TB utilizzando l’equazione di stato in B:
TB
PBVB
nR
Sostituendo:
LBC nR
3P0V0
nR
3PV
0 0
ln
3V0
V0
3P0V0 ln 3 3 2.5 105 10 1.1 8.3 106 J
nR
Il lavoro complessivo L vale allora:
L LAB LBC 7.5 106 8.3 106 8 105 J
La variazione di energia interna che compete a tutta la trasformazione ABCD è:
5
5
5
E int PDVD PAVA 3P0 2V0 2P0 3V0 0 J
2
2
2
ed applicando il primo principio, il caloreQ complessivamente scambiato
risulta:
E int Q L 0 J
Q L 8 105 J
24
3V0