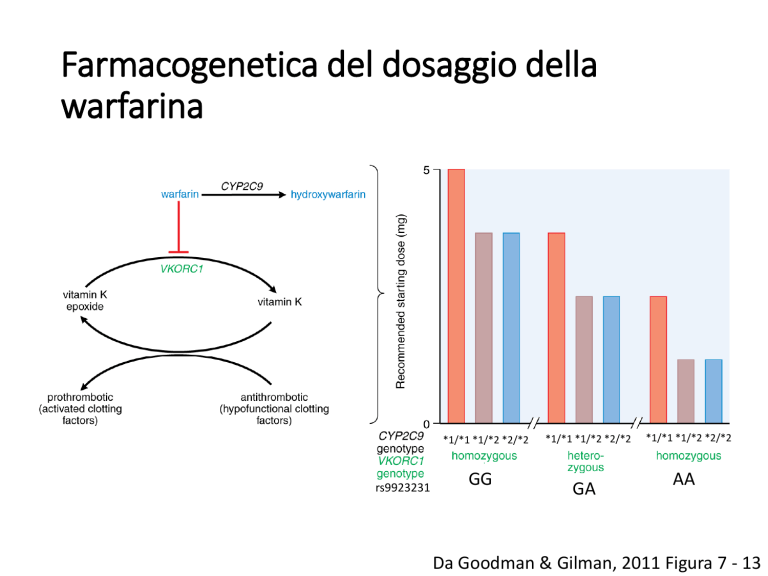
Farmacogenetica del dosaggio della
warfarina
*1/*1 *1/*2 *2/*2
rs9923231
GG
*1/*1 *1/*2 *2/*2
GA
*1/*1 *1/*2 *2/*2
AA
Da Goodman & Gilman, 2011 Figura 7 - 13
Johnson et al., Clin Pharm Ther 2011
Johnson et al., Clin Pharm Ther 2011
Johnson et al., Clin Pharm Ther 2017
Perera et al., Lancet 2013
2. Carbamazepina
___________________________________________________
La Carbamazepina (CBZ), una dibenzazepina (composto
triciclico) è un anticonvulsivante aromatico, correlato agli
antidepressivi triciclici.
Riduce la propagazione degli impulsi anormali nel cervello
producendo un blocco frequenza e voltaggio dipendente dei
canali sodio, in tal modo inibisce la generazione di un
ripetitivo potenziale d’azione dei foci epilettogeni.
È stato approvato dalla FDA per il trattamento dell’epilessia
e altri disturbi correlati, nevralgia del trigemino e disordini
bipolari.
2.1 Farmacocinetica
___________________________________________________
Somministrazione Orale o rettale
Biodisponibilità ~85%
Picco plasmatico 4-12 µg/mL
Vd 1 L/Kg considerando la biodisponibilità come pari al 100%
*** Concentrazioni terapeutiche del farmaco si ritrovano a livello del liquido cerebrospinale, nella bile
e nella saliva; permea la placenta e viene secreta nel latte materno.
Emivita 25-65 h (dopo trattamento iniziale); 10-20 h (dopo trattamento cronico).
Eliminazione Sotto forma di metaboliti (72%) attraverso le urine; una piccola quantità di farmaco
viene escreta con le feci.
Effetti avversi:
• Dose dipendenti: cambiamento di umore, sonnolenza o andatura instabile
• Dose indipendenti: eruzioni cutanee, tossicità epatica e soppressione del midollo osseo
2.1.1 Biotrasformazione e varianti
___________________________________________________
La carbamazepina viene metabolizzata a livello epatico in modo completo, meno del 5%
della dose è escreto in forma immodificata; sono state descritte quattro vie metaboliche
principali:
1) Formazione di 10,11-epossido-carbamazepina (circa il 40% del metabolismo totale);
2) Idrossilazione diretta dei 2 anelli aromatici (circa il 25%);
3) Glucuronazione della catena carbamilica (15%);
4) Introduzione, sugli anelli aromatici, di gruppi contenenti zolfo.
2.1.1 Biotrasformazione e varianti
___________________________________________________
PXR CAR
Autoinduzione
2.1.1 Biotrasformazione e varianti
___________________________________________________
Enzimi della F1:
Anche se gli studi in merito sono stati pochi, si è visto che varianti negli enzimi coinvolti nel metabolismo della
CBZ interessano la farmacocinetica della Carbamazepina.
In particolare:
•
CYP3A4*16 (frequenza 1-5% nelle popolazioni di Giappone, Corea e Messico) ha una funzionalità ridotta, il
che comporta decremento della clearance nei sistemi in vitro.
•
Un piccolo studio sulla popolazione Coreana ha rivelato che i non espressori del CYP3A5 (CYP3A5*3/*3)
presentano una clearance della CBZ significativamente più alta rispetto agli espressori del CYP3A5
(CYP3A5*1/*1 e CYP3A5*1/*3). Questo è dovuto all’autoinduzione dei geni del CYP3A.
•
Varianti nel EPHX1 sono associati anche ad un alterato metabolismo della CBZ.
EPHX1:Y113H e EPHX1:H139R ↑ CBZ-diol/CBZ-epoxide nel plasma
2.1.1 Biotrasformazione e varianti
___________________________________________________
Effetto del CYP3A5*3
•
•
Diverse varianti genetiche sono state descritte per il CYP3A5 e la più comune, CYP3A5*3, causa la perdita
dell’attività del CYP3A5.
La base genetica è uno SNP nell’introne 3, A>G, che crea un sito criptico di splicing e così 131 nucleotidi
della sequenza intronica vengono inseriti nell’RNA, introducendo un codone di stop che prematuramente
tronca la proteina CYP3A5.
2.1.1 Biotrasformazione e varianti
___________________________________________________
Linea continua = linea di regressione per gli espressori
Cerchi bianchi = espressori
Linea tratteggiata = linea di regressione per i non espressori
Cerchi neri = non espressori
2.1.1 Biotrasformazione e varianti
___________________________________________________
Discussione:
• I non-espressori del CYP3A5 mostrano livelli plasmatici di CBZ più alti del 31% rispetto agli
espressori;
• La clearance dei non-espressori è del 29% più bassa rispetto agli espressori;
• Siccome la CBZ è un induttore dei CYP3A4/5, l’espressione di questi può alterare la CBZ;
• I livelli sierici della CBZ aumentano con l’aumentare della dose MA dopo la normalizzazione
della dose, il livello sierico della CBZ diminuisce inversamente alla dose somministrata.
I risultati possono essere una conseguenza dell’aumento della clearance della CBZ dovuta
all’induzione dei CYP3A4/5 con l’aumento della dose del farmaco.
• In conclusione, il genotipo CYP3A5*3 influenza i livelli sierici della CBZ in pazienti epilettici
Coreani e così contribuisce all’osservazione di una variabilità inter-individuale nei livelli di
CBZ.
2.1.1 Biotrasformazione e varianti
___________________________________________________
Trasportatori:
Varianti di ABCB1 mostrano una
resistenza alla CBZ in 464 pazienti cinesi,
ma il risultato non è riprodotto nei 228
indiani del nord (rs3789243 e rs2032582).
(!) Non è correlato all’etnia: uno stesso
studio fatto su europei ed asiatici non ha
evidenziato
una
associazione
del
ABCB1:3435 C>T con una farmacoresistenza.
2.1.1 Biotrasformazione e varianti
___________________________________________________
Una associazione statisticamente più sicura è quella con ABCC2 SNP c.1249G>A. Questa
variante è associata con neurological ADRs in 146 individui coreani con l’epilessia a cui è stata
somministrata CBZ e validata in una coorte indipendente della stessa etnia.
Un altro SNP della ABCC2 (-24C>T) è stato associato alla perdita di risposta della CBZ in giovani
pazienti caucasici con l’epilessia.
Studi relativi alla probanda farmacoresistenza di varianti di RALBP1 hanno smentito l’ipotesi.
2.2 Farmacodinamica
___________________________________________________
I target della CBZ nel cervello, cioè i canali sodio SCN1A, SCN1B, SCN2A
e SCN3A hanno conseguenze farmacogenomiche:
•
La variante di SCN1A IVS5N+5 G>A richiede un dosaggio maggiore
•
Le varianti in SCN2A e SCN3A possono contribuire alla resistenza al
farmaco
•
Evidenze in vitro sui topi suggeriscono SCN1B come un potenziale
farmaco-gene per CBZ
2.3 HLA-B*15:02 ed effetti avversi
___________________________________________________
Human Leukocyte Antigen B (HLA-B) è:
•
Un gene che codifica per una proteina di superficie implicata nel
riconoscimento e presentazione degli antigeni al SI
•
Un gene fra i più polimorfici di tutto il genoma umano
Più di 2000 alleli HLA-B identificati
La variante allelica HLA-B *15:02:
•
È associata ad un rischio incrementato di sviluppare la Sindrome di StevensJohnson (SJS) e la Necrolisi Epidermica Tossica (TEN) in risposta al
trattamento con CBZ, che si sviluppa entro i primi 3 mesi dall’inizio della
terapia.
•
La sua distribuzione varia a seconda del gruppo etnico
In particolare, è diffuso in Oceania e gran parte dell’Asia (1-10%)
È raro in Africa (non osservato) ed Europa (0-0,02%)
2.3 HLA-B*15:02 ed effetti avversi
___________________________________________________
La SJS è caratterizzata da un distacco dell’epidermide che colpisce più del 10% della
superficie corporea, mentre la TEN, solitamente, ne coinvolge più del 30% .
I pazienti con le vescicole tra il 10 e il 30% della superficie corporea hanno un
accavallamento fra le due tipologie.
Il tasso di mortalità è:
< 5% per la SJS
> 30% per la TEN
Dove la sepsi è considerata la maggiore causa di morte
Il primo caso di associazione genetica fra CBZ e induzione di SJS/TEN con l’allele
HLA-B *15:02 è stato pubblicato da Chung et al. nel 2004.
La FDA raccomanda che “pazienti con antenati appartenenti ad una popolazione a
rischio dovrebbero essere sottoposti a screening per la presenza dell’allele
HLA-B *15:02 prima di iniziare il trattamento con CBZ”.
2.3 HLA-B*15:02 ed effetti avversi
___________________________________________________
b
*X = any HLA-B genotype other than *15:02
Alternative medications such as phenytoin, fosphenytoin, oxcarbazepine, eslicarbazepine acetate,
and lamotrigine have some evidence linking serious cADRs with the HLA-B*15:02 allele and thus
caution should be used in choosing alternatives to carbamazepine
c
Clinical use of pharmacogenetics tests
(Pharmaco)genetic tests must meet certain criteria
concerning their:
- analytical validity (not trivial for genes such as CYP2D6)
- quality of data from genetic test
- test's performance characteristics
- clinical validity/utility
- penetrance of genetic variation on drug effects
- mechanism influencing drug effects (in vitro, PK, preclinical)
- clinical studies comparing outcomes of genetics-based prescribing
- therapeutic index, severity of toxicity, severity of disease
Clinical utility of pharmacogenetic testing
- The use of the test leads to improved health outcomes for
patients who are subject to testing?
- What are the risks that occur as a result of testing?
- What are the costs of testing?
- How can testing influence the behavior of clinicians?
https://www.genome.gov/sequencingcosts/
Costs of testing
Plumpton et al., PharmacoEconomics 2016
Pharmacogenetic testing my affect clinicians behaviour
Chen et al., Neurology 2014
As the cost of sequencing continues to fall every individual will in the
not-too-distant future have their germline genome sequenced early in
life and the results will be available for clinical use throughout their
lifetime.
clinicians need guidelines on how to
interpret and deploy genetic variants to
improve their prescribing
An important consideration for the actionability of a gene–drug
relationship is the availability of an alternative therapy
Straightforward for medications:
- that are already therapeutically monitored (tacrolimus and CYP3A5);
- for which there are several valid alternative drugs (codeine and CYP2D6);
- for which the risk of severe adverse effects is extremely high (abacavir and HLAB*57:01.
More difficult for medications for which the best alternative is unknown (tamoxifen
and CYP2D6).
https://www.pharmgkb.org/view/dosing-guidelines.do?source=CPIC#
FDA/EMA approved medications
15% of medications contain pharmacogenomic information on their label
Relling & Evans, Nature 2015
Relling & Evans, Nature 2015
Pharmacogenetic testing approach
reactive approach in which a fresh genetic test is
ordered every time it is required
vs
pre-emptive approach in which a single sample is
assessed for many likely-to-be actionable genes at the
same time
Bringing pharmacogenetic testing to the clinic
CDS = clinical decision support
Conclusions
• Clinicians are accustomed to making prescribing decisions on the
basis of patient characteristics such as age, kidney or liver function,
drug–drug interactions and personal preferences.
• Much of this takes place without optimal CDS to assist in compiling
these characteristics and matching them with evidenced-based
choices on medications and doses.
• As CDS improves and becomes more widespread, and as the
evidence to support pharmacogenomic testing continues to grow,
momentum for the clinical implementation of pharmacogenomics
should accelerate.
• Going forward, there is a growing body of evidence to suggest that
pharmacogenomics will become an important component of
evidence-based precision medicine.
CDS = clinical decision support