Materiale didattico a supporto
dell’esperienza 3
COMPORTAMENTO DI SALI
CONTENENTI PARTICOLARI CATIONI IN
SEGUITO A TRATTAMENTO CON
COMPLESSANTI, BASI ED ACIDI
Perché le soluzioni dei cationi metallici di
partenza sono acide.
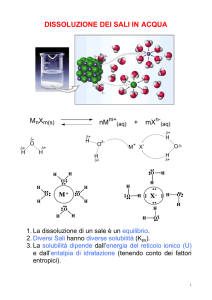
Una volta sciolto un sale sia il catione che l’anione interagiscono con l’acqua formando
degli ioni “solvati”.
Quando le interazioni tra le molecole d’acqua (base di Lewis) e il catione metallico
(acido di Lewis) sono sufficientemente forti si può parlare dell’effettiva formazione di
un complesso.
Per esempio lo ione ferro(III) in acqua coordina sei molecole d’acqua, si può
correttamente indicare lo ione Fe3+(aq) come il complesso esa-acquoferro(III):
[Fe(OH2)6]3+.
Le molecole di acqua coordinate allo ione metallico sono più acide delle altre presenti
in soluzione. L’aquocomplesso può quindi comportarsi esso stesso come un acido di
Bröensted:
[M(OH2)r]n+ + H2O
[M(OH2)r-1OH](n-1)+ + H3O+
La forte interazione tra lo ione ferro(III) e l’ossigeno delle molecole d’acqua coordinate
fa si che il legame O-H di queste molecole sia (più) polarizzato verso l’ossigeno.
(L’orbitale di legame, in altre parole, si sposta maggiormente verso l’ossigeno). La
conseguenza è che il legame O-H si indebolisce e gli idrogeni delle molecole d’acqua
coordinate sono più acidi delle altre presenti.
La forza dell’interazione tra un catione e le molecole d’acqua che lo solvatano, dipende da:
carica dello ione (Z2), raggio ionico (r) e elettronegatività dell’elemento (p P sta per Pauli).
I cationi metallici possono essere classificati in gruppi a seconda del valore del rapporto Z2 / r
(Z2 / r è calcolato esprimendo r in picometri).
Si può osservare che all’aumentare della carica e al diminuire del raggio ionico l’acidità aumenta.
Inoltre, a parità di Z2/r, i cationi con grande elettronegatività (si osserva qualche differenza quando p > di
1.5) sono, in genere, più acidi.
Relazione tra il rapporto Z2/r e l’ acidità dei cationi metallici
Z2/r
p
Tra 0.00 e 0.01
Tra 0.00 e 0.01
Tra 0.01 e 0.04
Tra 0.01 e 0.04
Tra 0.04 e 0.10
Tra 0.01 e 0.10
Tra 0.10 e 0.16
Tra 0.10 e 0.16
Tra 0.16 e 0.22
> 0.16
> 0.22
<1.8
>1.8
<1.8
>1.8
<1.8
>1.8
<1.8
>1.8
<1.8
>1.8
<1.8
Categoria
Cationi non acidi
Cationi flebilmente acidi
Cationi flebilmente acidi
Cationi debolmente acidi
Cationi debolmente acidi
Cationi moderatamente acidi
Cationi moderatamente acidi
Cationi fortemente acidi
Cationi fortemente acidi
Cationi estremamente acidi
Cationi estremamente acidi
Intervallo di
pKa
14.0 – 15.0
11.5 – 14.0
11.5 – 14.0
6 – 11.5
6 – 11.5
1-6
1-6
<1
<1
<< 1
<< 1
Esempi
Maggior parte dei cationi alcalini
Tl+
Maggior parte dei cationi alcalino-terrosi
Maggior parte dei cationi 2+ del blocco “d”
Tutti i cationi 3+ del blocco “f”
Maggior parte dei cationi 3+ del blocco “d”
Maggior parte dei cationi 4+ del blocco “f”
Maggior parte dei cationi 4+ del blocco”d”
La formazione degli idrossidi, è legata all’acidità dei
cationi.
La formazione di un idrossido (poco solubile) si ha una volta che via, via, gli idrogeni acidi sono rimossi
secondo lo schema seguente:
1) Il catione idrato perdendo un H+ idrolizza formando un idrosso-catione.
2) L’aggiunta di una base porta alla rimozione di altri protoni ed, ad un certo momento, alla
precipitazione per formazione di un idrossido.
3) Se il catione di partenza era sufficiente acido, altra base porta alla formazione di
idrossoanioni (l’idrossido di partenza è anfotero).
4) Il passo successivo, che richiede cationi ancora più acidi, è la formazione per ulteriore perdita
di protoni di un osso-anione.
I cationi, con un rapporto carica-raggio molto grande Z2/r >> 0.22, non esistono in soluzione
acquosa, nemmeno a pH fortemente acido. Sono presenti invece i loro osso-ioni.
Spesso gli idrossidi evolvono nel tempo agli ossidi corrispondenti per perdita d’acqua.
IL COMPORTAMENTO DEI CATIONI RISPETTO AGLI
IONI OSSIDRILE (OH-)
L’interazione degli ioni ossidrile con i vari cationi metallici può portare alla formazione dei
corrispondenti idrossidi (insolubili), in base alla seguente reazione:
Mn+(aq) + nOH-(aq) == M(OH)n(s)
nella quale il catione metallico si comporta da acido.
Poiché in acqua, in seguito all’autoprotolisi, gli ioni ossidrile sono sempre presenti (la loro
concentrazione dipende dal pH), alcuni di questi idrossidi metallici presentano caratteristiche
anfotere, e con un eccesso di base tornano in soluzione:
M(OH)n(s) + mOH-(aq) == [M(OH)n+m]m-
Spunto di lavoro : osservare criticamente l’effetto dell’ulteriore aggiunta di NaOH. Questo serve
per individuare quei cationi metallici che hanno comportamento anfotero.
Fare attenzione: per alcuni cationi metallici un’aggiunta iniziale eccessiva di idrossido può
vanificare la seconda aggiunta e rendere incomprensibile le osservazioni iniziali.
IL COMPORTAMENTO DEI CATIONI RISPETTO AGLI
IONI CARBONATO
I cationi trivalenti hanno un comportamento diverso da quelli mono- e bi- valenti.
Cationi bivalenti (rame(II), piombo(II), bario(II), nichel(II), zinco(II), ferro(II), stronzio(II), cobalto(II) ) e ione
argento(I).
Inizialmente si osserva la formazione dei carbonati secondo l’equilibrio:
M2+(aq) + CO32-(aq) == MCO3(s).
I carbonati di questi ioni sono, di solito, scarsamente solubili.
Cationi trivalenti (ferro(III) e alluminio(III)).
I cationi trivalenti sono più acidi dei cationi bivalenti e quindi aumenta l’importanza del equilibrio di idrolisi acida:
(a)
M3+(aq) + 2H2O(l)
[M(OH)2]+(aq)+ 2H+(aq)
Gli ioni H+ prodotti da questa reazione possono reagire con lo ione carbonato:
CO32-(aq)+ 2 H+(aq)
H2CO3(aq)
CO2(g) + H2O(l)
spostando in parte l’equilibrio (a) verso destra. La reazione complessiva che risulta dalla somma delle precedenti
sarà:
M3+(aq) + CO32-(aq) + H2O(l) == [M(OH)2]+ (aq) + CO2(g)
non è così spostata verso i prodotti da impedire completamente la formazione del carbonato secondo l’equilibrio:
3CO32-(aq) + M3+(aq)== M2(CO3)3(s)
ma lo è abbastanza da impedire la formazione di un vero e proprio precipitato come nel caso dei cationi bivalenti.
IL COMPORTAMENTO DEI CATIONI RISPETTO AGLI
IONI ALOGENURI.
Gli ioni alogenuri formano normalmente sali molto solubili, fatta eccezione per il
piombo e l’argento per i quali valgono le relazioni (X = Cl-,Br-,I-):
M2+(aq)+ 2X-(aq)
e
M+(aq)+ X-(aq)
MX2(s)
MX(s)
spostata quantitativamente dalla parte dei prodotti.
Molti degli ioni metallici formano deboli complessi con gli ioni alogenuri.
IL COMPORTAMENTO DEI CATIONI RISPETTO ALLA
SOLUZIONE di NH3.
L’ammoniaca, una base debole, reagisce con l’acqua formando ioni ammonio e
ossidrile:
NH3(g) + H2O(l)
NH4+(aq) + OH-(aq)
Gli ioni ossidrile, come già detto, reagiscono con i cationi per formare gli
idrossidi.
Inoltre l’ammoniaca (base di Lewis) forma complessi con molti cationi metallici.
Normalmente i complessi ammoniacali si formano per grandi concentrazioni di
ammoniaca, perciò è possibile che si abbia prima un precipitato (idrossido)
seguito dalla sua dissoluzione (formazione del complesso amminico)
REGOLE DI SOLUBILITÀ
1) I nitrati (NO3-), gli acetati (C2H3O2-), i clorati (ClO3-), e i
perclorati (ClO4-) sono sali solubili;
2) Tutti i sali di ammonio (NH4+) sono solubili;
3) Tutti i sali degli ioni del primo gruppo sono solubili;
4) I cloruri (Cl-), i bromuri (Br-), e gli ioduri (I-) sono sali solubili.
Fanno eccezione gli alogenuri d’argento (Ag+), di piombo (II) (Pb+2) e
di mercurio (I) (Hg2+2) che sono insolubili;
5) Tutti i solfati sono solubili ad eccezione di quelli di calcio (Ca+2),
stronzio (Sr+2), bario (Ba+2), piombo II (Pb+2), mercurio I (Hg2+2), e
argento (Ag+);
6) Tutti i carbonati (CO3-2), cromati (CrO4-2), ossalati (C2O4-2), e
fosfati (PO4-3) sono insolubili eccetto quelli del Gruppo I e d’
ammonio che sono solubili;
7) Tutti i solfuri (S-2) sono insolubili. Fanno eccezione quelli degli
elementi del Gruppo I e del Gruppo II che sono invece solubili;
8) Tutti gli idrossidi (OH-) e gli ossidi (O-2) sono insolubili con
l’eccezione di quelli degli elementi del primo e secondo gruppo.
IL COLORE DEI COMPLESSI (METALLI DI
TRANSIZIONE)
Un raggio di luce “bianca”, come quello che può essere prodotto dal filamento di tungsteno di
una comune lampadina a ~3300 °C, è costituito da radiazioni elettromagnetiche le cui frequenze
costituiscono una banda continua. Si può ottenerne lo spettro facendo incidere il raggio con un
prisma. Al nostro occhio solo una parte dello spettro della luce bianca è visibile ed esso appare
come in figura:
Andando dal rosso al violetto la frequenza della radiazione (n) elettromagnetica aumenta e
proporzionalmente aumenta l’energia dei fotoni (E=hn).
Se un raggio di luce bianca attraversa o è riflesso
da un corpo assorbente può apparire al nostro
occhio colorato. Il nostro occhio è in grado, infatti,
di riconoscere (rilevando un colore) quando alla
luce bianca mancano delle bande di frequenza che
cadono appunto nel “visibile”. Dallo schema della
figura che segue è possibile ricavare il colore della
luce assorbita: per esempio, se alla luce emergente
manca una banda di colore blu essa apparirà come
arancione (i due colori sono detti complementari) e
così via.
In generale l’assorbimento della radiazione elettromagnetica si ha quando
ad esso corrisponde una transizione tra due livelli energetici (elettronici nel
caso ci sia assorbimento nella regione del visibile) di un sistema
microscopico e il sistema alla fine è in uno stato “più eccitato” rispetto allo
stato di partenza.
Condizione minima perché si abbia la transizione elettronica tra due livelli
energetici è che sia rispettata la relazione:
dove ν è la frequenza della radiazione elettromagnetica monocromatica
(hν è l’energia dei singoli quanti di luce o fotoni della radiazione) e ΔE è la
differenza di energia tra i due livelli.
Il colore dei composti dei metalli di transizione.
Il colore di questi composti nella maggioranza dei casi può essere
attribuito a transizioni elettroniche che avvengono tra gli orbitali d.
Allo stato gassoso (cioè in assenza di perturbazioni) i livelli energetici
dei 5 orbitali d sono degeneri e nessun assorbimento luminoso può
avvenire. È quindi necessario trovare una spiegazione della perdita
della degenerazione da parte di questi orbitali quando lo ione
metallico è impegnato in composti di coordinazione.
Cerchiamo di capire cosa accade facendo riferimento al modello
teorico del “campo cristallino” (crystal field theory, CFT; l’acronimo
LFT si riferisce ad una teoria successiva detta del campo dei leganti),
illustrando il solo il caso particolare in cui la coordinazione attorno
allo ione metallico abbia geometria ottaedrica (6 leganti uguali
disposti regolarmente attorno al centro di coordinazione).
Immaginiamo di avere uno ione di uno dei metalli della prima serie di transizione Mn+
(che per definizione deve avere parzialmente riempiti gli orbitali d del guscio più esterno) e
che esso formi un complesso con 6 anioni monovalenti con geometria ottaedrica regolare:
M n 6 X MX 6( 6n )
La teoria del campo cristallino considera questi anioni come delle cariche (negative)
puntiformi. Si può così pensare che la stabilità del complesso sia dovuta alle interazioni
attrattive elettrostatiche tra lo ione metallico carico positivamente e i 6 leganti carichi
negativamente. Queste cariche negative, però, perturbano gli orbitali d facendone
aumentare l’energia a causa della repulsione elettrostatica che esse esercitano.
I vari orbitali sono influenzati in modo diverso a seconda di come essi sono orientati nello spazio.
Gli orbitali dz2 e dx2-y2, allineati
sugli assi, puntano direttamente
verso le cariche negative dei leganti
e subiscono una maggiore
repulsione.
Gli altri orbitali dxy, dyz e dxz sono
disposti lungo le bisettrici degli assi
cosicchè i loro lobi non puntano
verso i leganti.
Gli orbitali dz2 e dx2-y2 (detti eg ) saranno meno stabili degli orbitali degli orbitali dxy,
dyz e dxz (detti t2g).
E’ facile comprendere dalla loro geometria che gli orbitali t2g hanno la stessa energia;
più difficile è rendersi conto che i due eg sono a loro volta degeneri.
Basta però tenere conto che, formalmente, l’orbitale dz2 si
può ottenere dalla media di un orbitale dx2-z2 e un
orbitale dy2-z2 per darsi una giustificazione intuitiva.
La separazione tra le energie degli orbitali eg e t2g viene indicata con Δo (“o” sta per ottaedrico).
Il valore di Δo osservato è caratteristico del legante scelto. Per altre geometrie di coordinazione e
per diverso numero di leganti, gli orbitali d sono influenzati in modo differente e lo schema dei
livelli energetici degli orbitali d sarà diverso.
Una radiazione
elettromagnetica può
promuovere un elettrone
presente negli orbitali t2g agli
orbitali del livello eccitato eg
(se essi sono parzialmente
occupati o vuoti). Questa
transizione è alla base del
colore dei complessi dei metalli
di transizione.
Per piccoli valori di Δo il complesso assorbirà nel rosso ed apparirà blu – verde;
per grandi valori di Δo il complesso assorbirà nel violetto ed apparirà giallo-verde.
Lo ione Zn2+ ha configurazione (Ar)3d10 (è un “d10”) tutti gli orbitali d sono occupati e non da
complessi colorati (a meno non sia colorato il contro anione o il legante). Lo zinco, come cadmio
e mercurio, è infatti considerato impropriamente un elemento di transizione .
Colore dei cationi metallici idrati
Quarto periodo del blocco “d”
Ti3+
Violetto
V3+
Cr3+
Blu
Violetto (verde)
Cr2+
Blu
Mn2+
Rosa pallido
Fe3+
Giallo (Porpora pallido)
Fe2+
Verdino
Co2+
Rosa
Ni2+
Verde
Cu2+
Blu