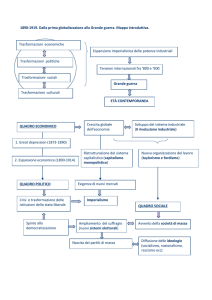
La struttura cristallina degli ossidi può essere in generale vista come quella
corrispondente a un reticolo di anioni di ossigeno nel quale i cationi si
dispongono negli interstizi.
1
Nella catalogazione delle strutture cristalline si fa riferimento a strutture tipiche
quali quella del salgemma (rock salt) e della wurzite.
Nell’allumina l’ossigeno (anione) ha struttura esagonale; l’alluminio occupa i
2/3 dei siti ottaedrici (per il bilancio della carica); la struttura base dell’α
-allumina è quindi un ottaedro.
2
La differenza tra la struttura della blenda e quella della fluorite dipende dalle
dimensioni del catione (dimensione dei siti interstiziali).
3
Molti cristalli a struttura perovskitica sono piezoelettrici ovvero una volta
sottoposti a sforzo meccanico manifestano una differenza di potenziale
elettrico (viceversa, se immersi in un campo elettrico si deformano
meccanicamente); il catione piccolo al centro del sito ottaedrico non sta
perfettamente in mezzo; in presenza di un campo elettrico si sposta e deforma
il cristallo; comprimendo il cristallo il catione si muove su direzioni
perpendicolari e genera una dipolo elettrico.
Alcuni cristalli a struttura perovskitica possono essere anche conduttori di
elettricità se lo ione tetravalente è sostituito da uno bi- o tri-valente.
Le strutture a spinello sono tipiche di molti materiali ferromagnetici.
4
A temperatura ambiente la silice cristallina (ossido di silicio, n° di
coordinazione = 4 e struttura non compatta) può esistere in tre forme
allotropiche (= uguale composizione chimica ma diversa struttura cristallina)
stabili. Altre forme allotropiche sono stabili ad elevata temperatura o ad alta
pressione.
Dal punto di vista tecnologico sono importanti le trasformazioni accompagnate
da elevato aumento di volume (che causano deformazioni ovvero sforzi e
quindi rotture).
Trasformazioni:
- reconstructive o ricostruttive: sono trasformazioni che avvengono per
nucleazione e accrescimento: sono quindi reazioni lente. Nel caso della silice
queste trasformazioni sono sostanzialmente irreversibili: quindi, una volta
ottenute trimidite o cristobalite non si torna più a quarzo se non in tempi
lunghissimi e in presenza di una fase fluida (anche H2O) per
ricristallizzazione.
- displacive o displasive: sono trasformazioni martensiticthe che avvengono
per rotazione del reticolo; sono quindi istantanee.
5
La cristobalite presenta la struttura della blenda invertita (con cationi in
struttura fcc).
La tridimite ha una struttura come quella della wurzite (con anioni in struttura
hcp).
Il quarzo ha una struttura come quella della wurzite ma con legami
leggermente ruotati. Nella trasformazione da quarzo α a quarzo β ruotano
leggermente i tetraedri.
6
Il tetraedro di silice è la base di moltissimi minerali detti silicati.
Tra questi:
Gli ortosilicati hanno struttura simile alla cristobalite (il cristallo è però
formato da tetraedri indipendenti collegati da cationi in ottaedri o cubi).
Sono composti tipici nei ceramici tradizionali. Importante nel diagramma A-S
è l’eutettico basso-fondente.
I metasilicati si dividono in pirosseni e anfiboli.
I pirosseni sono costituiti da catene singole di silicati. Gli anfiboli da catene
doppie (un esempio sono i minerali a base di amianto).
7
I feldspati possono essere di Na, Ca o K.
In questi parte del Si4+ è sostituito da Al3+. Di conseguenza gli ioni alcalini o
alcalino-terrosi (che bilanciano la carica) vanno a posizionarsi negli interstizi
ottaedrici.
Anche i feldspati sono importanti nella produzione di vetro e ceramici
tradizionali essendo causa di eutettici bassofondenti. L’albite fonde a 1118°C
mentre l’ortoclasio fonde in maniera incongruente a 1150°C; l’anortite fonde a
1553°C.
8