CORSO DI LAUREA SPECIALISTICA IN BIOTECNOLOGIE DEL
FARMACO
Valeria Benedusi
BIOTECNOLOGIE FARMACOLOGICHE
AA 2011-12
LEZIONE 18
Acidi nucleici e nuovi farmaci III
ACIDI NUCLEICI COME TERAPEUTICI
1. ANTISENSO: desossinucleotidi complementari con l’m-RNA
2. ANTIGENE: desossinucleotidi complementari al DNA
3. RIBOZIMA: ribonucleotidi catalalitici complementari a RNA
4. APTAMERI: desossi e ribonucleotidi complementari a una
sequenza aminoacidica (competono con l’RNA nella
interazione tra RNA e proteina)
5. DECOY:
DNA complementare a sequenze aminoacidiche
(competono con sequenze di DNA nell’interazione DNAproteina)
6. siRNA: RNA complementari a sequenze specifiche
RNA Interference: il processo attraverso il quale un
RNA a doppio filamento interferisce con
l’espressione genica:
sia inducendo la degradazione di RNA complementare
che bloccandone la traduzione
E’ un fenomeno comune in natura volto a proteggere
l’ospite da dsRNAs estranei (virus) o endogeni
(retrotrasposoni)
http://www.nature.com/focus/rnai/animations/index.html
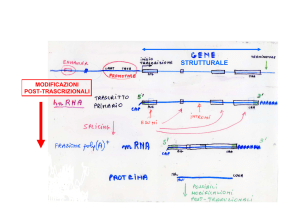
Silenziamento Post-trascrizionale (1990)
Jorgensen 1990:
Introduzione di transgeni responsabili della pigmentazione della
petunia per ottenere petunie più scure
pigmentazione ridotta del 40% nelle petunie transgeniche
ridotta espressione sia del gene endogeno che del transgene
(cosoppressione)
A variegated petunia. Upon injection of
the gene responsible for purple
colouring in petunias, the flowers
became variegated or white rather
than deeper purple as was expected.
1993: Vengono identificati i primi miRNA nel C. elegans (lin-4 e
let-7)
1998: Fire e Mello descrivono la presenza di RNA interference
nel C. elegans
1999: il silenziamento genico nelle piante è accompagnato
dall’accumulo di piccoli frammenti di RNA (20-25 Nt)
complementari al gene silenziato. dsRNAs vengono ridotti a
piccoli frammenti di 21-23 Nt
2001: Tuschl et al. dimostrano nella Drosophila che una piccola
sequenza di RNA può interferire in modo specifico con la
trascrizione
The Nobel Prize in Physiology or Medicine 2006
"for their discovery of RNA interference - gene silencing by double-stranded RNA"
Craig C. Mello
Andrew Z. Fire
Stanford University University
of Massachusetts
b. 1959
b. 1960
Small RNAs
miRNA
Prodotti in modo endogeno
Funzione: regolazione
dell’espressione genica
sopprimendo la traduzione o la
trascrizione di geni target
siRNA
Exo-siRNA:Introdotti in modo
esogeno (virus a dsRNA,
transposoni, transgeni)
Endo-siRNA: derivati da loci
genomici endogeni
Funzione principale: rispondere
alle minacce esterne
sopprimendo la trascrizione
genica dell’”invasore”
Interferenza basata su RNA (RNA interference)
Sono coinvolti nel processo:
Micro RNA (miRNA) precursori a forcina
Small interfering RNA (siRNA) (2 nt 3’ protrundenti)
Ribonucleasi DICER
RISC (RNA driven interference silencing complex) che
comprende: Argonauta, la proteina che srotola il doppio
filamento e la ribonucleasi che taglia la sequenza senso a 10-11
nt dal terminale 5’.
Mammalian RNAi biogenesis
Il complesso RISC attivato riconosce
sequenze complementari di RNA, le lega e
degrada: questo puo’ avvenire diverse volte
in quanto l’RNA antisenso, protetto dal
complesso proteico è stabile e in cellule che
si dividono lentamente puo’ agire per 3-7
giorni.
RNA lungo a doppio filamento
shRNA plasmidico
siRNA sintetico
a doppio filamento
miRNA endogeno
20-25 NT
Formazione del complesso RISC (RNA
induced silencing complex)
Amplificazione
RNA-dip RNA polimerasi
funzione
miRNA
Blocco traduzione
Complesso RISC attivato
funzione
siRNA
Formazione doppia elica con RNA complementare
e attacco di endonucleasi
Risc unwinds dsRNA,
the ribonuclease in the
Ribonuclease complex hydrolizes
new targets
LOCI NATURALI CHE GENERANO siRNA
Nature Reviews Genetics 2007, 8:884
Attività di siRNA a livello del nucleo
Metilazione di citosine in frammenti di DNA
complementari (descritta in vegetali)
Riorganizzazione della cromatina (descritto in lievito,
cellule vegetali e di insetto: siRNA determinano la
metilazione di istoni e la formazione di eterocromatina)
Excisione programmata di DNA in eccesso (protozoi)
RNA-directed DNA methylation (descritta in vegetali)
RNA interference-mediated heterochromatin assembly
siRNAs are thought to guide
histone methyltransferases
(HMTs) to the chromatin to
modify histone H3 on lysine 9
(H3K9). The methylated form
of H3 is bound by Swi6 or HP1,
which also associates with the
methyltransferases, to
maintain the silenced state. m,
methyl group.
Marjori A. Matzke & James A. Birchler
Nature Reviews Genetics 6, 24-35 (January 2005
si RNA – caratteristiche
RNA a doppia elica di 21-23 nt
Presenza di terminale 3’ più lungo di 2nt
Presenza di gruppi OH in 3’
Presenza 5’ fosfato
Alta stabilità nella porzione 5’ senso(ricco in GC)
Bassa stabilità nella porzione 5’ antisenso(ricco UA)
Bassa stabilità nella zona centrale dove deve avvenire l’attacco della endonucleasi
2’ desossitimidina per proteggere siRNA da attività esonucleasiche
Non deve essere complementare a zone introniche
Complementare a una porzione di RNA a non più di 75 basi da codone di inizio trad.
si RNA – caratteristiche
siRNA possono diffondere per brevi e lunghe distanze
Piante: siRNAs prodotti da Dicer-like 4 nel floema
raggiungono 10-15 cellule fuori dal floema dove
possono originare dsRNA (attraverso una RNA Pol
RNA dip) che vengono processati in siRNAs secondari
che propagano il silenziamento con un processo di
amplificazione
Animali: trasporto attraverso vescicole secretorie
(esosomi)
CELLULE HeLa
In rosso: siRNA marcato
In blu: nuclei
In verde la proteina GAPDH
si RNA non specifico
Trattamento: 48h
si RNA contro GAPDH
siRNA come agenti terapeutici
LA DISTRIBUZIONE
Problematiche tipiche delle molecole di grandi
dimensioni e che sono altamente polari
Difficoltà ad ottenere distribuzione tessuto
specifica
Degradazione dovuta a RNasi circolanti
Ideale per applicazione topica (occhi, derma, tumori
localizzati)
siRNA come agenti
terapeutici
LA
SOMMINISTRAZIONE
siRNA come agenti terapeutici
LA SOMMINISTRAZIONE
1. Applicazione topica: instillazione di gocce, aerosol,
iniezione intratumorale
2. Somministrazione sistemica:
a. iv (molecole di circa 5nm riescono a passare le
membrane, fino a 200 nm passano solo capillari
fenestrati : uso di nanocarrier)
b. RNA di sintesi modificati per migliorarne la
farmacocinetica
c. Utilizzo di vettori virali e non per esprimere l’RNA
della cellula bersaglio
siRNA come agenti terapeutici
LA SOMMINISTRAZIONE
Modificazione delle molecole di siRNA per una
distribuzione più efficiente
modificazioni per evitare le difese immunitarie
(modificazione con 2’-o-metile nel filamento
antisenso)
fosforotionati per bloccare esonucleasi
coniugazione con peptidi, colesterolo, PEG
Metodi di somministrazione:
FISICI
Iniezione idrodinamica: efficace in epatociti ma invasiva
Elettroporazione: campo elettrico che facilita la transfezione
di acidi nucleici, utilizzata in vivo nel muscolo, retina, giunture
artritiche e tumori
DI CONIUGAZIONE
Carrier mediated methods
Stable nucleic acid
lipid particle
BIODISTRIBUZIONE
Anton P. McCaffrey*, Leonard Meuse*,
Thu-Thao T. Pham*, Douglas S. Conklin†,
Gregory J. Hannon†, Mark A. Kay*
Nature, 2002
siRNA IN STUDI CLINICI
Potenziali effetti collaterali della terapia con siRNA:
1. Attivazione del sistema immunitario
2. Effetti off-target
3. Saturazione di vie di silenziamento endogene (miRNA)
Similarità e differenze con oligonucleotidi antisenso
Similarità:
- lunghezza
- metodologia di delivery comune
- induzione di silenziamento genico a livello
post-trascrizionale
- digestione di RNAm bersaglio da parte di
endonucleasi
- possibilità di stabilizzazione con basi
modificate
- similarità nella biodistribuzione
Differenze:
- doppio filamento contro singolo filamento
- maggiore stabilità della molecola naturale
- maggiore efficacia in cellule in coltura
- meccanismo di azione mediato da RISC
FUNZIONI FISIOLOGICHE DEI miRNA
Mantenimento dell’identità cellulare (es. pluripotenza)
L’identità cellulare viene mantenuta silenziando mRNAs che non
appartengono allo specifico repertorio della cellula
Network di miRNA che controllano specifici pathway (miR-21
regola miRNA che controllano apoptosi: disregolazione di miR21 cancro. miRNA che controllano la via di segnale dell’insulina,
diverse tipologie cellulari hanno maggiore o minore necessità di
glucosio quindi il funzionamento di questo network di miRNA è
regolato a seconda della tipologia cellulare)
miRNA e cancro
Tumori: pattern specifico di espressione dei miRNA che permettono di
discriminare i diversi tipi di cancro e di identificare il tessuto di origine delle
metastasi
Network trascrittoma-microRNA nel cancro
miRNA e cancro
miRNA oncogeni: miRNA overespressi nei tumori (es. miR-155 è upregolato in
tumori maligni del sistema ematopoietico, della mammella, del polmone e del
pancreas, miR-380-5p reprime p53 nel neuroblastoma, antagonizzandolo con
un oligonucleotide antagonista migliora la prognosi) blocco dei miRNA con
oligonucleotidi antisenso
miRNA oncosoppressori: miRNA ridotti o mancanti nei tumori. La loro
overespressione limita la proliferazione o induce apoptosi (es. miR-15a-16-1,
downregolato in cellule B di pazienti con leucemia linfocitica cronica, adenoma
della prostata e dell’ipofisi) miRNA mimics o vettori virali
Strategie per terapie anti-cancro basate su miRNA:
1. Bloccare miRNA oncogeni usando oligonucleotidi
antisenso
2. Ripristinare l’espressione di miRNA oncosoppressori
3. Riprogrammare le cellule cancerogene
Limiti e vantaggi della terapia con miRNA
Riferimenti bibliografici
Chapman E and Carrington J. Specialization and evolution of endogenous small RNA pathways.
Nature Rewievs Genetics 2007, 8:884
Iorns E et al. Utilizing RNA interference to enhance cancer drug discovery. Nature Rewievs
Drug Discovery 2007, 6:556
Kawakami S. and Hashida M. Targeted delivery of small interefering RNA by systemic
administration.
Drug Metab. Pharmacokin 2007, 22: 142
Kathryn A. Whitehead, Robert Langer & Daniel G. Anderson Knocking down barriers: advances
in siRNA delivery. Nature Reviews Drug Discovery 8, 129-138 (February 2009)
Carthew et al., Origins and mechanisms of miRNAs and siRNAs. Cell vol 136, Feb 2009
Garzon et al., Targeting microRNAs in cancer: rationale, strategies and challenges. Nat
reviews vol 9 (2010)
Semple et al., Rational design of cationic lipids for siRNA delivery. Nat Biotech vol 28 Feb.
2010
Kosik et al., MicroRNAs and cellular Phenotipy, Cell vol 143, 2010