L’equivalente meccanico del calore
•
•
•
•
Abbiamo definito la caloria come la quantità di calore
necessaria per innalzare la temperatura di un grammo
di acqua da 14.5°C a 15.5°C alla pressione
atmosferica.
Lo stesso cambiamento di stato si ottiene anche
effettuando solo del lavoro adiabatico
Joule esegui una seria di esperimenti come quello
mostrato in figura con cui determinò
L’equivalente meccanico del calore, ossia la relazione
tra la caloria e l’unità di misura del lavoro,J.
M
Mulinello
1 caloria = 4.1858 J
G.M. - Edile A 2002/03
Il calore dipende dalla trasformazione
•
•
•
•
Il primo principio stabilisce che
DU=Q-W
DU non dipende dalla trasformazione
W dipende dalla trasformazione (dW non è un differenziale esatto, dW )
Anche Q dipende dalla trasformazione (dQ non è un differenziale esatto, dQ)
•
Per una trasformazione infinitesima
dU= dQ - dW
•
Esistono due eccezioni
– Le trasformazioni a lavoro nullo (a volume costante)
– Le trasformazioni a pressione costante
•
per queste trasformazioni il calore è una funzione di stato, dipende solo dallo
stato iniziale e da quello finale.
G.M. - Edile A 2002/03
Il calore nelle trasformazioni a volume
costante
•
Il lavoro può essere valutato utilizzando i parametri dell’ambiente esterno sia
per una trasformazione reversibile che per una irreversibile.
W=Pe(Vf-Vi)
•
Ma Vf=Vi
•
Allora
(volume costante)
DU=Q
W=0 (lavoro nullo)
(per una trasformazione infinitesima dQ= dU)
– il calore scambiato nella trasformazione a volume costante è uguale alla variazione
di energia interna
– Poiché l’energia interna è una funzione di stato,
• Anche il calore in questo caso è una funzione di stato
•
Conseguenza
– Il calore scambiato in una trasformazione a volume costante (lavoro nullo) dipende
solo dallo stato iniziale e da quello finale e non dipende dalla particolare
trasformazione
– Il calore scambiati sulla trasformazione irreversibile è uguale a quello scambiato
sulla trasformazione reversibile.
G.M. - Edile A 2002/03
Il calore nelle trasformazioni a pressione
costante
•
•
•
Anche in questo caso il lavoro può essere valutato utilizzando i parametri
dell’ambiente esterno sia per una trasformazione reversibile che per una
irreversibile.
W=Pe(Vf-Vi)= PfVf-PiVi
Essendo Pf=Pi=Pe
Per il I principio della termodinamica
DU=Q-W
Q= DU+W= DU+ PfVf-PiVi=Uf-Ui + PfVf-PiVi=(Uf + PfVf)-(Ui + PiVi)
•
La grandezza H= U + PV
•
•
è una funzione di stato (entalpia)
Q= DH
Anche in questo caso il calore scambiato è una funzione di stato.
È lo stesso sia per una trasformazione reversibile che per una irreversibile
•
Per una trasformazione infinitesima
dQ= dH
G.M. - Edile A 2002/03
I calori specifici a volume e pressione
costante
•
Tornando alla definizione di calore specifico
Calore specifico a volume costante
c
1 dQ 1 dU
m dT m dT V cos t
Calore specifico a pressione costante
c
•
•
1 dQ 1 dH
m dT m dT Pcos t
Calore molare a volume costante
CV
1 dQ 1 dU
n dT n dT V cos t
Calore molare a pressione costante
CP
1 dQ 1 dH
n dT n dT P cost
Appare che è possibile esprimere i calori specifici a volume e pressione
costante in termini delle funzioni di stato U e H,
Non dipendono dalla trasformazione (purché a volume o a pressione
costante)
– La trasformazione potrà essere reversibile o irreversibile il risultato è identico.
G.M. - Edile A 2002/03
Il gas perfetto
•
I gas
– Monoatomici (i gas nobili: He,Ne,
Ar, Kr, Xe)
– Biatomici (H2, O2, N2)
– Poliatomici (C O2, H2O,…)
•
•
Si comportano come gas perfetto in
condizione di bassa densità
Un gas perfetto è un gas che in ogni
condizioni soddisfa l’equazione di
stato di un gas perfetto
PV=nRT
R 0.08205
•
•
Legge di Boyle PV=cost a T=cost
Legge di Charles, Gay-Lussac:
V1=Vo(1+btC)
b coefficiente di dilatazione di
volume 1/273.15 per tutti i gas (in
condizioni di gas perfetto)
•
Legge di Avogadro: volumi uguali
di gas nelle stesse condizioni di
pressione e temperatura contengono
lo stesso numero di molecole.
litri atm
joule
cal
8.314
1.986
mole K
mole K
mole K
G.M. - Edile A 2002/03
L’energia interna del gas perfetto
•
•
L’espansione libera
La trasformazione è irreversibile
– Non c’è equilibrio meccanico
– La pressione è diversa nei due
contenitori
•
•
•
Vuoto
Gas
Pe
fig. A
Per calcolare il lavoro dobbiamo usare i parametri
dell’ambiente:
W=PeDV
DV è la variazione del volume su cui agisce la pressione
esterna (=0 contenitore con pareti rigide)
Temperatura iniziale
=
Facendo avvenire l’espansione in un calorimetro
– Se il gas si comporta come un gas perfetto
•
•
•
Ti=Tf
Il calore scambiato con il calorimetro è nullo (Q=Cap_terDT)
DU=Q-W=0
U(T,V1)=U(T,V2)
U non dipende da V ma solo da T.
Temperatura finale
=
G.M. - Edile A 2002/03
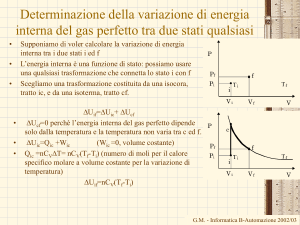
Determinazione della variazione di energia
interna del gas perfetto tra due stati qualsiasi
•
Supponiamo di voler calcolare la variazione di energia
interna tra i due stati i ed f
L’energia interna è una funzione di stato: possiamo usare
una qualsiasi trasformazione che connetta lo stato i con f
Scegliamo una trasformazione costituita da una isocora,
tratto ic, e da una isoterma, tratto cf.
•
•
P
Pf
Pi
f
i
Vi
•
•
•
DUif=DUic+ DUcf
DUcf=0 perché l’energia interna del gas perfetto dipende
P
solo dalla temperatura e la temperatura non varia tra c ed f.
DUic=Qic +Wic
(Wic =0, volume costante)
Pf
Qic =nCVDT= nCV(Tf-Ti) (numero di moli per il calore
Pi
specifico molare a volume costante per la variazione di
temperatura)
DUif=nCV(Tf-Ti)
f
i
Vf
V
c
f
i
Vi
f
i
Vf
V
G.M. - Edile A 2002/03
La relazione di Mayer
CV
•
•
1 dU
n dT V
Per un gas perfetto
H=U(T)+nRT
CP
1 dH
n dT P
dove H U PV
PV=nRT
(H(T))
1 dH
1 dU(T) nRT
1
d U(T)
CP
nR C V R
n dT P n
dT
n
dT P
P
Dato ch e U no n dipende da P
fare la derivata risp etto aT
a pressio ne co stan te o a vo lume
costante è la stessa co sa
:
=C V
• Gas monoatomici
C
C R 5
3
5
P V
1.6
CV R CP R
C
C
3
2
2
V
V
•
Gas biatomici
5
7
CV R CP R
2
2
CP C V R 7
1.4
CV
CV
5
G.M. - Edile A 2002/03
L’equipartizione dell’energia
N
U
i1
1
K i N K N m
v2x v2y v 2z
N Kx Ky Kz
2
energia
è la so m ma dei v alori m edi
lungo i tre assi, che p eraltro so no
cinetica
m edia
uguali.
Kx
1
1
m v2x kT
2
2
U N Kx Ky Kz
k costante di Boltzmann
NA k = R
1
1 3
3
3
1
N kT kT kT NkT nN A kT nRT
2
2
2 2
2
2
3
1 dU 1 d2 nRT 3
CV
2R
n dT n dT
CP CV R 32 R R 52 R
G.M. - Edile A 2002/03
Gas biatomici
•
•
•
•
I gradi di libertà di una molecola biatomica
3 di traslazione (x,y,z)
2 di rotazione (lungo i due assi perpendicolare
alla congiungente i due nuclei
2 di oscillazione (energia cinetica e potenziale)
7
7
U N kT n RT
2
2
7
1 dU 1 d2 nRT 7
CV
2R
n dT n dT
•
•
•
È come se ci fossero delle
soglie
Solo al di sopra di una certa
energia media si attivano i
gradi di libertà della rotazione e
quelli della oscillazione
Comportamento non spiegabile
con la meccanica classica
G.M. - Edile A 2002/03
•
•
Appli
cazio
ne
Una quantità di gas ideale monoatomico alla temperatura di 10.0°C e a una
pressione di 100 kPa occupa un volume di 2.50 m3. Il gas viene riscaldato a
volume costante fino a quando la pressione diventa 300 kPa .
Determinare il calore assorbito dal gas e la variazione di energia interna.
P
PV nRT
N
100 10 2 2.50m 3
P1Vo
m
n
106.2mol
J
RT1 8.314
273.15 10.0K
mol K
3
P2
P1
N
300 103 2 2.50m 3
PV
m
T2 2 o
849.4K
J
nR
8.314
106.2mol
mol K
W0
DU Q
Vo
V
T
T+dT
3
J
DU nC VDT 106.2mol 8.134
849.4 283.15K
2
mol K
733.7kJ
G.M. - Edile A 2002/03
•
•
Una quantità di gas ideale biatomico alla temperatura di 0.0°C e a una pressione
di 100 kPa occupa un volume di .50 m3. Il gas viene riscaldato a pressione
costante fino a quando il volume raddoppia.
Determinare il calore assorbito dal gas, la variazione di energia interna, il lavoro
effettuato.
P
PV nRT
N
3
.50m
2
PVi
m
n
22.0mol
J
RT i 8.314
273.15K
mol K
100 103
N
100 103 2 1.00m 3
PVf
m
Tf
546.7K
J
nR 8.314
22.0mol
mol K
Appli
cazio
ne
P
Vi
Vf
V
W PVf Vi 100 10 Pa 1.00 .50 50kJ
3
5
J
DU nC VDT 22.0mol 8.134
546.7 273.15K
2
mol K
d
122.4kJ
7
J
Q nC P DT 22.0mol 8.134
546.7 273.15K 171.4kJ
2
mol K
G.M. - Edile A 2002/03
•
Appli
cazio
ne
Calcolate il lavoro svolto da un agente esterno durante una compressione
isoterma di una certa quantità di ossigeno da un volume di 22.4 L alla
temperatura di 0.00°C e 1 bar di pressione a un volume di 16.8L.
N
3 3
22.4
10
m
2
PVi
m
n
0.99mol
J
RT i 8.314
273.15K
mol K
105
P
Pf
Isoterma
Pi
W
dW PdV
f
PdV
i
f
i
nRT
dV nRT
V
f
i
dV
V
nRT logV i nRT logV f logV i nRTlog
f
Vf
Vi
V
PV nRT
Vf
Vi
Vf
J
16.8
W nRTlog
1mol 8.314
273.15Klog
639.17J
Vi
molK
22.4
DU 0
DU Q W
QW
West W 639.17J
G.M. - Edile A 2002/03
•
Una certa massa di gas occupa un volume di 4.3 L a una pressione di 1.2 bar e
una temperatura di 310 K.
Essa viene compressa adiabaticamente fino a un volume di 0.76 L.
Determinare la pressione finale e la temperatura finale supponendo che si tratti
di un gas ideale per il quale =1.4.
•
•
•
•
Dobbiamo innanzitutto determinare l’espressione di una adiabatica reversibile.
Troveremo infatti che l’adiabatica reversibile vale
PV nRT
PV cos t
•
Appli
cazio
ne
O una equazione che deriva da questa utilizzando l’equazione di stato
PV
1
nRT
1
V cos t TV cos t
V
P V P
1
nRT
cost TP
P
1
1
cost
G.M. - Edile A 2002/03
Le trasformazioni del gas perfetto:
adiabatica
reversibile
•
P
Consideriamo un tratto infinitesimo di adiabatica
reversibile
dU dQ dW
dQ 0
dU nC V dT
dW PdV
Adiabatica
Pi
dU dW
Pf
Vi
Vf
nC VdT PdV
nC VdT
V
1
nRT
dV
V
CV
dT
dV
C P CV T
V
dT
dV
CP
T
V
1
CV
1 dT
dV
1 T
V
G.M. - Edile A 2002/03
Le trasformazioni del gas perfetto:
adiabatica
reversibile
P
1 dT
dV
1 T
V
•
Adiabatica
Pi
Sommiamo su tutti i tratti infinitesimi
f
i
1 dT
1 T
f
i
dV
V
1
Tf 1
Vi
log
log
Ti
Vf
1
Tf Vf
1
Ti Vi
1
T
V
log f log f
1
Ti
Vi
1
Tf 1 Vi
Ti
Vf
Pf
Vi
Vf
Tf Vi
Ti Vf
V
1
TV 1 cos t
G.M. - Edile A 2002/03
•
•
•
•
Appli
cazio
ne
PV nRT
Una certa massa di gas occupa un volume di 4.3 L a una pressione di 1.2 bar e
una temperatura di 310 K.
Essa viene compressa adiabaticamente fino a un volume di 0.76 L.
Determinare la pressione finale e la temperatura finale supponendo che si tratti
di un gas ideale per il quale =1.4.
L’ adiabatica reversibile vale
PV cos t
Pf Vf Pi Vi
1.4
V
4.3
5
13.56bar
Pf Vf Pi i 1.2 10
0.76
Vf
1
Tf Vf
1
Ti Vi
Pi Vi nRTi
Pf Vf nRT f
Vi
Tf Ti
Vf
1
4.3
310K
0.76
0.4
620K
Pf Vf
Tf Ti
Pi Vi
13.56bar 0.76L
Tf 310K
619.1K
1.2bar 4.3L
G.M. - Edile A 2002/03
•
•
In figura sono illustrate le quattro trasformazioni reversibili (isocora, isobara,
isoterma ed adiabatica) subite da una certa quantità di gas ideale.
Identificate le quattro trasformazioni e poi ordinatele
– secondo i valori decrescenti del calore assorbito dal gas
– secondo i valori decrescenti del lavoro effettuato dal gas
– secondo i valori decrescenti della variazione di energia interna
•
–
–
–
–
•
•
•
•
•
Secondo valori decrescenti del lavoro
effettuato (area al di sotto della
trasformazione)
1
2
3
4
Isobara
Isoterma
Adiabatica
Isocora
Secondo valori decrescenti della
variazione di energia interna
DU=nCVDT
– 1 Isobara
– 2 Isoterma
– 3 Adiabatica, 4 Isocora a pari
merito
•
Appli
cazio
ne
PV nRT
1
2
3
4
Isobara
Isoterma
Adiabatica
Isocora
Secondo valori decrescenti del calore
assorbito Q= DU+W
–
–
–
–
1
2
3
4
Isobara (Q= DU+W)
Isoterma (Q=W)
Adiabatica, (Q=0)
Isocora (Q<0)
G.M. - Edile A 2002/03
L’adiabatica ha una pendenza più elevata
della isoterma passante per lo stesso stato
PV Po Vo
PV
P o o
V
Po Vo
P
V
per l' isoterma
per l' adiabatica
•
•
•
•
PV Po Vo
P
Po
Isoterma
dP
P
1
Po Vo 2
o
V V
dV Vo
Vo
o
1
dP
V
Po Vo 2
dV Vo
V
Vo
Adiabatica
Vo
o
V
Po
Vo
Tutte e due le pendenze sono negative
L’adiabatica ha una pendenza che è volte quella dell’isoterma
Ma è maggiore di 1 (CP>CV)
La pendenza dell’adiabatica in valore assoluto è più grande di quella
dell’adiabatica
G.M. - Edile A 2002/03
•
Un gas monoatomico ideale, a una temperatura iniziale To (in Kelvin) si espande
da un volume Vo ad un volume 2Vo per mezzo di uno dei cinque processi indicati
nel grafico delle temperature in funzione del volume mostrato in figura.
– In quale processo l'espansione è
• isoterma
• isobara (pressione costante)
• adiabatica
Appli
cazio
ne
– Date una spiegazione alle vostre risposte.
•
•
Isoterma trasformazione AE
Isobara trasformazione AC
PVo nRTo
P2Vo nRT1
T1 2To
•
Adiabatica trasformazione AF
T1 2Vo
1
1
To Vo
T1
To
To
1
1.661 .63To
2
2
G.M. - Edile A 2002/03
•
•
•
•
•
Un gas ideale subisce una compressione adiabatica reversibile da P=1.0 bar,
Appli
V=1.0 106 litri, T=0.0 °C a P= 1.0 105 bar, V=1.0 103 litri.
Si tratta di un gas monoatomico, biatomico o poliatomico?
cazio
Qual è la temperatura finale?
ne
Quante moli del gas sono presenti?
Qual è l’energia cinetica traslazionale per ogni mole prima e dopo la
compressione?
Pi
V
Pi
V
f log log f
PiVi PfVf
Pf Vi
Pf
Vi
Pi
1
log
log 5
Pf
log105 5 log10 5
10
1.66
Vf
103 log103 3 log10 3
log
log 6
Vi
10
Po Vo
105 Pa 10 3 m 3
• Il gas è monoatomico
Po Vo nRT o n
44000mol
RTo 8.31 J 273.15K
molK
PV
Tf f f
nR
Tf K
101 0 Pa 1m 3
Tf
27349K
J
8.31
44000mol
molK
3
kT
2
Kmol NA
3
3
3
kT RT 8.31 273.15 3404J
2
2
2
G.M. - Edile A 2002/03