Si ricavano informazioni dallo studio delle proprietà magnetiche dei nuclei
Risonanza
magnetica
di spin
nucleare
Radiofrequenze: per esempio
= 600 MHz B = 14 T
TIPI di SPETTROSCOPIA
NMR
IR
UV-VISIBILE
Le radiofrequenze possono determinare un cambiamento dello spin
nucleare. Questo fenomeno è noto come risonanza magnetica nucleare.
La risonanza magnetica nucleare (NMR) è una tecnica
spettroscopica
l’interazione
che
tra
come
l’IR
radiazione
e
l’UV
prevede
elettromagnetica
e
materia con conseguente assorbimento di energia e
quindi passaggio della materia da uno stato a più
bassa energia ad uno a più alta energia.
Interazione radiazione
elettromagnetica/materia
• Che cosa succede quando un campione assorbe radiazioni UV?
Passaggio di un elettrone da un
orbitale molecolare di legame
ad uno di antilegame nello stato eccitato
UV
• Che cosa succede quando un campione assorbe
radiazioni Rf (radio frequenze) in un esperimento
NMR?
Nuclei cambiano disposizione e
spin (da parallela ad
antiparallela)
{B0 = campo magnetico esterno}
Antiparallela al campo
Rf
(100’s MHz)
Parallela al campo
B0
L’NMR si differenzia dall’IR e dall’UV in quanto
mentre in queste ultime misuriamo l’assorbimento di
energia da parte della materia nel passare da un
livello fondamentale ad un livello eccitato che sono
preesistenti, nell’NMR creiamo artificialmente 2 o più
livelli energetici e successivamente andiamo a
misurare la frequenza di assorbimento conseguente
al passaggio della materia da uno stato a più bassa
energia ad uno stato a più alta energia.
Nell’NMR sottoponiamo il nucleo all’influenza di un
campo
magnetico
esterno.
Ciò
determina
una
differenza di energia tra i due stati di spin del nucleo
(creiamo in questo modo i livelli energetici). Quando
investiamo il nucleo con una radiazione di opportuna
frequenza (siamo nella regione delle radiofrequenze),
si ha assorbimento che comporta una transizione dello
spin nucleare.
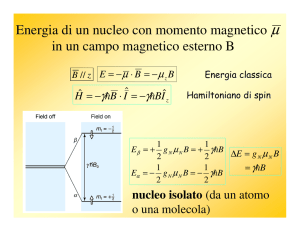
Lo spin nucleare
Ciascun nucleo oltre ad essere caratterizzato da un numero di massa ed un
numero atomico possiede anche un MOMENTO ANGOLARE P che è una
grandezza quantizzata ed è dovuto alla rotazione del nucleo intorno al
proprio asse. Il moto circolare genera un dipolo magnetico lungo l’asse. Il
campo magnetico generatosi è caratterizzato da un momento angolare o
momento di spin P.
P
P= h I
2p
I= numero di spin
valori= 0, ½, 1, e così via fino a 6.
Quando I=O non si ha rotazione
P caratterizza il movimento del
nucleo intorno al proprio asse, e
il numero di spin I è un indice
dell’intensità di questo momento
angolare.
Il valore di I dipende dal valore della massa
atomica (somma di protoni e elettroni) e del
numero atomico (numero di protoni).
I
Massa atomica
N. atomico
Esempio
Semi-intero
dispari
dispari o pari
1
H
1
(1/2) 157N(1/2) 178O (5/2)
Intero
pari
dispari
2
H
1
(1)
Zero
pari
pari
12
C(0)
6
14
N(1)
7
16
O
8
(0)
I nuclei più interessanti all’NMR sono quelli che hanno
I=1/2 come ad esempio: 1H, 13C, 15N
I=0
il
nucleo
può
essere
assimilato
ad
una
sfera
con
la
carica
uniformemente distribuita sulla superficie e immobile nello spazio: non si ha
alcun moto di rotazione
I=1/2
il nucleo
può
essere
assimilato
ad
una
sfera
con
la
carica
uniformemente distribuita sulla superficie che in questo caso ha un moto di
rotazione attorno ad un asse. Nuclei di questo tipo sono assimilabili ad una
spira percorsa da corrente quindi ad un piccolo magnete caratterizzato da
un momento magnetico nucleare m.
Il fenomeno dell’NMR interessa tutti e solo quegli isotopi che hanno I >O in
quanto la rotazione genera un momento magnetico nucleare m che può
interagire con un campo magnetico esterno.
Il m associato alla rotazione del nucleo è proporzionale al momento
angolare P
La costante di proporzionalità tra il momento magnetico m ed il momento
angolare nucleare P è detta costante giromagnetica
m
m=gP
m
+
+
g= rapporto giromagnetico
mz = g h
2p
m
I
L’NMR si basa sull’interazione tra il momento
magnetico nucleare ed un campo magnetico esterno
e può, quindi, essere utilizzato solo se I≠0.
Il momento magnetico m è quantizzato e può assumere
nello spazio solo un numero limitato di orientazioni. Tali
orientazioni sono determinate dal numero quantico
magnetico m che a sua volta varia in funzione di I. In
generale il numero delle orientazioni è dato da: 2I+1.
Pz = m
z
_
+h
12
0
_ _h
12
I = 1/2
I=1
Il numero quantico m può assumere i valori -I,-I+1,….., +I-1, +I.
Gli isotopi più abbondanti del C e dell’ O non possiedono spin.
1H
Elemento
2H
12C
1/2
1
0
1/2
2
3
0
2
Numero quantico
di spin
( I )
Orientazioni
13C
14N
16O
17O
19F
1
0
5/2
1/2
3
0
6
2
Elementi con numero di massa o numero atomico dispari sono dotati di “spin
nucleare”.
Quando
I=1/2 (come nel caso dell’1H e del 13C) si ha mI=±1/2 che
rappresentano le due diverse orientazioni che m può assumere.
Quando
il nucleo è messo in presenza di un campo magnetico, le due
orientazioni hanno diversa energia: se il momento magnetico m è “parallelo”
(nucleo nello stato +½ o a) al campo magnetico si ha una interazione
favorevole tra i due, e l’energia del nucleo scende; se invece m è
“antiparallelo” (nucleo nello stato -–½ o b) l’interazione è sfavorevole e
l’energia del nucleo sale.
Alta energia b
Bo
Bassa energia a
Stato fondamentale
Stato eccitato
Ci sono più nuclei nello stato a che nello stato b. La
differenza di popolazione è molto piccola (20 protoni su
un milione) ma è sufficiente a fornire le basi per la
spettroscopia NMR.
La differenza di E fra i due stati di spin (a e b) dipende dal campo esterno
Sono necessari forti campi magnetici. L’unità usata è il Tesla. Il campo
magnetico terrestre al livello della superficie è 10-4 T. Nell’NMR si usano
campi da 1 a 20 T. Anche con campi così forti la DE è solo di 0.1 cal/mol
La differenza tra i due stati
di spin dipende dalla forza
del campo applicato
b spin
state
randomly
oriented nuclei
(no magnetic field)
DE
200 MHz
for 1H
Energia
DE
400 MHz
for 1H
a spin
state
0
4.7
High Field NMR
• increased sensitivity
9.4
• increased resolution
Forza del campo magnetico, B0 (Tesla)
La differenza di Energia dipende da B0 e g
Le due orientazioni degeri vengono divisi in due con differente energia
nel momento in cui si applica un campo magnetico
- 1/2
DE = g h Bo
2p
Degeneri a
B0 = 0
DE: la quantità di
energia
che
è
necessaria per far
variare il numero di
spin
+ 1/2
B0
g è detta costante giromagnetica e varia da nucleo a nucleo
Quando il campione è sottoposto ad un impulso di radiazione
elettromagnetica la cui energia corrisponde alla differenza di energia DE tra
gli stati di spin a e b, i nuclei nello stato di spin a sono promossi nello stato
di spin b. Questa transizione è chiamata “inversione” dello spin.
quantizzata
Opposta
-1/2
-1/2
DE
DE = h
Radiofrequenza
+1/2
B0
Allineata
+1/2
poiché DE = h
Frequenza della
radiazione che in
grado di operare una
transizione
=
g
2p
Rapporto
giromagnetico g
Bo
Campo magnetico
applicato
g è una costante per ciascun nucleo (H, C, N, etc)
DE = h= g h Bo
2p
=
g
2p
Bo
1H
13C
g = 2.675 x 108 T-1s-1
g = 6.688 x 107 T-1s-1
Se uno spettrometro NMR è equipaggiato con un magnete che genera un
campo magnetico B0 di 7.046 T a che frequenza opera lo spettrometro
(nel caso dell’1H)?
=
2.675 x 108
2 (3.1416)
T-1s-1 x 7.046 T = 300 x 106 Hz = 300 MHz
Frequenze degli spettrometri
NMR
B0
400 MHz
9.6 T
500 MHz
12 T
600 MHz
14.4 T
900 MHZ
21.6 T