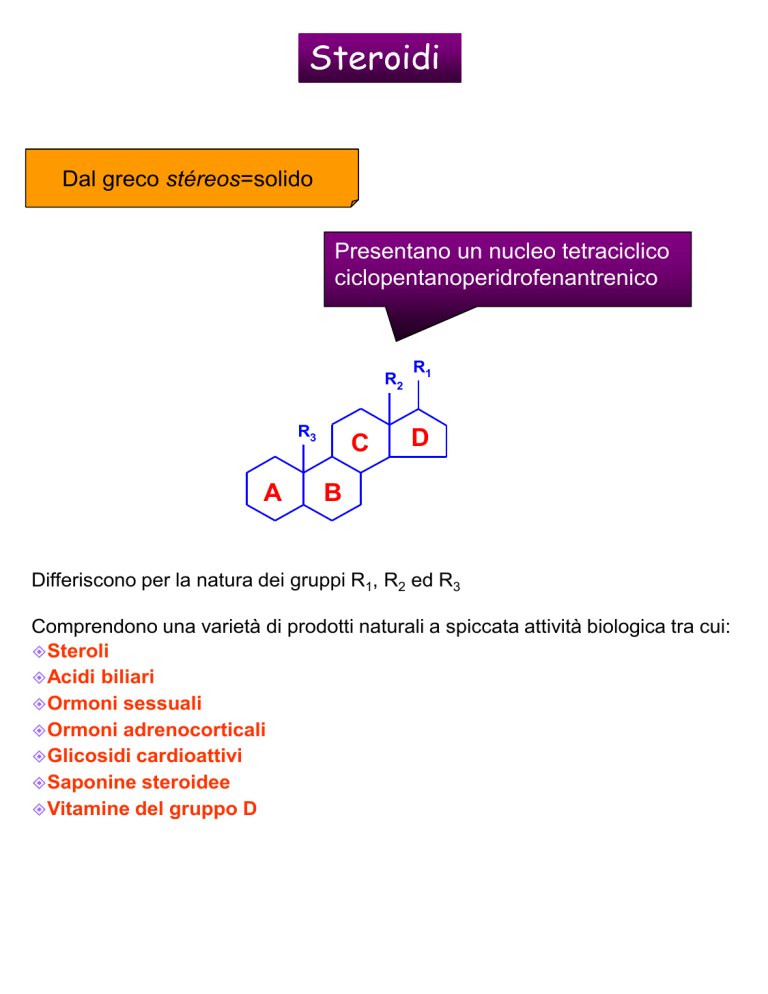
Steroidi
Dal greco stéreos=solido
Presentano un nucleo tetraciclico
ciclopentanoperidrofenantrenico
R2
R3
A
C
R1
D
B
Differiscono per la natura dei gruppi R1, R2 ed R3
Comprendono una varietà di prodotti naturali a spiccata attività biologica tra cui:
Steroli
Acidi biliari
Ormoni sessuali
Ormoni adrenocorticali
Glicosidi cardioattivi
Saponine steroidee
Vitamine del gruppo D
Nomenclatura ed aspetti stereochimici
Gli anelli della struttura base si indicano con le lettere A,B,C, D
I sistemi steroidei hanno una numerazione particolare
21
24
22
20
18
12
19
1
2
3
9
10
B
A
C
8
14
D
27
16
15
7
5
4
13
26
23
17
11
25
6
Gli anelli a sei termini o a cinque termini possono presentare
una giuntura trans oppure cis.
H
H
H
H
trans-decalina
cis-decalina
H
H
A
C
B
H
H
tutto-trans
H
D
D
C
H
A
B
H
A/B-cis
H
Nomenclatura ed aspetti stereochimici
Insaturazioni possono essere presenti in posizione 4 o 5.
L’anello A può essere aromatico.
H
A
H
D
C
B
A
B
C
H
H
H
D
H
A/B con l'insaturazione
A/B con l'insaturazione 5
H
A
C
B
D
H
H
Anello A aromatico
La stereochimica è riportata come a sulla faccia inferiore della
molecola disegnata secondo le convenzioni, mentre è riportata
come b sulla faccia superiore.
Beta
H
Alfa
H
Nomenclatura sistematica degli steroidi
E’ basata su una serie di idrocarburi capostipiti
24
24
H
H
H
H
H
H
H
H
H
H
H
Colestano
C27
Ergostano
C28
Zoosteroli
H
Colano
C24
Fitosteroli
Acidi Biliari
21
18
19
H
H
H
Pregnano
C21
Corticosteroidi e gestogeni
H
H
H
H
18
17
H
H
H
H
H
H
Androstano
C19
Estrano
C18
Androgeni
Estrogeni
Origine biosintetica degli steroidi dai triterpeni
HO
HO
H
H
Lanosterolo
Cicloartenolo
Animali
e funghi
(organismi
non fotosintetici)
Piante
(organismi fotosintetici)
R2
R3
R1
Il Colesterolo
H
H
H
•E’ il principale sterolo animale
•E’ presente in tutti i tessuti
animali come costituente delle
membrane cellulari in
particolare quelle del cervello.
HO
Si ottiene in grandi quantità dal midollo
spinale e dal cervello dei bovini o dalla
lanolina (miscela di esteri di acidi grassi
con steroli e alcoli alifatici a lunga catena ).
Utilizzato come materiali di partenza nella
sintesi parziale di farmaci steroidei.
Biosintesi del Colesterolo
Dal lanosterolo C30 a colesterolo C27
Perdita di tre gruppi metilici
Generazione di un doppio legame 5,6 al posto di un
doppio legame 8,9.
Riduzione del doppio legame in catena laterale
La sequenza di questi stadi è variabile e dipende
dal tipo di organismo coinvolto.
In genere il primo stadio è la perdita del metile sul C-14
R
14
R
R
O2
NADPH
O2
NADPH
Enz-OOH
citocromo P450
HO
CH2 OH
H
CHO
Lanosterolo (C30)
R
R
R
-HCO2H
H
CH O-H
O-O-Enz
H
O
H
O
H-
H+
O2
NADPH
R
H
Perdita dei metili sul C-4
O2
NADPH
A
HO
4
NAD+
HO
H
+O
H
O
H
HO2C
H
O
Tautomeria cheto enolica.
Il metile al C-4 assume
un’orientazione equatoriale
favorevole alla sua rimozione
HO
H
-CO2
H
H
O
NADPH
HO
H
HO
O
H
H
H
Migrazione del doppio legame 8
H+
9
5
H
8
B
H
7
6
H
NADP+
H
H+
H
H
H
H
H
-
NADP H
H
H
H
H
Riduzione del doppio legame in catena laterale 24
H+
H
25
NADPH
24
H-
H 2O
H
I Fitosteroli
Gli steroli più diffusi nella
piante , nei funghi e nella
alghe presentano sostituenti
in catena laterale alla
posizione 24.
242
241
24
I più diffusi
H
H
H
HO
Presenta una insaturazione
sulla catena laterale al C-22.
Questa caratteristica si osserva
in molti steroli delle piante, ma
mai in quelli dei mammiferi.
Campesterolo (C28)
H
H
H
H
H
H
HO
HO
Sitosterolo (C29)
Stigmasterolo (C29)
Si ritrovano in forma di alcoli liberi, ma
anche come esteri di acido palmitico, oleico,
linoleico, linolenico, come glicosidi o come
glicosidi acilati con acidi grassi.
Fonti facilmente accessibili di fitosteroli
I semi della pianta di soia contengono lo 0.2% in peso
di steroli di cui
20% stigmasterolo,
50% sitosterolo
20% campesterolo
scopi commerciali
QuestiAvengono
usati come materiale di partenza di
farmaci steroidei
Biosintesi dei Fitosteroli
Si formano dal cicloartenolo, un triterpene
C-30 attraverso meccanismi simili a quelli
che portano alla formazione del colesterolo
dal lanosterolo
In molti steroli la funzione ciclopropanica
viene persa e presentano un metile sul C-10.
Apertura anello ciclopropanico
Poiché l’orientazione b dell’H-8
non è favorevole all’apertura
dell’anello ciclopropanico si
invoca l’assistenza di un sito
nucleofilo dell’enzima che apre
l’anello sul C-9.
R
R
R
H+
H
9
H
+
Enz
8
H
:Enz
HO
HO
HO
Da notare che nelle piante la
rimozione del primo CH3 al C-4
precede la perdita del C-14a.
Biosintesi dei Fitosteroli
Alchilazione catena laterale
SAM
Ad
S +
R
Me
Me
H
24'
Ad
S
+ R
+
24
H
isomerizzazione
allilica
H
+
NADPH
NADPH
[O]
22
isomerizzazione
allilica
NADPH
22
NADPH
[O]
NH2
N
H3C +
S
O
N
N
N
HO
OH
SAM: S-adenosilmetionina
H2N
CO2H
Saponine steroidee
Una fonte
comune:
Dioscorea
(Patata dolce
americana )
Importanti materiali di
partenza per le
sintesi parziali di
farmaci steroidei
Un tipico esempio: La dioscina
O
25
H
22
D-Glc
a1
4
O
O
b1
H
H
O
a1
HO
L-Rha
O
O
H
OH
O
HO
16
H
OH
HO
2 O
Diosgenina
O
HO
L-Rha
OH
Dioscina
Hanno attività tensioattiva ed
emolitica. Sono tossici per
ingestione.
La funzione spirochetalica
si origina dalla catena
laterale del colesterolo
attraverso ossigenazioni al
C-16 e C-26
e formazione di una
funzione chetonica al C-22.
Glicosidi cardioattivi
Digitalis purpurea
Strophanthus
Presenti in piante utilizzate
come veleni ad azione rapida
(Strophanthus) o come
farmaci cardiaci (Digitalis)
Cardenolidici C-23
Due classi principali
Bufadienolidici C-24
O
O
O
O
HO
H
H
HO
H
OHC
OH
H
H
HO
OH
OH
Digossigenina
Ellebrigenina
In : Apocynaceae (Strophanthus),
In : Liliaceae, Ranuncolaceae
Liliaceae, Scrophulariaceae (Digitalis)
Anche nella pelle del rospo
Glicosidi cardioattivi
Caratteristiche strutturali
Funzione lattonica a,b insatura
O
Giunzione cis A/B e C/D
O
Dall’ossidazione
catena laterale +
AcCoA
Funzioni ossigenate al C-10
Glicosidazione OH in 3
OHC
H
H
OH
b-D-Glc-b-Glc-Cymarosio- O
OH
Gruppi OH in 3, 5 e 14
in orientazione b
K- Strofantoside
(glicoside principale dello Strophantus kombè)
La porzione zuccherina è costituita da 1 a 4 unità di
monosaccaridi spesso zuccheri rari caratteristici
di questo gruppo di composti
OH
O
HO
MeO
OH
D-Digitossosio
O
HO
O
OH
OH
OH
OH
D- Digitalosio
OMe
D-Cimarosio
Gli ecdisoni
Stimolano la muta degli insetti
OH
OH
OH
OH
HO
OH
HO
OH
HO
OH
HO
H
H
O
a Ecdisone
O
Ecdisterone
Isolati da artropodi ( e da piante)
OH
OH
Presentano:
Giunzione A/B cis;
2 OH b, 14 OH a;
Funzione 7-6-cheto.
OH
HO
OH
HO
H
Biosintetizzati dagli insetti a
partire da steroli comuni
come sitosterolo
O
Ponasteronea
Uno dei vari ecdisoni isolati da piante
Vitamine del gruppo D
TRASPOSIZIONE 1,7
SIGMATROPICA
h
H
H
H
H
H
HO
HO
7-deidrocolesterolo
OH
precolecalciferolo
APERTURA
ELETTROCICLICA
(cicloreversione)
OH
OH
[O]
H
rene
[O]
H
9
8
fegato
6
4
5
10
3
HO
HO
OH
HO
calcitriolo
calcidiolo
(1a,25-diidrossivitamina D3) (25-idrossivitamina D3)
H
7
2
1
Non è la forma
attiva
colecalciferolo
(vitamina D3)
h
H
H
H
HO
ergosterolo
HO
ergocalciferolo
(vitamina D2)
Acidi Biliari
Caratteristiche:
Scheletro colanico C-24
Giunzione A/B cis
Catena laterale C5
OH in 3a e 7a
Nella bile ed intestino in
forma di sali per
emulsionare i grassi e
facilitare la digestione
R
H2N
CONHCH2COO -Na+
CO2H
glicina
H
HO
OH
CO2H
12
H
HO
7
3
H
OH
H2N
R
H
Glicocolato di sodio
SO3H
R
taurina
CONHCH2SO3 -Na+
Acido Colico
HO
H
R
Taurocolato di sodio
Biosintesi degli acidi biliari
Nel fegato
OH
[O]
HO
OH
O
Colesterolo
OH
[H]
OH
O
OH
[O]
HO
H
OH
HO
OH
H
HSCoA
SCoA
O
O
CO2H
OH
S CoA
O
HO
H
Acido colico
+
OH
CH3CH2COSCoA
Microflora intestinale
OH
CO2H
Acido
deossicolico
HO
H
Nella bile
Ormoni steroidei
Possono essere suddivisi in:
Adrenocorticali o corticosteroidi
Prodotti nella
corteccia surrenale
Scheletro del
pregnano C21
Gestogeni
Androgeni
Glucorticoidi
Mineralcorticoidi
Prodotti nel corpo luteo
Prodotti nelle gonadi
(testicoli, ovaie)
Scheletro
dell’androstano C19
Scheletro
dell’estrano C18
Estrogeni
Biosintesi degli ormoni steroidei
Dal colesterolo via pregnenolone
e progesterone
P450ssc (P450- linked side chain
cleaving enzyme) o desmolasi
OH
OH
O
O2, NADPH
HO
HO
HO
Colesterolo
O
H
OHC
NAD+
H
HOOC
HO
O
+
Pregnenolone
O
H
H
HO
H
O
Progesterone
OH
Corticosteroidi
O
O
O2, NADPH
O
O
17-a-idrossiprogesterone
OH
O2, NADPH
O
Progesterone
OH
O2, NADPH
OH
O
OH
11
O
Desossicorticosterone
11-deossicortisolo
OH
O2, NADPH
Glucorticoidi
O
OH
O2, NADPH
O
O
HO
OH
HO
O
O
Corticosterone
Idrocortisone
(cortisolo)
OH
O
O
HO
ruolo nella sintesi
proteica dei carboidrati
e deposito glicogeno
nel fegato.
OH
OHC
OH
E’ la forma
farmacologicamente
attiva cui viene
trasformato il
cortisone nel fegato.
O
Mineralcorticoidi
O
O
Aldosterone
Aldosterone
(forma emiacetalica)
controllo del bilancio
elettrolitico; promuovono
rilascio Na+ e Cl- e
l’escrezione di K+
Gestogeni o Progestinici
O
O
Progesterone
OH
HO
H
Pregnandiolo
(un catabolita urinario)
Intervengono nella
preparazione
dell’utero per la
gravidanza;
mantengono le
condizioni
necessarie per la
gestazione
Androgeni
Enzima P450 dipendente
O
O
HO
OH
O
O
OH
Enz-OOH
Enz
O2, NADPH
HO
HO
H
17-adrossipregnenolone
Pregnenolone
O
O
NAD+
HO
O
Androstenedione
NADH
Deidroepiandrosterone
OH
Principale ormone sessuale
maschile. Responsabile dello
sviluppo e del mantenimento
delle caratteristiche sessuali
maschili.
O
Testoterone
O
HO
H
Androsterone
(un catabolita urinario)
Gli androgeni hanno anche
un’attività anabolica che
stimola la crescita delle ossa
e dei muscoli e promuove il
deposito di proteine.
Ormoni sessuali
femminili.
Responsabili delle
caratteristiche
sessuali femminili.
Con il progesterone
controllano il ciclo
mestruale. Durante la
gravidanza i livelli
aumentano
considerevolmente
(50 volte).
Estrogeni
O
O
O2, NADPH
Aromatasi
P450
O
HO
Androstenedione
NADH
Estrone
OH
OH
OH
O2, NADPH
OH
Aromatasi
HO
O
Testoterone
HO
Estradiolo
Estriolo
(catabolita urinario)
Meccanismo della reazione di ossidazione del CH3 in 10
catalizzata dall’aromatasi
HO
10
O
O
O2
NADPH
O
O
O2
NADPH
HCO2H
HO
H
O2
NADPH
O
Enz
O
O
O
H
Enz-OOH
OH
Composti ad attività estrogenica
CH3
OH
OH
O
HO
HO
H3C
O
O
Stilbestrolo
Cumestrolo
O
HO
OH
Estratti dall’erba
medica, dal
trifoglio, dalla soia
O
Daidzeina
Estrogeni sintetici
OH
OH
CH
HO
CH3O
17a-Etinilestradiolo
12 volte più efficace
dell’estradiolo
Mestranolo
Profarmaco: viene
convertito a etinilestradiolo
nel fegato